化工反应工程答案 第六章..
- 格式:doc
- 大小:175.50 KB
- 文档页数:11


第一章绪论习题1.1 解题思路:(1)可直接由式(1.7)求得其反应的选择性(2)设进入反应器的原料量为100 ,并利用进入原料气比例,求出反应器的进料组成(甲醇、空气、水),如下表:组分摩尔分率摩尔数根据式(1.3)和式(1.5)可得反应器出口甲醇、甲醛和二氧化碳的摩尔数、和。
并根据反应的化学计量式求出水、氧及氮的摩尔数,即可计算出反应器出口气体的组成。
习题答案:(1) 反应选择性(2) 反应器出口气体组成:第二章反应动力学基础习题2.1 解题思路:利用反应时间与组分的浓度变化数据,先作出的关系曲线,用镜面法求得反应时间下的切线,即为水解速率,切线的斜率α。
再由求得水解速率。
习题答案:水解速率习题2.3 解题思路利用式(2.10)及式(2.27)可求得问题的解。
注意题中所给比表面的单位应换算成。
利用下列各式即可求得反应速率常数值。
习题答案:(1)反应体积为基准(2)反应相界面积为基准(3)分压表示物系组成(4)摩尔浓度表示物系组成习题2.9 解题思路:是个平行反应,反应物A的消耗速率为两反应速率之和,即利用式(2.6)积分就可求出反应时间。
习题答案:反应时间习题2.11 解题思路:(1)恒容过程,将反应式简化为:用下式描述其反应速率方程:设为理想气体,首先求出反应物A的初始浓度,然后再计算反应物A的消耗速率亚硝酸乙酯的分解速率即是反应物A的消耗速率,利用化学计量式即可求得乙醇的生成速率。
(2)恒压过程,由于反应前后摩尔数有变化,是个变容过程,由式(2.49)可求得总摩尔数的变化。
这里反应物是纯A,故有:由式(2.52)可求得反应物A的瞬时浓度,进一步可求得反应物的消耗速率由化学计量关系求出乙醇的生成速率。
习题答案:(1)亚硝酸乙酯的分解速率乙醇的生成速率(2)乙醇的生成速率第三章釜式反应器习题3.1 解题思路:(1)首先要确定1级反应的速率方程式,然后利用式(3.8)即可求得反应时间。
(2)理解间歇反应器的反应时间取决于反应状态,即反应物初始浓度、反应温度和转化率,与反应器的体积大小无关习题答案:(1)反应时间t=169.6min.(2)因间歇反应器的反应时间与反应器的体积无关,故反应时间仍为169.6min.习题3.5 解题思路:(1)因为B过量,与速率常数k 合并成,故速率式变为对于恒容过程,反应物A和产物C的速率式可用式(2.6)的形式表示。

第一章(摩尔衡算)作业答案:P1-11A 在一个连续流动的反应器中反应:AB等温进行,计算当进料的摩尔流率为5mol/h, 假设反应速率-r A 为: (a ) -r A =k , k=0.05mol/h.L 时 (b ) -r A =kC A , k=0.0001s -1 时 (c ) -r A =kC A 2, k=3 L/mol.h 时消耗99%的组分A (即C A =0.01C A0)时,对CSTR 和PFR 反应器需要的反应器体积。
进料的体积流量为10L/h 。
[注意:F A =C A v 。
当体积流量恒定时,v=v 0, 因此,F A =C A v 0。
故C A0=F A0/v 0=(5 mol/h )/(10L/h)=0.5mol/L 。
] 解:(a )在CSTR 中,组分A 的摩尔平衡方程为:Ao AAF F V r -=- 00.0110/0.5/0.990.99990.05/.--⨯====⨯=Ao A Ao A Ao C v C v C v C v vC L h mol LV L k k k mol h L对PFR ,组分A的摩尔平衡方程为:A A dFr dV=摩尔流率与体积流率之间的关系:A A F C v = 由于体积流率v 恒定,故有:A A A dF dC v dCv dV dV dV== 对零级不可逆反应,反应速率可写为:A r k -= 将r A 代入方程得到:AA dC vr k dV==- 整理得:A vdC dV k-=反应器入口的条件:当V=0 时 C A =C A0对上式子积分:0AA C VA C v dC dV k -=⎰⎰给出方程:0()A A vV C C k=- 将C A0、C A 、v 和k 的数值代入方程,得:10/(10.01)0.5/990.05/=-⨯=⋅L hV mol L L mol h L(b )在CSTR 中,组分A 的摩尔平衡方程为:Ao AAF F V r -=- 0100.0110/999927500.010.00013600---====⨯=⨯⨯⨯Ao A Ao A A A C v C v C v C v v L hV L kC k C k h根据(a )中PFR 的求解方法,得出一级不可逆反应的V 的表达式:0ln A Av C V k C = 将C A0、C A 、v 和k 的数值代入方程,得到:110/1ln 127.90.000136000.01-==⨯L h V L h (c )在CSTR 中,组分A 的摩尔平衡方程为:Ao AAF F V r -=- 00022000.0110/9900990066000(0.01)3/0.5/--====⨯=⨯⋅⨯AA A A A A A C v C v C v C v v L hV L kC k C kC L mol h mol L 根据(a )中PFR 的求解方法,得出二级不可逆反应的V 的表达式:011()A A v V k C C =- 将C A0、C A 、v 和k 的数值代入方程,得到:10/11()6603/0.50.010.5=-=⋅⨯L h V L L mol h第二章(转化率和反应器尺寸)作业答案:在体积为2.5 m 3的理想BR 中进行液相反应:A B P +→,反应温度维持在75℃,实验测定反应速率方程为:A A B r k C C -=,32.7810/.-=⨯k l mol s ,004/==A B C C mol l ,0684/min =A F mol求:(1)反应器中A 的转化率达80%时所需的时间。
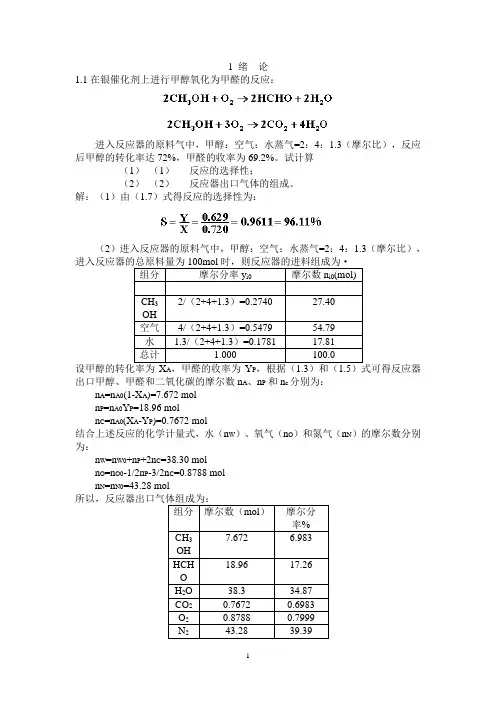
1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),组分摩尔分率y i0 摩尔数n i0(mol)CH32/(2+4+1.3)=0.2740 27.40OH空气4/(2+4+1.3)=0.5479 54.79水 1.3/(2+4+1.3)=0.1781 17.81总计 1.000 100.0A P出口甲醇、甲醛和二氧化碳的摩尔数n A、n P和n c分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol结合上述反应的化学计量式,水(n W)、氧气(n O)和氮气(n N)的摩尔数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol组分摩尔数(mol)摩尔分率%7.672 6.983CH3OH18.96 17.26HCHOH2O 38.3 34.87CO2 0.7672 0.6983O2 0.8788 0.7999N2 43.28 39.392 反应动力学基础2.4在等温下进行液相反应A+B→C+D,在该条件下的反应速率方程为:若将A和B的初始浓度均为3mol/l的原料混合进行反应,求反应4min时A的转化率。
解:由题中条件知是个等容反应过程,且A和B的初始浓度均相等,即为1.5mol/l,故可把反应速率式简化,得由(2.6)式可知代入速率方程式化简整理得积分得解得X A=82.76%。
2.6下面是两个反应的T-X图,图中AB是平衡曲线,NP是最佳温度曲线,AM是等温线,HB是等转化率线。





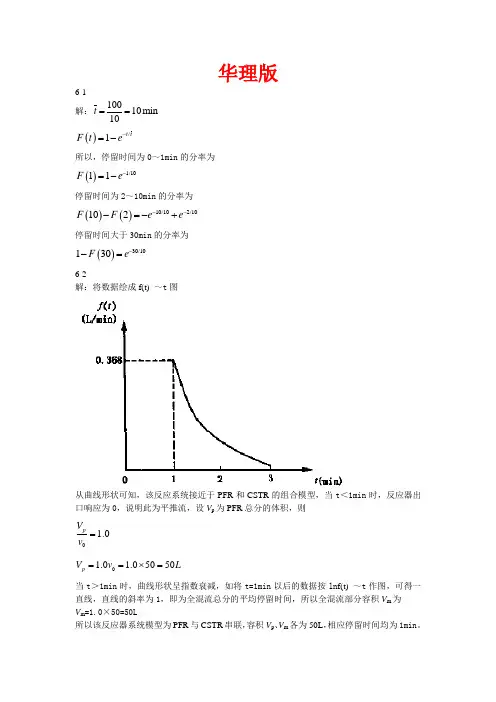
华理版6-1 解:10010min 10t == ()/1t t F t e -=-所以,停留时间为0~1min 的分率为()1/1011F e -=-停留时间为2~10min 的分率为()()10/102/10102F F e e ---=-+停留时间大于30min 的分率为()30/10130F e --=6-2解:将数据绘成f(t) ~t 图从曲线形状可知,该反应系统接近于PFR 和CSTR 的组合模型,当t <1min 时,反应器出口响应为0,说明此为平推流,设V p 为PFR 总分的体积,则0 1.0pV v =01.0 1.05050p V v L ==⨯=当t >1min 时,曲线形状呈指数衰减,如将t=1min 以后的数据按ln f(t) ~t 作图,可得一直线,直线的斜率为1,即为全混流总分的平均停留时间,所以全混流部分容积V m 为 V m =1.0×50=50L所以该反应器系统模型为PFR 与CSTR 串联,容积V p 、V m 各为50L ,相应停留时间均为1min 。
6-3解:CSTR中均相二级反应00c c ====0.435 即转化率为0.565CSTR 中固相二级反应:0100011i c k c e e c c k c k τττ⎛⎫=∙ ⎪⎝⎭6-4 解:()()000c t c f t dt c c ∞=⎰ 根据动力学方程可知,()21/200022c t c kt c c ⎛⎫-= ⎪⎝⎭,f(t)=0.5 代入已知条件,()21/200022c t c kt c c ⎛⎫-= ⎪⎝⎭= ()21t - ()()000c t c f t dt c c ∞=⎰=()2201t dt -⎰=0.667 所以转化率为A x =1-0.667=0.3336-5解:(1)由图知,反应器为通过一PFR 反应器和一全混釜反应器,0.4P ks τ=,求()dF t dt ,再取对数,用ln f(t) ~t 作图,可得一直线,斜率为1.25,所以0.8m ks τ=,平均停留时间为1.2ks 。

《化学反应工程》第三版(陈甘堂著)课后习题答案第二章均相反应动力学基础2-4三级气相反应2NO+O22NO2,在30℃及1kgf/cm2下反应,已知反应速率常数2kC=2.65×104L2/(mol2 s),若以rA=kppApB表示,反应速率常数kp应为何值?解:原速率方程rA=dcA2cB=2.65×104cAdt由气体状态方程有cA=代入式(1)2-5考虑反应A课所以kp=2.65×104×(0.08477×303) 3=1.564后当压力单位为kgf/cm2时,R=0.08477,T=303K。
答p p 2rA=2.65×10 A B =2.65×104(RT) 3pApBRT RTp表示的动力学方程。
解:.因,wwnAp=A,微分得RTVdaw案24网pAp,cB=BRTRT3P,其动力学方程为( rA)=dnAn=kA。
试推导:在恒容下以总压VdtVδA=3 1=21dnA1dpA=VdtRTdt代入原动力学方程整理得wdpA=kpAdt设初始原料为纯A,yA0=1,总量为n0=nA0。
反应过程中总摩尔数根据膨胀因子定义δA=n n0nA0 nA若侵犯了您的版权利益,敬请来信通知我们!Y http://.cn.co(1)mol/[L s (kgf/cm2) 3]m(1)则nA=nA01(n n0)δA1(P P0)δA(2)恒容下上式可转换为pA=P0所以将式(2)和式(3)代入式(1)整理得2-6在700℃及3kgf/cm2恒压下发生下列反应:C4H10发生变化,试求下列各项的变化速率。
(1)乙烯分压;(2)H2的物质的量,mol;(3)丁烷的摩尔分数。
解:P=3kgf/cm2,(1)课MC4H10=58,(2)w.krC2H4=2( rC4H10)=2×2.4=4.8kgf/(cm2 s)PC4H10=PyC4H101 dpC4H10= P dt2.4-1==0.8 s 3w(3)nC4H10=nyC4H10=n0(1+δC4H10yC4H10,0xC4H10)yC4H10dnH2dtdnH2dt=hdaw后n0=nC4H10,0=δC4H10rC4H10=反应开始时,系统中含C4H*****kg,当反应完成50%时,丁烷分压以2.4kgf/(cm2 s)的速率dyC4H10dt答1rCH=2.4224wdnC4H10dt案116×1000=2000mol582+1 1==21网dyC4H10=n0(1+δC4H10yC4H10,0xC4H10) dt=2000×(1+2×1×0.5)×0.8=3200 mol/s若侵犯了您的版权利益,敬请来信通知我们!Y http://.cno2C2H4+H2,dP=k[(δA+1)P0 P]=k(3P0 P)dtm(3)dpA1dP= dtδAdt2-9反应APS,( r1)=k1cA , ( r2)=k2cp,已知t=0时,cA=cA0 ,cp0=cS0=0, k1/k2=0.2。
反应工程第一章:1:反应物的化学计量系数为负值,反映产物则为正值。
2:任何反应组分和其化学计量系数之比为反映进度ξ(永远为正值)。
3:转化率X 对应反应物,收率Y 对应反应产物。
4:选择性S :Y=SX 。
5:化学反应器的类型: 管式反应器 釜式反应器 塔式反应器 固定床反应器 流化床反应器 移动床反应器 滴流床反应器 6:化学反应器的操作方式: 间歇操作 连续操作半间歇(半连续)操作 7:反应器设计的基本方程:描述浓度变化的物料衡算式(连续方程) 描述温度变化的能量衡算式(能量方程) 描述压力变化的动量衡算式 描述器内反应速率(动力学方程) 计算某些参数(参数计算式) 8:守恒定律:输入=输出+消耗+积累第二章:1:反应速率恒为正值ξνννννν=-=-=-=---RR R B B B A A A R B A R R B B A A n n n n n n n n n n n n 000000::)(:)(:)(即:ξνi i i n n =-0普遍化:∑==-Mj jij i i n n 10ξν对多个反应:该反应物的起始量某一反应物的转化量=X 0i i n X ξν-=关键组分的起始量反应产物的生成量R A R Y νν=已转化的关键组分量关键组分量生成目的产物所消耗的=S 关键组分的起始量关键组分量生成某一产物所消耗的或:=Y r Rr r r RBBAA常数==-=-νννdtdn V r i i ν1=dtd V r ξ1=2:恒容过程:3:流动体系:4:多相反应系统反应速率表示形式:以相界面积定义反应速率:以催化剂重量定义反应速率:对于采用固体催化剂的反应:5:反应速率方程:基元反应:非基元反应:反应机理未知:幂函数形速率方程:可逆反应:6:正逆反应活化能的关系:7:可逆放热反应的最佳反应温度:dt dc r A A -=rAA dV dF r -=dadF r AA-='dWdF r AA -=''Ab A V A r r a r '''ρ==BA BA A c kc r νν=8:复合反应的基本类型:并列反应平行反应浓度高有利于反应级数大的反应温度升高有利于活化能大的反应连串反应9:反应速率方程的变换与积分、第三章:1:釜式反应器特征:反应器内各处温度和浓度均一且与出口一致2:物料衡算式:1:连续釜式反应器:2:间歇釜式反应器:3:等温间歇釜式反应器的计算(单一反应):1:反应时间:2:反应体积:3:反应器体积:1:平行反应:解:2:连串反应:解:以目的产物P 的收率最大为优化目标可得最佳反应时间:5:连续釜式反应器的反应体积:6:空时与空速的概念: 1:空时:(因次:时间) 2:空速: 空速的意义:单位时间单位反应体积所处理的物料量。
化学反应⼯程练习题解答20页第⼀章习题1有⼀反应在间歇反应器中进⾏,经过8min后,反应物转化掉80%,经过18min后,转化掉90%,求表达此反应的动⼒学⽅程式。
解2在间歇搅拌槽式反应器中,⽤醋酸与丁醇⽣产醋酸丁酯,反应式为:反应物配⽐为:A(mol):B(mol)=1:4.97,反应在100℃下进⾏。
A转化率达50%需要时间为24.6min,辅助⽣产时间为30min,每天⽣产2400kg醋酸丁酯(忽略分离损失),计算反应器体积。
混合物密度为750kg·m-3,反应器装填系数为0.75。
解3反应(CH3CO)2O+H2O→2CH3COOH在间歇反应器中15℃下进⾏。
已知⼀次加⼊反应物料50kg,其中(CH3CO)2O的浓度为216mol·m-3,物料密度为1050kg·m-3。
反应为拟⼀级反应,速率常数为k=5.708×107 exp(?E/RT) min-1,E=49.82kJ·mol-1。
求x A=0.8时,在等温操作下的反应时间。
解4在555K及0.3MPa下,在平推流管式反应器中进⾏⽓相反应A→P,已知进料中含A 30%(摩尔分数),其余为惰性物料,加料流量为 6.3mol·s-1,动⼒学⽅程式为?r A=0.27c A mol·m-3s-1为了达到95%转化率,试求:(1)所需空速为多少?(2)反应器容积⼤⼩?解5反应A+B→R+S,已知V R=0.001m3,物料进料速率V0=0.5×10-3m3min-1,c A0=c B0=5mol·m3,动⼒学⽅程式为?r A=kc A c B,其中k=100m3kmol-1min-1。
求:(1)反应在平推流反应器中进⾏时出⼝转化率为多少?(2)欲⽤全混流反应器得到相同的出⼝转化率,反应器体积应多⼤?(3)若全混流反应器体积V R=0.001m3,可达到的转化率为多少?已知k=1m3kmol-1hr-1,c B0=3kmol·m-3,c A饱和=0.02kmol·m-3,⽔溶液流量为10m3hr-1。
第一章1. Fogler 《化学反应工程》(英文版)Page 31,P1-11B.解:摩尔衡算:0Vj j j j dN F F r dV dt-+=⎰C :the corn steep liquor ;R :RNA ;P :penicillin.假设细胞为全混釜反应器,C 完全反应,R 不排出反应器,P 全部排出反应器 在非稳态操作条件的摩尔平衡:(质量平衡类似,将各量表示成以质量为基准就行)0C F =,0CdN dt=,00C C F r V += 00R F =,0R F =,R R dN r V dt=0P F =,0CdN dt=,0P P F r V -+=2. Fogler 《化学反应工程》(英文版)Page 33,P1-15B.解:由题目给出的条件可知,对于A B →的反应F A0=5 mol/h ,v 0=10 L/h ,C A0=0.5 mol/L对于CSTR : 摩尔衡算:0A AAF F V r -=- 动力学:(1)A r k -=(2)A A r kC -=(3)2A A r kC -=摩尔流率与浓度关系:000A A F C v =0A A A F C v C v ==浓度为变量的摩尔衡算方程:00000A A A AA AC v C v C C V v r r --==--当消耗99%的组分A 时,00.01A A C C =,代入上式可得:000000.010.99A A A A AC C C V v v r r -==--代入动力学: (1)00000.990.99A A A C C V v v r k==- 代入数据得到:V=99 L (2)000000000.990.990.9999(0.01)A A A A A A C C C v V v v v r kC k C k====- 代入数据得到:V=2750 L (3)000000022000.990.990.999900(0.01)A A A A A A A C C C v V v v v r kC k C kC ====- 代入数据得到:V=66000 L对于PFR : 摩尔衡算:AA dF r dV= 动力学:(1)A r k -=(2)A A r kC -=(3)2A A r kC -=摩尔流率与浓度关系:000A A F C v =0A A A F C v C v ==浓度为变量的摩尔衡算方程:0()A A d C v r dV= 0AAdC dV v r = 00AA C AC AdC V v r =⎰代入动力学: (1)000000000000.99()(0.01)AA A A C C A AA A A A A C C A v v v dC dC V v v C C C C C r k k k k ===-=-=-⎰⎰ 代入数据得到:V=99 L (2)00000000ln ln ln1000.01AA C A A AC A A A v C v C v dC V v kC k C k C k ====-⎰代入数据得到:V=127.9 L (3)000020001111()()0.01AA C A C AA A A A v v dC V v kC k C C k C C ==-=--⎰ 代入数据得到:V=660 L 对于BR : 摩尔衡算:AA dN r V dt= 动力学:(1)A r k -=(2)A A r kC -=(3)2A A r kC -=浓度为变量的摩尔衡算方程:AA C A A C dC dt r =⎰代入动力学: (1)000.001A A C C t k-=代入数据得到:t=9.99h (2)001ln0.001A A C t k C =代入数据得到:t=19.2h (3)00111()0.001A A t k C C =- 代入数据得到:t=666h3. Fogler 《化学反应工程》(中文版)Page 23,P1-12C.解:由题目条件可知,反应A B C →+,在恒体积、等温、完全混合的间歇釜中进行,且V=20 L ,N A0=20 mol ,C A0=N A0/V=1 mol/L (1) 摩尔衡算:AA dN r V dt= 动力学:A A r kC -=物质量与浓度的关系:A A N C V =浓度为变量的摩尔衡算方程:()A A d C V r V dt= A A dC V r V dt=AA dC dt r =0AA C AC AdC t r =⎰代入动力学:001ln AA C A A C A A C dC t kC k C ==-⎰代入数据得:t=7.99 min(2) 摩尔衡算:AA dN r V dt= 动力学:2A A r kC -=物质量与浓度的关系:A A N C V = 浓度为变量的摩尔衡算方程:()A A d C V r V dt= A A dC V r V dt=AA dC dt r =0AA C AC AdC t r =⎰代入动力学:020111()AA C A C AA A dC t kC k C C ==--⎰ 代入数据得:t=9.5 min(3)假设反应气体为理想气体: 状态方程:PV NRT =00208.31440033256000.02N RT P Pa Pa V ⨯⨯=== 408.31440066512000.02t t N RT P Pa Pa V ⨯⨯===第二章1. 在一个恒体积的间歇反应器中进行液相等温不可逆反应:A B →若反应为二级、一级、零级均相反应,分别求出转化率由0至0.9所需时间与转化率由0.9至0.99所需时间之比。
6.多相系统中的化学反应与传递现象6.1、在半径为R 的球形催化剂上,等温进行气相反应⇔A B 。
试以产物B 的浓度C B 为纵座标,径向距离r 为横座标,针对下列三种情况分别绘出产物B 的浓度分布示意图。
(1) (1) 化学动力学控制 (2) (2) 外扩散控制(3) (3) 内、外扩散的影响均不能忽略图中要示出C BG ,C BS 及C Be 的相对位置,它们分别为气相主体、催化剂外表面、催化剂颗粒中心处B 的浓度,C Be 是B 的平衡浓度。
如以产物A 的浓度CA 为纵座标,情况又是如何?解(1)以产物B 的浓度为纵座标(2)以产物A 的浓度为纵座标6.2 已知催化剂颗粒外表面的气膜传热系数为117w/m 2K,气体的密度和热容分别为0.8kg/m 3和2.4J/kgK,试估算气膜的传质系数. 解:-=====⨯⨯=⨯=2/3321/(/)(/Pr),/Pr 1/117/0.8 2.410 6.09410/219.4/D H G p s c c G s p J J k C h S S k h C m s m hρρ又6.3 某催化剂,其真密度为3.60g/cm3,颗粒密度为1.65g/cm3,比表面积为100m2/g.试求该催化剂的孔容,孔隙率和平均孔半径. 解:=-=<>=<>====3(1),0.5422/,65.6/0.542/1.650.328/p t p p a p r p a g p p r S r AV cm g ρρεεερερ由得由得由催化剂6.4 已知铁催化剂的堆密度为 2.7g/cm 3, 颗粒密度为 3.8 g/cm 3,比表面积为16m 2/g,试求每毫升颗粒和每毫升床层的催化剂表面积. 解:==2260.8/43.2/p g g S m ml S m mlρρb 每毫升颗粒的表面积=每毫升床层的表面积=6.5 试推导二级反应和半级反应的扩散有效因子表达式(6.23)和(6.24). 解:(1)二级反应,()()(()=-=-==-±=⎡⎤=-±⎣⎦=-2222222,,/2/1/21,/A w AS G m AG AS w ASG m w w AS w AGG m w AG w AG G mR k C k a C C k C k a k k C k C k a k C k C k a αηA S x 由上解得:C 按定义此即(6.23)式式中D a=(2)半级反应()(=-=-==-±==-+⎛=-+=+- ⎝1/21/21/21/21/21/21/221/2,(),/2/(2122A w AS G m AG AS w AS AS w G m w AS w AGw G m AGR k C k a C C k C C k k a k C k C k k a C Da Da αηx 由上解得:按定义:-⎡+⎢=-⎢⎢⎣⎡⎤⎛+⎢⎥ =-⎢⎥ ⎢⎥⎝⎣⎦=1/221/221/222212(6.24),:/w AG G mDa Da Da k C k a 此即式式中6.6 在充填ZnO-Fe2O3催化剂的固床反应器中,进行乙炔水合反应:+→++2223322232C H H O CH COCH CO H已知床层某处的压力和温度分别为0.10Mpa,400℃,气相中C 2H 2含量为3%(mol),该反应速率方程为r=kC A ,式中C A 为C 2H 2的浓度,速率常数k=7.06×107exp(-61570/RT),h -1,试求该处的外扩散有效因子.数据:催化剂颗粒直径0.5cm,颗粒密度1.6g/cm 3,C 2H 2扩散系数7.3×10-5m 2/s,气体粘度2.35×10-5Pa ﹒s,床层中气体的质量流速0.2kg/m 2s. 解:由已知条件可得()()---=⋅=⨯⨯=⨯+⨯=+===⨯⨯⨯===-=⨯⨯2530.359552/370.24/Re 0.0050.24/2.351051.06260.03180.972730.3303/22.44002730.357/(Re )0.24852.3510/(0.33037.310)0.97460.1837/()615707.0610exp 8.314673D b c G D c G kg m skg m j S Gk j m s S k ρερ()-⎡⎤= = ⎢⎥⎣⎦==⨯ ⋅⎡⎤=⨯=⎢⎥⎣⎦332221174.6/0.3263//0.203910/10.005/(0.005)16000.756w p m l h l s k k m kg sa m ρππ====+/0.0014810.99851w G m Da k k a Daπη6.7实验室管式反应器的内径2.1cm,长80cm ,内装直径6.35mm 的银催化剂进行乙烯氧化反应,原料气为含乙烯 2.25%(mol)的空气,在反应器内某处测得P=1.06×105Pa,T G =470K,乙烯转化率35.7%,环氧乙烷收率23.2%,已知+→ =-⨯ +→+ =-⨯ 42422412462422222419.6110/232 1.2510/C H O C H O H J molC H C H O CO H O H J molC H ∆∆颗粒外表面对气相主体的传热系数为58.3w/m 2K,颗粒密度为1.89g/cm 3.设乙烯氧化的反应速率为 1.02×10-2kmol/kg ﹒h,试求该处催化剂外表面与气流主体间的温度差. 解:()-= ⋅⎛⎫-=-+--=⨯ ⎪⎝⎭= ⋅=⨯⋅⋅=== -=--= 512252223()10.2/23.223.2()()1 5.00110/35.735.758.3/ 2.09910/0.50/16()()/48.59A r s ppm p pp p g G A r s m R mol kg h H H H J mol h w m k J m K h S d a m kgV d T T R H h a Kπρπρ∆∆∆∆6.8 一级连串反应:−−→−−→12A B C在0.1Mpa 及360℃下进行,已知k 1=4.368 s -1,k 2=0.417 s -1,催化剂颗粒密度为1.3g/cm 3,(k G a m )A 和(k G a m )B 均为20cm 3/g ﹒s.试求当C BG /C AG =0.4时目的产物B 的瞬时选择性和外扩散不发生影响时的瞬时选择性.解:外扩散无影响时,由(6.35)式得:⨯'=-=0.41730.410.96184.368S外扩散有影响时,由(6.34)式得:⨯=-=+10.41730.4(1.168)0.940310.01605 4.368(1.01605)S上式中所用的====1122/0.168/0.01605a G ma G mk D k a k D k a ρρ6.9 在Pt/Al 2O 3催化剂上于200℃用空气进行微量一氧化碳反应,已知催化剂的孔容为0.3cm 3/g,比表面积为200m 2/g,颗粒密度为1.2g/cm 3,曲节因子为3.7.CO-空气二元系统中CO 的正常扩散系数为0.192cm 2/s.试求CO 在该催化剂颗粒中的有效扩散系数.(----=== ===≥=⨯⨯=⨯ ==⨯ 53822322/30,10,0.36/216.610,,:9.7103010 1.19610// 1.16410/g gp g p a k k p V S A cm V r D cm sDe D cm sλερλετa 解:r 为努森扩散故有6.10 试推导球形催化剂的内扩散有效因子表达式(6.60). 解:==-=-+2222223,:1122A A A C u dC du udr r dr rd C d u du udr r dr r dr r 令可得用以上各式对教材中(6.55)式进行变量置换得:= =2222p d u b u drb k De式中 (A)(A) (A) 式为二阶常系数齐次微分方程,边界条件:r=0 du/dr=0; r=R p u=C AS R p (B) 结合边界条件(B)式解(A)得:= sinh()()sinh()p A ASp R br C C C r bR有内扩散影响时的反应速率为:()=-= 24()p AA pr R dC R De R D dr π ()=⎛⎫-=-⎪⎝⎭(),():114tanh p A r R A p s AS s s dCC D drR R C De πφφφ由式求出代入式得按内扩散有效因子的定义:⎛⎫⎛⎫=-=- ⎪ ⎪⎝⎭⎝⎭3411311()3tanh tanh 4p s AS s s s s s p p ASR C De E R k C πφηφφφφφπ==s p bR R φ式中==⎛⎫=- ⎪⎝⎭/3():111()tanh(3)3s E F φφηφφφ若令则式可改写为(F)即为教材(6.60)式,(E)式是(6.60)的又一形式.6.11 在球形催化剂上进行气体A 的分解反应,该反应为一级不可逆放热反应.已知颗粒直径为0.3cm,气体在颗粒 中有效扩散系数为 4.5×10-5m 2/h,颗粒外表面气膜传热系数为44.72w/m 2﹒K,气膜传质系数为310m/h,反应热效应为-162kJ/mol,气相主体A 的浓度为0.20mol/l,实验测得A 的表观反应速率为1.67mol/minl, 试估算:(1) (1) 外扩散阻力对反应速率的影响; (2) (2) 内扩散阻力对反应速率的影响; (3) (3) 外表面与气相主体间的温度差. 解:--=⋅=⨯⋅⨯⨯==⨯<*53331.67/min 1.00210/(1)31.671060.8081100.150.2(310/60),.AAG G R mol l mol m h L C k *A 判别外扩散阻力的影响用(6.79)式:R 故仅从传质考虑外扩散影响可不计==*2(2)(6.82),:2.783s A s AGR L DeC φφ判别内扩散阻力的影响用式先求出====2, 2.783,(6.60) 3.1,0.288,s s φηφφφη因有从可借助式估算出由此可知内扩散阻力影响严重.(3)计算外表面与气相主体间温度差⊿Tm : =-=⋅⋅⋅*)/m G s A s T T T R h ∆∆r 颗粒体积(H 颗粒外表面积=50.4K6.12 在固体催化剂上进行一级不可逆反应→ ()A B A已知反应速率常数k,催化剂外表面积对气相的传质系数为k G a m ,内扩散有效因子η.C AG 为气相主体中组分A 的浓度. (1)试推导:()()-=+11AG A G mC R B k k a η(2)若反应式(A)改为一级可逆反应则相应的(B)式如何?解:(1)一级不可逆反应A B:()()()()-=-==+==+/1A G AG AS m G m AG G m AG G m R k C C a k k a C k k a C k k a kηηηηA S A S A A S C 由上可解得:C 解得:-RC(2)一级可逆反应:AB()()()()()()()()-=-=+-+=+--=+-=++:11A G m AG AS AS Ae G m AG AeG m AG AS A AS Ae G mR k a C C k k C C k a C kC k a kC C R k k C C k a k k ηηηηηA S 由解得:C 则有6.13 在150℃,用半径100μm 的镍催化剂进行气相苯加氢反应,由于原料中氢大量过剩,可将该反应按一级(对苯)反应处理,在内,外扩散影响已消除的情况下,测得反应速率常数k p =5min -1, 苯在催化剂颗粒中有效扩散系数为0.2cm 2/s,试问:(1) (1) 在0.1Mpa 下,要使η=0.8,催化剂颗粒的最大直径是多少?(2) (2) 改在2.02Mpa 下操作,并假定苯的有效扩散系数与压力成反比,重复上问的计算.(3) (3) 改为液相苯加氢反应,液态苯在催化剂颗粒中的有效扩散系数10-5cm 2/s.而反应速率常数保持不变,要使η=0.8,求催化剂颗粒的最大直径. 解:()==⎛⎫- ⎪ ⎪⎝⎭(1)0.107611tanh 33pd φηφφφ1由(6.60)式=用试差法从上二式可解得当η=0.8时,需d p <6.36cm(2)2.02Mpa 时,De ≈0.2×0.101/2.02=0.01 cm 2/s,与此相对应:==0.418pd φ同上法可求得当η=0.8时,需d p <1.42cm(3)液相反应时,De=1×10-6cm 2/s,与此相应的φ为21.51dp,同上法可求得当η=0.8时,需d p <0.0142cm.6.14 一级不可逆反应A B,在装有球形催化剂的微分固定床反应器中进行温度为400℃等温,测得反应物浓度为0.05kmol/m 3时的反应速率为 2.5 kmol/m 3床层﹒min ,该温度下以单位体积床层计的本征速率常数为k v =50s -1 ,床层孔隙率为0.3,A 的有效扩散系数为0.03cm 2/s,假定外扩散阻力可不计,试求:(1) (1) 反应条件下催化剂的内扩散有效因子 (2) (2) 反应器中所装催化剂颗粒的半径()===== --==-==⨯⨯ ⋅3171.43/18.13500.05/p v B B B vv v p B pA v AS V k V V V k k k l s V V V d R k C kmol s m εεφηηp p 解:k k 床层实验测得(-R A )=0.0417 kmol/s ﹒m 3床层,解上二式得η=0.0167,可见内扩散影响严重.由η=1/φ=1/8.13dp=0.0167,可解出dp=7.38cm,即反应器所装催化剂的颗粒 半径为3.69cm.6.15 在0.10Mpa,530℃进行丁烷脱氢反应,采用直径5mm 的球形铬铝催化剂,此催化剂的物理性质为:比表面积120m 2/g,孔容0.35cm 3/g,颗粒密度1.2g/cm 3,曲节因子 3.4.在上述反应条件下该反应可按一级不可逆反应处理,本征反应速率常数为0.94cm 3/gs,外扩散阻力可忽略,试求内扩散有效因子.解:丁烷分子量为58,λ=10-5cm,<ra>=2Vg/Sg=58.3×10-8cm, λ/2<ra>=8.576,此值与10接近,故可近似扩散是以奴森扩散为主:--=⨯⨯=⨯22970058.310 2.10410/k D cm s-==⨯==32/ 2.610/1.736k p m De D cm s ετφ由(6.60)式算得η=0.465.6.16 在固定床反应器中等温进行一级不可逆反应,床内填充直径为6mm 的球形催化剂,反应组分在其中的扩散系数为0.02cm 2/s,在操作温度下,反应式速率常数等于0.01min -1,有人建议改有3mm 的球形催化剂以提高产量,你认为采用此建议能否增产?增产幅度有多大?假定催化剂的物理性质及化学性质均不随颗粒大小而改变,并且改换粒度后仍保持同一温度操作.解:=======0.6,0.02887,0.9995,0.3,0.01444,0.9998p p d cm d cm φηφη故采用此建议产量的增加是很有限的.6.17 在V 2O 5/SiO 2催化剂上进行萘氧化制苯酐的反应,反应在 1.013×105Pa 和350℃下进行,萘-空气混合气体中萘的含量为0.10%(mol),反应速率式为:⎛⎫=⨯-⋅ ⎪⎝⎭50.381353603.82110exp ,/A A r p kmol kg hRT式中PA 为萘的分压,Pa.已知催化剂颗粒密度为1.3g/cm 3,颗粒直径为0.5cm,试计算萘氧化率为80%时萘的转化速率(假定外扩散阻力可忽略),有效扩散系数等于3×10-3cm 2/s.解:因外扩散阻力可不计,故C AS ≈C AG , ()-= ⋅0.38/A p AGR k C kmol kg h η式中η由教材(6.66)式计算,为此先计算以下数据:--==⨯⎛⎫=⨯-⋅ ⎪⎝⎭⎛⎫ =⨯-⋅ ⎪⎝⎭13250.3850.383/12,310/,1353603.8210exp /1353603.8210exp /p p p AGp AG a V cm De cm s k p kmol kg h RT p kmol m h RT ρA 的值由:r 颗粒将此P AG =C AG RT,ρp =1300kg/m 3颗粒,T=(350+273)K 代入上式,并将小时换为秒计则得:-=⨯⋅40.3832.19610/A AG r C kmol m s 颗粒由上式得 k p =2.196×10-4又:C AS =C AG =P AG /RT=105×0.1%(1-0.8)/(8314×623)=3.861×10-6 kmol/m 3 将有关数值代入(6.66)式得:()()()()--=====⨯==⨯⎰⎰⎰1/20.3831/20.381/24] 1.12:8.76910[][] 1.566310ASACASACAS C A A C C AS AG AGA A C C A A a f C dC f C f C C f C dC C dC η式中最后得萘氧化率为80%时的萘的转化速率为: ()--==⨯⋅0.38632.15710/A p AGR k C kmol m s η颗粒6.18 乙苯脱氢反应在直径为0.4cm 的球形催化剂上进行,反应条件是0.10Mpa,600℃,原料气为乙苯和水蒸汽的混合物,二者摩尔比为1:9,假定该反应可按拟一级反应处理.⎛⎫''= =-⋅⋅ ⎪⎝⎭913000.1244exp ,/w EB w r k p k kmol kg h PaRT 苯乙烯(1)当催化剂的孔径足够大,孔内扩散属于正常扩散,扩散系数D’=1.5×10-5m 2/s, 试计算内扩散有效因子.(2)当催化剂的平均孔径为100Å时,重新计算内扩散有效因子. 已知:催化剂颗粒密度为1.45g/cm 3,孔率为0.35,曲节因子为3.0. 解:为计算内扩散有效因子,先求取K p := ⋅= ⋅3//EB p EB r kp kmol kg h k p kmol m hρ由颗粒将 P EB =RTC EB ,T=(600+273)代入上式得: =⨯ ⋅= ⋅3334.50810/ 1.252/BE EB r C kmol m h C kmol m s 颗粒颗粒 由此得K p =1.252 s -1(1) (1) 孔径足够大,属正常扩散时,-==⨯ 62/ 1.7510/p m De D m sετ由此求得Φ=0.564,由(6.60)式算得η=0.85(2) (2) 孔半径为100Å时:λ/2<ra>=10-5/200×10-8=5,属于过渡区扩散,由教材(6.36)式可算得乙苯的Dk=2.784×10-2cm 2/s.--==⨯+⨯22212.34810/112.784100.15D cm s--==⨯=⨯32722.73910/ 2.73910/pmD De cm s m sετ由上数据可算得φ=1.425,由教材(6.60)式算得η=0.5286.19 苯(B)在钒催化剂上部分氧化成顺酐(MA),反应为:这三个反应均为一级反应.实验测得反应器内某处气相中苯和顺酐的浓度分别为 1.27%和0.55%(均为mol%),催化剂外表面温度为623K,此温度下,k1=0.0196 s -1,k2=0.0158 s -1,k3=1.98×10-3 s -1,苯与顺酐的k G a m 均为 1.0×10-4m 3/skg.催化剂的颗粒密度为1500kg/m 3,试计算反应的瞬间选择性并与外扩散无影响时的瞬时选择性相比较.解:()()---==⨯=⨯=⨯⋅====-=+ 55512332312/ 1.30710, 1.05310,0.13210/./0.1307,0.1053,0.0132),w p w w w w G m a a m BG BS w w BS k k k k k m kg s Da k k a D D A a C C k k C ρa12G 由可算出单位均为由可算得D 为简化起见以表示顺酐,C 表示(C O +C O 由教材(6.18)式可写出:k ()()(A)-= - (B)-= - (1223)m AS AG w BS w AS m CS CG w AS w BS a C C k C k C a C C k C k C C G G k k=++=+++++1221121(1)/(1)(2)/(1)/[(1)(1)]BS BG a a As AG a a BG a a a C C D D C C D D C D D D 由得由得 有外扩散影响时的瞬时选择性: ()()()()()=-+⎡⎤⎡⎤++=-+⎢⎥⎢⎥++++++⎣⎦⎣⎦⎡⎤++=-+⎢⎥++++⎣⎦=1213121131313213212131131322/1111(1)110.4742w BS w AS w w BSw w AG a BG a a w w w w a a a a BG w w a a AG a w w w w a BG a S k C k C k k C k k C D C D D k k k k D D D D C k k D D C D k k k k D C D 无外扩散影响时的瞬时选择性:'=-=++1213130.5726w w CG w w w w BG k k C S k k k k C6.20 原题见教材,今补充如下:实验测得A 的气相浓度为1.68×10-5mol/cm 3时的反应速率为1.04×10-5(mol/cm 3床层﹒s).解:已知 ()---=⨯-=⨯ ⋅*5531.0410/(10.4) 1.73310/A R mol cm s颗粒若不计外扩散阻力,则C AS =C AG =1.68×10-5mol/cm 3 由教材312页: ()=-*2/s AAG R L DeC φL=dp/6=0.04cm,可算得s φ=0.1375,由(6.82)式=2s φφη,将此式与(6.60)式用试差法联立求解可得:φ=0.387 η=0.92。