第三章定性分析
- 格式:doc
- 大小:596.50 KB
- 文档页数:11


定性分析方法定性分析方法是一种研究和分析事物特征、性质、特点等非数量化的方法。
在社会科学、心理学、教育学等领域,定性分析方法被广泛运用,以揭示事物的内在规律和特征。
本文将介绍定性分析方法的基本概念、应用范围和具体步骤。
首先,定性分析方法是指通过对事物的质性特征进行分析和研究的方法。
与定量分析方法相对应,定性分析方法更注重对事物的特征、性质、特点等非数量化的方面进行深入挖掘和分析。
在社会科学领域,定性分析方法常常用于对人类行为、社会现象、文化特征等进行研究,以揭示其内在规律和特征。
定性分析方法的应用范围非常广泛。
在社会学领域,研究者常常运用定性分析方法对社会群体的行为、态度、观念等进行深入挖掘和分析,以揭示其内在的规律和特征。
在心理学领域,定性分析方法常常用于对个体的情感、态度、行为等进行深入研究和分析,以揭示其内在的心理特征。
在教育学领域,定性分析方法常常用于对教育现象、教学方法、学生学习态度等进行深入研究和分析,以揭示其内在的规律和特征。
具体来说,定性分析方法包括以下几个步骤。
首先,确定研究对象和研究目的,明确要研究的问题和内容。
其次,收集相关的文献资料和数据,对研究对象进行深入了解和分析。
然后,运用适当的研究方法和技术,对研究对象进行观察、访谈、分析等,获取相关的信息和数据。
最后,对所获得的信息和数据进行整理、分析和解释,得出结论和发现。
总之,定性分析方法是一种研究和分析事物特征、性质、特点等非数量化的方法,具有广泛的应用范围和重要的研究意义。
通过深入挖掘和分析事物的内在规律和特征,定性分析方法有助于揭示事物的本质和规律,为人们更好地认识和理解事物提供了重要的方法和手段。

第一章绪论第一节分析化学及其任务和作用定义:研究物质的组成、含量、结构和形态等化学信息的分析方法及理论的科学,是化学学科的一个重要分支,是一门实验性、应用性很强的学科第二节分析方法的分类一、按任务分类定性分析:鉴定物质化学组成(化合物、元素、离子、基团)定量分析:测定各组分相对含量或纯度结构分析:确定物质化学结构(价态、晶态、平面与立体结构)二、按对象分类:无机分析,有机分析三、按测定原理分类(一)化学分析定义:以化学反应为为基础的分析方法,称为化学分析法.分类:定性分析重量分析:用称量方法求得生成物W重量定量分析滴定分析:从与组分反应的试剂R的浓度和体积求得组分C的含量反应式:mC+nR→CmRnX V W特点:仪器简单,结果准确,灵敏度较低,分析速度较慢,适于常量组分分析(二)仪器分析:以物质的物理或物理化学性质为基础建立起来的分析方法。
仪器分析分类:电化学分析 (电导分析、电位分析、库伦分析等)、光学分析(紫外分光光度法、红外分光光度法、原子吸收分光光度核磁共振波谱分析等)、色谱分析(液相色谱、气相色谱等)、质谱分析、放射化学分析、流动注射分析、热分析特点:灵敏,快速,准确,易于自动化,仪器复杂昂贵,适于微量、痕量组分分析四、按被测组分含量分类-常量组分分析:>1%;微量组分分析:0.01%~1%;痕量组分分析;< 0.01%五、按分析的取样量分类试样重试液体积常量分析 >0.1g >10ml半微量 0.1~0.01g 10~1ml微量 10~0.1mg 1~0.01ml超微量分析 <0.1mg ﹤0.01ml六、按分析的性质分类:例行分析(常规分析)、仲裁分析第三节试样分析的基本程序1、取样(采样):要使样品具有代表性,足够的量以保证分析的进行2、试样的制备:用有效的手段将样品处理成便于分析的待测样品,必要时要进行样品的分离与富集。
3、分析测定:要根据被测组分的性质、含量、结果的准确度的要求以及现有条件选择合适的测定方法。



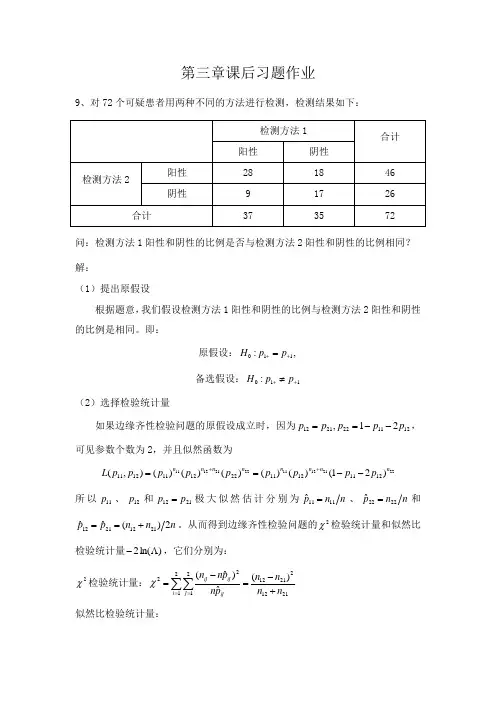
第三章课后习题作业9、对72个可疑患者用两种不同的方法进行检测,检测结果如下:问:检测方法1阳性和阴性的比例是否与检测方法2阳性和阴性的比例相同? 解:(1)提出原假设根据题意,我们假设检测方法1阳性和阴性的比例与检测方法2阳性和阴性的比例是相同。
即:原假设:011:,H p p ++= 备选假设:011:H p p ++≠(2)选择检验统计量如果边缘齐性检验问题的原假设成立时,因为121122211221,p p p p p --==,可见参数个数为2,并且似然函数为2221121122211211)21()()()()()(),(121112112212111211n n n n n n n n p p p p p p p p p L --==++所以11p 、12p 和2112p p =极大似然估计分别为n n p1111ˆ=、n n p 2222ˆ=和n n n p p2)(ˆˆ21122112+==。
从而得到边缘齐性检验问题的2χ检验统计量和似然比检验统计量)ln(2Λ-,它们分别为:2χ检验统计量:211222112212122)(ˆ)ˆ(n n n n p n p n n i j ij ij ij +-=-=∑∑==χ似然比检验统计量:⎪⎪⎭⎫⎝⎛+++-=⎪⎪⎭⎫⎝⎛-=Λ-∑∑==212112211221121221212ln 2ln 2ˆln 2)ln(2n n n n n n n n n p n n i j ijijij它们都有渐近2χ分布,其自由度都是4-2-1=1。
(3)计算检验统计量和p 值,并作出决策则McNemar 2χ检验统计量和似然检验统计量)ln(2Λ-的值分别为:3918)918(22=+-=χ 05818.392918ln 9182918ln 182)ln(2=⎪⎭⎫ ⎝⎛⋅++⋅+-=Λ-我们在Excel 中分别输入“)1,3(chidist =”和“)1,05818.3(chidist =”,可得到2χ检验统计量和似然检验统计量)ln(2Λ-的p 值分别为:083264517.0)3)1((2=≥=χP p 080331601.0)05818.3)1((2=≥=χP p由于p 值都不小,我们不能拒绝原假设,从而认为检测方法1阳性和阴性的比例与检测方法2阳性和阴性的比例是相同。


第三章课后习题作业9、对72个可疑患者用两种不同的方法进行检测,检测结果如下:问:检测方法1阳性和阴性的比例是否与检测方法2阳性和阴性的比例相同? 解:(1)提出原假设根据题意,我们假设检测方法1阳性和阴性的比例与检测方法2阳性和阴性的比例是相同。
即:原假设:011:,H p p ++= 备选假设:011:H p p ++≠(2)选择检验统计量如果边缘齐性检验问题的原假设成立时,因为121122211221,p p p p p --==,可见参数个数为2,并且似然函数为2221121122211211)21()()()()()(),(121112112212111211n n n n n n n n p p p p p p p p p L --==++所以11p 、12p 和2112p p =极大似然估计分别为n n p1111ˆ=、n n p 2222ˆ=和n n n p p2)(ˆˆ21122112+==。
从而得到边缘齐性检验问题的2χ检验统计量和似然比检验统计量)ln(2Λ-,它们分别为:2χ检验统计量:211222112212122)(ˆ)ˆ(n n n n p n p n n i j ij ij ij +-=-=∑∑==χ似然比检验统计量:⎪⎪⎭⎫⎝⎛+++-=⎪⎪⎭⎫⎝⎛-=Λ-∑∑==212112211221121221212ln 2ln 2ˆln 2)ln(2n n n n n n n n n p n n i j ijijij它们都有渐近2χ分布,其自由度都是4-2-1=1。
(3)计算检验统计量和p 值,并作出决策则McNemar 2χ检验统计量和似然检验统计量)ln(2Λ-的值分别为:3918)918(22=+-=χ 05818.392918ln 9182918ln 182)ln(2=⎪⎭⎫ ⎝⎛⋅++⋅+-=Λ-我们在Excel 中分别输入“)1,3(chidist =”和“)1,05818.3(chidist =”,可得到2χ检验统计量和似然检验统计量)ln(2Λ-的p 值分别为:083264517.0)3)1((2=≥=χP p 080331601.0)05818.3)1((2=≥=χP p由于p 值都不小,我们不能拒绝原假设,从而认为检测方法1阳性和阴性的比例与检测方法2阳性和阴性的比例是相同。

分析化学期末复习资料第一章绪论1. 分析化学包括:定量分析,定性分析,结构分析(形态分析)2. 定性分析的对象包括:样本,分析物3. 按样本大小可分为:常量分析(固:>100mg,液:>10mL),半微量分析(固:10~100mg,液:1~10mL),微量分析(固:0.1~10mg,液:0.01~1mL) 4. 按分析物在样品中所占含量可分为:主要(常量)组分分析(>1%),微量组分分析(0.01~1%),痕量组分分析(<0.01%)第二章误差及分析数据的统计处理1. 误差:测定值与真值之间的差值。
2. 绝对误差:E= X,TX,T3. 相对误差:Er=100% ,T4. 准确度:测定平均值与真值接近的程度,常用误差大小表示。
误差小,准确度高。
5. 偏差:个别测定结果与几次测定结果的平均值之间的差值。
6. 绝对偏差:di =Xi- XXi,X,7. 相对偏差:dr =100%XXi,X,,,dr8. 相对平均偏差:100% n,Xn2,,Xi-X,,i19. (样本)标准偏差:s= n-110. 精密度:在相同条件下,多次重复测定值相互符合的程度,常用偏差大小表示。
11. 实验结果首先要求精密度高,才能保证有准确的结果,但高的精密度不一定能保证有高的准确度。
(如无系统误差存在,则精密度高,准确度也高) 12. 校正系统误差(准确度,误差)的方法:改进方法,校正仪器,对照实验,空白实验,回收率实验13. 校正随机(偶然)误差(精密度,偏差)的方法:增加测定次数 14. 随机误差大,系统误差不一定大XX,i15. 可疑值的取舍:G检验(书p17)(G=,s:标准偏差),Q检验(p18) s t,s,,X,16. 平均值的置信区间(p14):(t:查表可得,n;测定次数)n2s大17. 判断两组数据精密度是否有差异(p19):F检验(与偏差有关)(F=) 2s 小18. 比较某测定值与标准值有无显著性差异(p19):t检验(与误差有关) ,X,,n[t=(μ:标准值)] s19. 有效数字:1)pH、pM、pKa、pKb、lgK等有效数字位数,按小数点后的位数来算(书p23;,5eg:pKa=4.74,则Ka=1.8都是2位有效数字) ,102)修约规则:“四舍六入五留双”&“奇进偶舍(倒数第二位为5时)”(书p23)3)运算规则:加减法:先计算后修约,与小数点后位数最少的相同;乘除法:结果的有效数字位数与所有数中有效数字位数最少的相同4)实验中数据统计中的有效数字:万分之一天平(保留到小数点后4位);滴定管(小数点后2位);移液管(小数点后2位);标准溶液浓度(小数点后4位);高含量组分>10%(小数点后4位);中含量组分1~10%(小数点后3位);微量组分<1%(小数点后2位)第三章滴定分析1. 滴定分析法按原理分:氧化还原滴定法,酸碱滴定法,配位(络合)滴定法,沉淀滴定法2. 按实验方法分:直接滴定法,间接滴定法,置换滴定法,返滴定法3. 直接滴定法:使用一种标准溶液 eg:NaOH滴定HAc 3+3+4. 返滴定法:用两种标准溶液eg:测定Al:Al+EDTA(过量)=AlEDTA标准Zn溶液,,,,,EDTA+Zn=ZnEDTA5. 标准溶液:在滴定分析中用来和被测组分发生反应的浓度准确已知的试剂溶液。

分析化学名词解释第一章绪论1.分析化学(analytical chemistry)是研究物质的组成、含量、结构和形态等化学信息的分析方法及相关理论的一门科学。
2.定性分析(qualitative analysis)的任务是鉴定试样由哪些元素、离子、基团或化合物组成,即确定物质的组成。
3.定量分析(quantitative analysis)的任务是测定试样中某一或某些组分的量。
4.结构分析(structual analysis)的任务是研究物质的分子结构或晶体结构。
5.形态分析(speciation analysis)的任务是研究物质的价态、晶态、结合态等存在状态及其含量。
6.化学分析(chemical analysis)是利用物质的化学反应及其计量关系确定被测物质的组成及其含量的分析方法。
7.仪器分析(instrumental analysis)是以物质的物理或物理化学性质为基础,使用较特殊仪器进行分析的方法。
8.物理分析法(physical analysis)是根据物质的某种物理性质,不经化学反应,直接进行定性、定量、结构和形态分析的方法。
第二章误差和分析数据处理9.准确度(accuracy)是指测量值与真值接近的程度。
10.误差是测量结果与真值之间的差值,是衡量准确度的指标。
11.标准值即采用可靠的分析方法,在不同的实验室,由不同的分析人员对同一试样进行反复多次测定,然后将大量测定数据用数理统计方法处理而求得的测量值,这种通过高精度测量而获得的更加接近真值的值称为标准值。
12.标准参考物质即求得标准值的物质。
13.绝对误差(absolute error)测量值与真值之差称为绝对误差。
14.相对误差(relative error)绝对误差与真值的比值称为相对误差。
15.系统误差(systematic error)也称为可定误差(determinate error),是由某种确定的原因造成的误差。
注安《安全生产管理》第三章第四五节讲义学习笔记全考点第四节安全评价方法一、安全评价方法分类(一)按评价结果的量化程度分类法1定性安全评价方法:根据经验?口直观判断能力对评价对象进行定性分析,如安全检查表、专家现场询问观察法、因素图分析法、事故引发和发展分析、作业条件危险性评价法(格雷厄姆-金尼法或1EC法)、故障类型和影响分析、危险可操作性研究等。
2.定量安全评价方法:运用实验结果和事故资料统计分析获得的指标或规律对评价对象进行定量的计算,如概率风险评价法、伤害(或破坏)评价法、危险指数评价法。
(记忆方法:破伤风指数)二、常用的安全评价方法(一)安全检查表方法(SCA)(定性方法)事先把检查对象加以分解,将大系统分割成若干小的子系统,以提问或打分的形式,将检查项目列表逐项检查,避免遗漏,这种表称为安全检查表,用安全检查表进行安全检查。
1安全检查表方法优点(1)检查项目系统、完整,可以做到不遗漏任何能导致危险的关键因素,因而能保证安全检查的质量。
(2)根据已有的规章制度、标准、规程等,检查执行情况,得出准确的评价。
(3)可采用提问的方式,有问有答,能使人知道如何做才是正确的,因而可起到安全教育的作用。
(4)编制安全检查表的过程,可使检查人员对系统的认识更深刻,更便于发现危险因素。
(5)对不同的检查对象、目的有不同的检查表,应用范围广。
2.安全检查表方法缺点针对不同的需要,须事先编制大量的检查表,工作量大且安全检查表的质量受(二)危险指数方法(RR)(定量方法)危险指数方法是通过对几种工艺现状及运行的固有属性(以作业现场危险度、事故概率和事故严重程度,对不同作业现场的危险性进行鉴别)进行比较计算,确定工艺危险特性、重要性,并根据评价结果,确定需要进一步评价对象的安全评价方法。
危险指数方法可以运用在工程项目的各个阶段(可行性研究、设计、运行等),可以在详细的设计方案完成之前运用,也可以在现有装置危险分析计划制定之前运用;也可用于在役装置。
拉曼光谱分析2篇拉曼光谱分析引言:拉曼光谱是一种非破坏性的分析技术,在化学、物理、生物等领域有着广泛的应用。
通过测定分子库仑振动引起的光子的散射光谱,可以确定分子的组成、结构与纯度等信息。
本文将介绍拉曼光谱分析原理、仪器和方法,并探究其在各领域的应用。
第一章拉曼散射与拉曼谱1.1 拉曼散射当一束激光穿过样品时,其中一部分光散射后形成散射光。
拉曼散射是一种非弹性光学散射,它在散射光中维持了激发光的能量和波长,改变了散射光的方向和强度。
1.2 拉曼谱拉曼谱是被称为荧光谱的光谱种类之一,使用光学显微镜(OM)或拉曼显微镜(RM)观察,能够毫秒级别分析纯度、结构和组成。
拉曼谱的红移和蓝移来自于拉曼散射光的波长。
第二章拉曼光谱分析原理和仪器2.1 原理基础拉曼光谱图显示分子库仑振动引起的散射光,而本征或摩尔散射为二次近似和一次近似散射,相较于热散射的分子现象,更能准确反映分子特征与结构分析。
2.2 仪器种类通常使用的拉曼光谱仪包括离线和在线两种类型。
在离线情况下,样品可以在先前从样品中提取分离,而在在线情况下可将拉曼光谱仪迅速连接到某些机器上,使设备更接近台面。
第三章拉曼光谱分析方法3.1 标准样品库与数据库标准样品库是基于数据库的分析,用于确定和确认样品的组分。
原则上,数据库应该包含样品的特征或实验条件。
对于大多数标准样品库,品牌需提供相关开发配置,具体视品牌而定。
3.2 定量分析如果使用吸收光谱进行定量分析,则使用定量公式进行计算。
在拉曼光谱方面,需要方法验证,包括质量控制。
第四章拉曼光谱在不同领域的应用4.1 化学领域化学领域中,拉曼光谱经常用于无机物质的分析(R萤荧素),聚合物的结构分析,贵金属的表征以及有机分子的数字化测量分析。
4.2 材料领域材料领域中,拉曼光谱应用于无机物质(如纳米材料)半导体材料以及有机物质的分析,并且在例如非晶体的热探头标定等方面表现出非常吸引人的表现。
4.3 生命科学领域在生命科学领域,拉曼光谱主要应用于生物医学领域、药物研究以及细胞研究。
第三章定性分析§3-1 概述学习要点:一、定性分析的任务和方法1.任务:鉴定物质中所含有的组分。
2.方法⑴干法:指分析反应在固体之间进行。
⑵湿法:指分析反应在溶液之间进行。
(主要学习湿法分析)二、定性分析反应进行的条件三、鉴定方法的灵敏度和选择性1.鉴定方法的灵敏度鉴定反应的灵敏度常用“最低浓度”和“检出限量”来表示。
⑴最低浓度⑵检出限量⑶检出限量和最低浓度之间的关系2.鉴定反应的选择性四、空白试验和对照试验空白试验:用配制试液用的蒸馏水代替试液,用同样的方法和条件重做试验进行鉴定,就叫做空白试验。
对照试验:用已知溶液代替试液,用同样方法进行鉴定,就叫做对照试验。
五、分别分析和系统分析1.分别分析:利用特效反应,在其它离子共存的条件下,鉴定任一想要鉴定的离子。
这种分析方法就叫做分别分析法。
2.系统分析:按一定的步骤和顺序将离子加以逐步分离的分析方法就叫做系统分析法。
§3-2 阳离子的分析一、常见阳离子的分组学习要点:(一)H2S系统1.分组方案2.系统分析简表(二)酸碱系统(了解)二、第一组阳离子的分析第一组阳离子包括:Ag+、Hg22+、Pb2+组试剂:稀HCl(一)主要特性(二)本组离子氯化物的沉淀与分离(三)第一组阳离子的系统分析讨论:1. P.73 3题2. 沉淀第1组阳离子为什么要在酸性溶液中进行?若在碱性条件下进行,将会发生什么后果?3. 向未知试液中加入第1组试剂HCl时,未生成沉淀,是否表示第1组阳离子都不存在?4. 如果以KI代替HCl作为第1组组试剂,将产生哪些后果?三、第二组阳离子的分析学习要点:第二组阳离子包括:Pb2+、Bi3+、Cu2+、Cd2+、Hg2+、AsⅢ,Ⅴ、SbⅢ,Ⅴ、SnⅡ,Ⅳ组试剂:0.3mol/LHCl存在下的H2S(一)主要特性(二)第二组阳离子硫化物的沉淀与分离(三)第二组阳离子的系统分析讨论:1. P.73 6题2. 沉淀本组硫化物时,在调节酸度上发生了偏高或偏低现象,将会引起哪些后果?3. 用TAA作组试剂沉淀第二组离子,调节酸度时为什么要先调至0.6mol/L HCl酸度,然后再稀释1倍,使最后的酸度为0.2mol/L?4. 以TAA代替H2S作为第2组组试剂时,为什么可以不加H2O2和NH4I?5. 已知某未知试液不含第3组阳离子,在沉淀第2组硫化物时是否还要调节酸度?6. 设原试液中砷、锑、锡高低价态的离子均存在,试说明它们在整个系统分析过程中价态的变化。
四、第三组阳离子的分析学习要点:第三组阳离子包括:Al3+、Cr3+、Fe3+、Fe2+、Mn2+、Zn2+、Co2+、Ni2+组试剂:NH3- NH4Cl存在下的(NH4)2S。
(一)主要特性(二)第三组离子的沉淀与分离(三)第三组阳离子的分析1.系统分析(1)氨法分析(2)碱—过氧化物法分析2.分别分析注:分出第三组沉淀后的清液(若要进行四、五组离子的分析)应立即用HAc酸化,加热除去H2S。
讨论:1. P.73-74 9题、11题2. 在系统分析中,沉淀本组离子时可否用Na2S代替(NH4)2S?3. 用(NH4)2S或TAA沉淀本组离子为什么要加足够的NH4Cl?4. 在系统分析中,本组硫化物沉淀生成后,与母液放置过夜才离心沉降,是否可以?5. 已知NiS、CoS在0.3mol/L HCl溶液中不被H2S沉淀,但为什么生成的NiS、CoS又难溶于1mol/L HCl?五、第四组阳离子的分析学习要点:第四组阳离子包括:Ba2+、Sr2+、Ca2+(经典分组方案)组试剂:NH3-NH4Cl存在下的(NH4)2CO3。
(一)主要特性(二)本组离子碳酸盐的沉淀与分离(三)本组离子的分析1.系统分析2.分别分析讨论:1.P.74-75 13题、20题2.在系统分析中,引起第4组中二价离子丢失的可能原因有哪些?3.以K2CrO4试法鉴定Ba2+时,为什么要加HAc和NaAc?六、第五组阳离子的分析学习要点:第5组包括:Mg2+、K+、Na+、NH4+(经典分组方案)组试剂:无㈠主要特性㈡本组离子的分析讨论:1. P.74 14题2. 以镁试剂鉴定Mg2+时,在以(NH4)2S消除干扰离子的手续中,如果加得不足,将产生什么后果?§3~3 阴离子分析学习要点:一、阴离子的分析特性与酸反应(易挥发性)㈡氧化还原性㈢形成络合物的性质二、阴离子的分析㈠阴离子分析试液的制备制备的阴离子分析试液必须满足3个要求:除去重金属离子;将阴离子全部转入溶液;保持阴离子原来的存在状态。
制备方法:把试样与饱和Na2CO3溶液一起煮沸,重金属阳离子生成不溶于H2O的碳酸盐、碱式碳酸盐、氢氧化物或氧化物沉淀,阴离子留在溶液中。
用Na2CO3处理后的溶液叫做制备溶液或阴离子分析液。
㈡阴离子的初步试验1.分组试验2.挥发性试验(见前)3.氧化还原性试验⑴氧化性阴离子试验2NO2- + 2I- + 4H+ = I2 + 2NO + 2H2O⑵还原性阴离子试验①使KMnO4(酸性)中的MnO4-还原褪色如:2MnO4- + 10HCl + 6H+ = 5Cl2 + 2Mn2+ + 8H2O②使I 2-淀粉(酸性)溶液还原褪色如: SO 32- + I 2 + H 2O = SO 42- + 2I - + 2H +S 2- + I 2 +2H + = S + 2HI ㈢ 阴离子的鉴定讨论:1. P.74-75 17、19题2. 在阴离子分组试验中,(1)BaCl 2试验得出否定结果,能否将第1组阴离子整组排除?(2)AgNO 3试验得出肯定结果,能否认为第2组阴离子中至少有一种存在? 3. 在氧化性、还原性试验中,(1)以稀HNO 3代替稀H 2SO 4酸化试液是否可以?(2)以稀HCl 代替稀H 2SO 4是否可以? (3)以浓H 2SO 4作酸化试液是否可以?4. 下列各组溶液,在各项初步试验中将有怎样 的表现?说明之。
(1)SO 32-,Cl -,Ac - (2)SO 42-,S 2-,NO 3- (3)S 2O 32-,NO 3-,Ac - §3-4 有机化合物元素定性分析及官能团鉴定 一、有机物元素定性分析的特点因有机物分子结构和理化性质与无机物有本质的差别,对有机物的化学分析更要注意溶(熔)剂的选择,设法提高化学反应速率,避免副反应,并考虑分子结构对官能团反应活性的影响。
二、有机物元素定性分析有机物的定性分析即鉴定有机试样中含有哪些元素,根据试样中含有元素,再推断其可能含有的官能团,从而选择相应的定性鉴定方法。
通常有机物元素定性分析主要指氮、硫和卤素的鉴定,有时也包括磷、硼和砷等非金属或某些金属元素。
分解试样的方法常用钠熔法和氧瓶燃烧法,其中钠熔法使用更多。
(一)钠熔法的基本原理(二)元素的鉴定 1.氮的鉴定普鲁士蓝法 碱性(pH=13)条件下,试液中的CN -与FeSO 4反应生成Na 4Fe(CN)6。
6NaCN+ FeSO 4== Na 4Fe(CN)6 + Na 2SO 4酸化后,使Na 4Fe(CN)6与Fe 3+反应,形成Fe 4[Fe(CN)6]3(普鲁士蓝) 据此鉴定试样中氮元素的存在。
3 Na 4Fe(CN)6 + 2 Fe 2(SO 4)3 == 6 Na 2SO4 + Fe 4[Fe(CN)6]3醋酸铜-联苯胺法 碱性溶液中CN -经醋酸化与醋酸铜-联苯胺反应,生成联苯胺蓝的蓝色沉淀或蓝色环,表示试样中有氮元素存在。
有机物(含C 、H 、N 、S 、X 等)NaCN,Na 2SNa 熔融NaX ,NaSCN 等2Cu(Ac)2 + 2 NaCN + 2H 2NNH2H 2NNH 2HNNH2HAc + 2Na 2 Cu 2(CN)4+ 2NaAc2.硫的鉴定硫化铅法 (见本章第二节) 亚硝酰铁氰化钠法(见本章第三节) 3. 硫和氮同时鉴定用硫氰化铁法可以同时鉴定氮和硫,硫氰酸根与三价铁离子反应生成红色的硫氰化铁。
4.卤素的鉴定(1)Cl -、Br -和I -的鉴定Ag ++ X - = AgX ↓(X= Cl 、Br 、I )(2)Cl -、Br -和I -的分别鉴定Br -和I -的分别鉴定(见本章第三节) (3)F -的鉴定锆盐与茜素溶液生成紫红色的锆-茜素络合物,酸性条件下生成更稳定的六氟化锆络离子,使溶液的紫红色变为原来茜素的黄色。
4OOHOHZrCl 434OO OOH4Zr + HCl6HF4OOH OH+ ZrF 62- + 2H +黄紫红色三、有机官能团的鉴定 (一)羟基的鉴定醇或酚,结构和性质都不同,醇多中性,酚多为弱酸性。
(1)醇类的鉴定硝酸铈铵试验 碳原子数小于10醇与硝酸铈溶液作用,产生琥珀色或红色反应。
(NH 4)2Ce(NO 3)6 + ROH (NH 4)2Ce(NO 3)5RO + HNO 3注意:水溶性试样与非水溶性试样实验方式不同。
钒-8-羟基喹啉实验 8-羟基喹啉钒的化合物(I )为黑绿色,溶于苯或甲苯等橙灰绿色;加入醇后溶液变红,生成溶剂络合物(II )。
证明醇羟基的存在。
N OV O O NN OV O ……(ROH)nONIII注意:多元醇因为具有强极性而不溶于苯,故不能用此法鉴定。
2. 酚类的鉴定溴水试验酚类能使溴水褪色,并生成三溴代酚沉淀析出。
OH+ 3Br2OHBrBrBr+ 3HBr 白色沉淀三氯化铁试验酚类和分子中含有烯醇式结构或通过分子内的互变异构作用能产生烯醇式结构的化合物,遇三氯化铁后均能生成有色络合物,呈现的颜色与溶剂、试剂浓度,反应时间及酸度有关,结构不同的酚,颜色不同。
此有色物质一般不太稳定,会很快褪去,若在三氯化铁中加入三乙醇胺,可提高其稳定性。
化合物生成的颜色化合物生成的颜色苯酚紫间苯二酚紫邻甲苯酚蓝对苯二酚暗绿色结晶间甲苯酚蓝1,2,3-苯三酚淡棕红色对甲苯酚蓝1,3,5-苯三酚紫色沉淀邻苯二酚绿α-萘酚紫色沉淀(二)醚类的鉴定Zeisel试验醚类化学活性较低,能借含氧官能团的特性检出。
具有低级烷氧基的醚类能被氢碘酸分解而生成易挥发的碘代烷,碘代烷蒸气遇硝酸汞溶液可生成橙色和朱红色的碘化汞,从而表示醚的存在:(或RI + R'OH)2RI + Hg(NO3)2 HgI2 + 2RONO2(三)羰基的鉴定酮和醛能发生缩合或加成反应,据此可以鉴定羰基。
2,4-二硝基苯肼试验酸性条件下,醛酮分子中的羰基能与2,4-二硝基苯肼发生缩合反应,生成黄色、橙色或橙红色的2,4-二硝基苯腙沉淀:C=O + H2NNH RRNO2NO2C=O =NNHRRNO2 + H2ONO22,4-二硝基苯腙是有固定熔点的结晶,易从溶液中析出,沉淀的颜色取决于醛或酮的共轭程度。