3.1.1强弱电解质
- 格式:ppt
- 大小:2.65 MB
- 文档页数:24


强弱电解质的定义一、强弱电解质的概念在化学中,电解质是指能够在溶液中或熔融状态下导电的化合物。
根据其电离程度的不同,电解质可以分为强电解质和弱电解质两类。
强电解质是指在溶液中能够完全电离的化合物,将产生大量的离子。
典型的强电解质包括盐类和强酸强碱。
盐类如氯化钠(NaCl)、硫酸铵(NH4)2SO4等,在水溶液中完全离解成阳离子和阴离子。
强酸如盐酸 (HCl)、硝酸 (HNO3)等以及强碱如氢氧化钠 (NaOH)、氢氧化铁 (Fe(OH)3)等,在水溶液中也能完全分解成离子。
弱电解质是指在溶液中只能部分电离的化合物,将产生较少的离子。
弱电解质的电离程度较低,只有一小部分分子会离解成离子,而大部分分子仍以分子形式存在。
典型的弱电解质包括乙酸(CH3COOH)、氨(NH3)等。
这些化合物在水溶液中只能部分电离,生成的离子浓度较低。
二、强弱电解质的特点强电解质和弱电解质在溶液中的行为有很大的差异。
1. 电离程度不同:强电解质能够完全电离,产生大量离子,而弱电解质只能部分电离,产生较少的离子。
2. 导电能力不同:由于产生的离子数量不同,强电解质在溶液中具有较好的电导能力,能够迅速导电;而弱电解质的电导能力相对较差,需要较长的时间才能够导电。
3. 溶液的电解质浓度不同:由于强电解质能够完全电离,其溶液中的电解质浓度较高;而弱电解质只能部分电离,其溶液中的电解质浓度较低。
4. 溶液的酸碱性不同:强酸和强碱是强电解质,其水溶液呈酸性或碱性;而弱酸和弱碱是弱电解质,其水溶液呈中性或微酸碱性。
5. 化学反应速率不同:强电解质在溶液中能够迅速发生化学反应,而弱电解质的反应速率较慢。
三、强弱电解质的应用强电解质和弱电解质在生活和工业中有着广泛的应用。
1. 强电解质的应用:- 盐类在食品加工中起到调味、防腐等作用。
- 强酸和强碱广泛用于化学实验室中,用于酸碱中和反应、pH调节等。
- 氧化剂和还原剂中的离子起到催化作用,促进化学反应的进行。

现吨市安达阳光实验学校【创设计】高中化学强电解质和弱电解质每课一练4一、选择题(本题包括7小题,每小题3分,共21分)1.下列说法正确的是( )A.强电解质一是离子化合物B.强电解质、弱电解质的电离都是吸热过程C.强电解质的饱和溶液一是浓溶液D.强电解质在水中一能溶解解析:共价化合物如H2SO4、HNO3、HCl也是强电解质,A项错误;电离的过程都是吸热过程,B项正确;BaCO3、BaSO4难溶强电解质在水中溶解度很小,其饱和溶液浓度也很小,C、D项错误。
答案:B2.(2012·一中期末)下列物质的稀溶液中存在电离平衡的有(不考虑水的电离)( )A.HBr B.NaHSO4C.NH4NO3D.NaHCO3解析:HBr 、NaHSO4、NH4NO3、 NaHCO3都属于强电解质,且HSO-4是强酸的酸式酸根,在水溶液中完全电离,三者在稀溶液中完全电离,不存在电离平衡。
NaHCO3虽然也属于强电解质,但是存在电离平衡HCO-3 CO2-3+H+。
答案:D3.下列说法正确的是( )A.氯化钾溶液在电流作用下电离成钾离子和氯离子B.二氧化硫溶于水能转化成离子,故二氧化硫属于弱电解质C.硫酸钡难溶于水,所以硫酸钡属于弱电解质D.纯净的强电解质在液态时,有的导电有的不导电解析:A项,KCl溶液不需在电流作用下就能电离成K+和Cl-;B项,SO2本身不能电离出离子,故SO2不是电解质,SO2与H2O反生成的H2SO3才是电解质;C项,BaSO4属于强电解质;D项,纯净的强电解质在液态时有的导电(如熔融NaCl),有的不导电(如HCl、HClO4)。
答案:D4.(2011·期中)下列说法正确的是( )A.SO2水溶液能导电,故其为电解质B.向硫化氢饱和溶液中通入少量氯气,反后溶液的导电性比反前明显增强C.弱电解质溶液中不存在溶质分子D.如果盐酸的物质的量浓度是醋酸的2倍,则盐酸中的氢离子浓度也是醋酸的2倍解析:SO2水溶液导电是由于SO2与H2O反生成了H2SO3,H2SO3是弱电解质,并非SO2能电离,A项错误;氢硫酸是弱电解质,反后生成了强电解质,离子浓度增大,导电性增强,B对。



高中化学强弱电解质口诀【实用版】目录1.强弱电解质的定义与区别2.强电解质的特点3.弱电解质的特点4.强弱电解质的判断方法5.高中化学中常见的强弱电解质正文一、强弱电解质的定义与区别电解质是指在水溶液中或熔融状态下能够导电的化合物。
根据电解质在水溶液中电离程度的不同,可以将电解质分为强电解质和弱电解质。
强电解质是指在水溶液中或熔融状态下,能够完全或几乎完全电离的电解质。
这类物质包括强酸、强碱和大多数盐类。
强电解质在溶液中能够产生大量的离子,因此能够导电。
弱电解质是指在水溶液中或熔融状态下,只能部分电离的电解质。
这类物质包括弱酸、弱碱和水。
弱电解质在溶液中产生的离子较少,因此导电能力较弱。
二、强电解质的特点强电解质具有以下特点:1.能够完全或几乎完全电离。
2.产生的离子数量多,因此导电能力强。
3.溶液中的离子浓度较高。
三、弱电解质的特点弱电解质具有以下特点:1.只能部分电离。
2.产生的离子数量较少,因此导电能力较弱。
3.溶液中的离子浓度较低。
四、强弱电解质的判断方法判断强弱电解质的方法主要有以下几点:1.观察电解质在水溶液中的电离程度。
若电离程度高,则为强电解质;若电离程度低,则为弱电解质。
2.观察电解质在溶液中的离子浓度。
若离子浓度高,则为强电解质;若离子浓度低,则为弱电解质。
3.观察电解质的导电能力。
若导电能力强,则为强电解质;若导电能力弱,则为弱电解质。
五、高中化学中常见的强弱电解质高中化学中常见的强电解质有:1.强酸:硫酸、盐酸、硝酸、高氯酸、氢溴酸、氢碘酸等。
2.强碱:钾、钠、钙、钡的氢氧化物等。
3.大多数盐:(除了乙酸铅、氯化汞等外)几乎所有的盐类。
常见的弱电解质有:1.弱酸:醋酸、碳酸、硅酸、磷酸等。
2.弱碱:氨水等。
3.水。
通过以上内容,我们可以了解到高中化学中强弱电解质的定义、特点、判断方法以及常见的强弱电解质。



3.1.1强电解质与弱电解质分层练习学校:___________姓名:___________班级:___________考号:___________一、单选题1.下列属于弱电解质的是 A .H 2SO 4B .NaOHC .CH 3COOHD .BaSO 4 2.下列说法中不正确的是①将BaSO 4放入水中不能导电,所以BaSO 4是非电解质;①氨溶于水得到的溶液能导电,所以氨水是电解质;①固态的共价化合物不导电,熔融态的共价化合物可以导电;①固态的离子化合物不导电,熔融态的离子化合物也不导电;①强电解质溶液的导电能力一定比弱电解质溶液的导电能力强A .①①B .①①①C .①①①①D .①①①①① 3.下列物质属于强电解质的是A .4BaSOB .34H POC .3SOD .3CH CHO 4.下列物质属于弱电解质的是A .NaClB .CH 3COOHC .H 2SO 4D .NaOH 5.下列叙述正确的有( )①CO 2、SO 2、P 2O 5均为酸性氧化物①氯化钠溶于水中、淀粉溶于水中所形成的分散系分别为:溶液、胶体①电解质发生电离的前提条件是通电①按照纯净物、混合物、强电解质、弱电解质和非电解质顺序排列的是CuSO 4•5H 2O 、盐酸、苛性钾、次氯酸、氨气①氨溶于水得到的溶液能导电,所以NH 3是电解质;①液态HCl 不导电,所以属于非电解质;①强电解质溶液的导电能力一定比弱电解质溶液强;A .2个B .3个C .4个D .5个6.下列属于强电解质的是( )①NaOH①NH3·H2O①MgCl2①醋酸①NaHCO3A.①①①B.①①①C.①①①D.①①①7.下列物质属于弱电解质的是A.H2SO4B.Na2O C.AgCl D.NH3·H2O 8.北魏贾思勰《齐民要术·作酢法》这样描述苦酒:“乌梅苦酒法:乌梅去核,一升许肉,以五升苦酒渍数日,曝干,捣作屑。

第一节弱电解质的电离第1课时强、弱电解质课时作业1.下列物质中属于强电解质,但在给定条件下不能导电的是()A.液态溴化氢B.蔗糖C.铝D.醋酸解析蔗糖属于非电解质,不导电,B错;铝能导电,但不属于电解质,C错;醋酸属于弱电解质,D错。
答案 A2.下列说法正确的是()A.在水溶液中能离解为自由移动的离子的化合物是电解质B.强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物C.CO2的水溶液导电能力很弱,所以CO2是弱电解质D.在强电解质的水溶液中只有离子没有分子解析根据强、弱电解质的定义可知,电解质的强弱与其溶解性没有关系,强电解质有的是易溶的,有的是难溶的,如碳酸钙等,故A项正确,B项错误;CO2的水溶液导电是因为CO2与水反应生成的碳酸电离出离子,而不是CO2电离,且液态CO2也不电离,故CO2是非电解质,C项错误;D项中忽视了水分子的存在,D项错误。
答案 A3.下列各组物质中都是强电解质的是()A.HF、HCl、BaSO4B.NH4F、CH3COONa、Na2SC.NaOH、Ca(OH)2、NH3·H2OD.HClO、NaF、Ba(OH)2解析HF是弱酸,为弱电解质,A项错误;NH4F、CH3COONa、Na2S都属于盐,都是强电解质,B项正确;NH3·H2O是弱碱,为弱电解质,C项错误;HClO 是弱酸,为弱电解质,D项错误。
答案 B4.下列说法正确的是()A.Ca(OH)2微溶于水,所以是弱电解质B.在水中能电离出离子的化合物一定是离子化合物C.CO2分子中含有极性键,且溶于水能导电,所以CO2是电解质D.NH3·H2O在水中只能部分电离,所以是弱电解质解析区别强、弱电解质的依据是看其溶于水后能否全部电离,和其溶解度大小无必然联系。
Ca(OH)2虽微溶于水,但溶于水的部分能全部电离,所以是强电解质,A项错误;某些共价化合物在水中也能电离出离子,如H2SO4等,B项错误;CO2溶于水能导电是由于和水发生反应生成了H2CO3,所以CO2是非电解质,C 项错误。
第一节弱电解质的电离第1课时强电解质和弱电解质题组一强电解质和弱电解质的概念与判断1.北魏贾思勰《齐民要术·作酢法》这样描述苦酒:“乌梅苦酒法:乌梅去核,一升许肉,以五升苦酒渍数日,曝干,捣作屑。
欲食,辄投水中,即成醋尔。
”下列有关苦酒主要成分的说法正确的是()A.苦酒的主要溶质是非电解质B.苦酒的主要溶质是强电解质C.苦酒的主要溶质是弱电解质D.苦酒的溶液中只存在分子,不存在离子答案 C解析苦酒的主要溶质是乙酸,属于弱电解质,在水中部分电离,所以既有电解质分子CH3COOH,又有H+和CH3COO-。
2.下列物质的水溶液能导电,且属于非电解质的是()A.二氧化硫B.石墨C.氧化钙D.C6H12O6(葡萄糖)答案 A解析SO2溶于水后可生成亚硫酸,其水溶液可导电,但其自身并不能电离出离子,为非电解质;石墨为单质,既不是电解质,也不是非电解质;CaO熔融状态下能电离出阴、阳离子,为电解质;葡萄糖为非电解质,但其水溶液不能导电。
3.下列各组物质中,前者为强电解质,后者为弱电解质的是()A.硫酸、氯化镁B.碳酸、碳酸钠C.碳酸氢钠、醋酸D.氢氧化钠、氨气答案 C解析硫酸和氯化镁均是强电解质;碳酸是弱电解质,碳酸钠是强电解质;碳酸氢钠是强电解质,醋酸是弱电解质;氢氧化钠是强电解质,氨气是非电解质。
故选C。
4.下列说法正确的是()A.Ca(OH)2微溶于水,所以是弱电解质B.在水中能电离出离子的化合物一定是离子化合物C.CO2溶于水能导电,所以CO2是电解质D.NH3·H2O在水中只能部分电离,所以是弱电解质答案 D解析区别强、弱电解质的依据是看其溶于水后能否完全电离,和其溶解度大小无必然联系。
Ca(OH)2虽微溶于水,但溶于水的部分能完全电离,所以是强电解质,A项错误;某些共价化合物在水中也能电离出离子,如H2SO4等,B项错误;CO2溶于水能导电是由于和水发生反应生成了H2CO3,所以CO2是非电解质,C项错误。
第一节弱电解质的电离第1课时强、弱电解质课程标准要求核心素养建构1.了解电解质与非电解质,强电解质与弱电解质的概念。
2.认识强、弱电解质与物质类别、结构的关系。
3.了解常见的强、弱电解质,学会书写电离方程式。
4.了解电解质在水溶液中的电离及电解质溶液的导电性。
[知识梳理]一、电解质和非电解质1.根据化合物在水溶液中或熔融状态下是否产生自由移动的离子,可把化合物分为电解质和非电解质。
电解质:在水溶液中或熔融状态下能产生自由移动的离子的化合物。
非电解质:在水溶液中和熔融状态下都不能产生自由移动的离子的化合物。
2.常见的电解质有酸、碱、盐、离子型氧化物。
【自主思考】1.(1)能导电的物质一定是电解质吗?(2)电解质一定能导电吗?提示(1)不一定,如金属或溶液等能导电,但不是电解质。
(2)不一定,如固体NaCl不导电。
二、强电解质和弱电解质1.实验探究实验 1 mol·L-1 HCl 1 mol·L -1 CH3COOH与镁反应现象剧烈反应,产生气体缓慢反应,产生气体结论Mg与盐酸反应快,表明盐酸中c(H+)较大溶液的pH 数值不相同(填“相同”或“不相同”)结论相同物质的量浓度的盐酸和醋酸溶液中c(H+)不相同(填“相同”或“不相同”)实验结论HCl和CH3COOH的电离程度不同2.概念【自主思考】2.强、弱电解质的本质区别是什么?提示在水溶液中能否全部电离。
三、电解质电离方程式的书写1.强电解质全部电离,在写电离方程式时,用“===”。
2.弱电解质部分电离,在写电离方程式时,用“”。
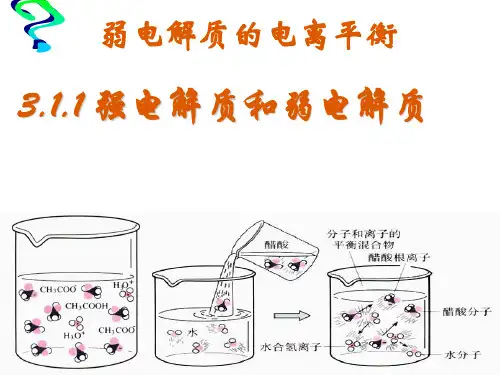
(1)一元弱酸、弱碱一步电离:如CH3COOH:CH3COOH CH3COO-+H+;NH3·H2O:NH3·H2O NH+4+OH-。
(2)多元弱酸分步电离,必须分步写出,不可合并(其中以第一步电离为主)。
如H2CO3:H2CO3H++HCO-3(主),HCO-3H++CO2-3(次)。
强弱电解质的电离方程式1. 电解质是什么嘿,朋友们,今天我们来聊聊电解质。
这东西听起来有点高大上,其实没那么复杂,咱们可以把它想象成生活中常见的盐、糖之类的东西。
电解质就是那些在水中能分开成离子的物质。
当你把食盐扔进水里,它就开始溶解,分成钠离子和氯离子,哇,简直像魔法一样!所以,电解质分为两大类,强电解质和弱电解质,今天我们就来详细唠一唠这俩家伙。
1.1 强电解质的特点强电解质就像是火箭,瞬间分裂、飞得老远。
它们在水里几乎完全电离,比如盐酸、氢氧化钠和氯化钠。
想象一下,把食盐放进水里,过了一会儿,你发现水里全是钠离子和氯离子,根本看不到“食盐”的身影。
就好比你在派对上,大家喝酒喝得酩酊大醉,酒瓶全空了,谁还记得酒瓶长什么样呢?1.2 弱电解质的特点相比之下,弱电解质就像个慢吞吞的家伙,电离得没那么彻底,只有一部分分开。
例如醋酸和氨水,它们在水中只电离出一小部分离子。
就像你去一个派对,大家都在聊天,有的人很活跃,跳得欢;而有的人在一旁悄悄喝水,完全没参与。
这种情况下,溶液里就会有不少未电离的分子,形成一种温和的气氛。
2. 强弱电解质的电离方程式好啦,咱们接下来就说说强电解质和弱电解质的电离方程式,别担心,不会让你头晕脑胀的。
就像数学题,分步骤来就好。
2.1 强电解质的电离方程式拿氯化钠(NaCl)来说,电离方程式就是这样的:NaCl (s) → Na^+ (aq) + Cl^ (aq) 。
这里,“(s)”代表固体,“(aq)”是水合离子,意思是这些离子在水里游来游去。
简直就是一场离子大聚会,真是热闹得不行。
2.2 弱电解质的电离方程式再看看醋酸(CH₃COOH),它的电离方程式就复杂一点:CH3COOH (aq) left→ CH3COO^ (aq) + H^+ (aq) 。
你看这个“↔”,就像在告诉我们,醋酸可以往两个方向走,既可以分开成离子,也可以结合成分子。
就像在生活中,有些朋友很喜欢和别人聊天,但有时候也想静静地待着。