第三章思考题
- 格式:docx
- 大小:17.15 KB
- 文档页数:2

第三章作业思考题(一)选择题1.毛泽东指出,解决中国一切革命问题的最基本的根据是( C ) A.正确分析中国社会的阶级状况;B 正确分析中国社会的经济结构C.认清中国社会的特殊国情;D 认清中国社会的主要矛盾2.新民主主义的经济纲领是( ADE )A.没收封建地主阶级的土地归农民所有;B.发展经济,保障供给;C.公私兼顾,劳资两利;D.保护民族工商业;E.没收四大家族官僚垄断资本归新民主主义国家所有3.中国共产党在中国革命中战胜敌人的“主要法宝”有( BCE ) A.群众路线;B.统一战线;C.武装斗争; D.独立自主;E.党的建设;(二)简答题1.如何理解新民主主义革命总路线中的领导权问题?答:1. 新民主主义革命是资产阶级民主革命,总路线指出新民主主义革命由无产阶级领导。
无产阶级领导权是中国革命的中心问题,也是新民主主义革命理论的核心问题。
区分新旧民主主义革命根本的标志是革命的领导权掌握在无产阶级手中还是资产阶级手中。
中国无产阶级除了具有与先进的生产方式相联系、没有私人占有的生产资料、富于组织纪律性等一般无产阶级的基本优点外,还具有自身的特点和优点。
一是深受三重压迫,革命性强;二是高度集中,易于形成强大的政治力量;三是与农民有天然的联系,易于结成工农联盟。
这些优点使无产阶级及其政党—中国共产党的领导,成为中国革命取得胜利的保证。
无产阶级要实现其领导权就必须同资产阶级争夺领导权。
无产阶级领导新民主主义革命是中国社会历史发展的客观要求,是十月革命后世界革命和时代转换的必然结果。
无产阶级对中国民主革命的领导主要体现为政治领导。
2.中国革命走农村包围城市、武装夺取政权道路的重大意义?2.第一,开辟了农村包围城市的革命新道路,实现了中国革命由城市向农村的历史性转变第二,开辟了农村包围城市的革命新道路,提示了中国革命发展的规律,指导中国革命取得了最后胜利。
第三,农村包围城市、武装夺取政权的革命新道路理论,对马克思主义理论宝库作出了独创性的贡献。

第三章思考题及解答1. 理想气体等温膨胀过程中△U = 0, 故有Q = -W , 即膨胀过程中系统所吸收的热全部变成了功,这是否违反了热力学第二定律?为什么?答:不违反热力学第二定律。
热力学第二定律的前提是“不发生其他变化”,应该理解为“系统和环境都完全复原”。
也就是说热力学第二定律是产生在系统“工作了一个循环”这样的前提之下的结论。
2.理想气体等温膨胀过程21ΔlnV S nR V =,因为V 2>V 1,所以ΔS >0。
但是根据熵增原理,可逆过程0S ∆=,这两个结论是否矛盾?为什么?答:不矛盾。
恒温过程只能用克劳修斯不等式判断过程是否可逆,只有绝热过程或隔离系统中发生的变化才能用熵增原理判断过程是否可逆。
3.理想气体自由膨胀过程△T = 0,Q = 0,因此△S =QT= 0, 此结论对吗? 答: 不对。
因该过程为不可逆过程, 所以△S 不能由过程的热温商求算,而应通过设计可逆途径求算。
4.在恒定压力下,用酒精灯加热某物质,使其温度由T 1上升至T 2,此间,没有物质的相变化,则此过程的熵变为21,m d ΔT p T nC T S T=⎰,对吗?如果此间物质发生了相变化,过程熵变应该怎样计算?答:正确。
如果有相变化,设计可逆过程进行计算。
根据题目给出的相变温度不同,将有不同形式的计算公式。
5.“所有能发生过程一定是不可逆的,所以不可逆过程也一定是能发生过程。
”这种说法是否正确?为什么?答:正确。
因为这是热力学第二定律的结论。
6.“自然界存在着温度降低但是熵值增加的过程。
”的结论是否正确?为什么?举例说明。
(绝热不可逆膨胀)。
答:正确。
熵值不仅与温度一个变量有关,还与其它状态性质有关。
如与体积、压力有关。
如双变量系统,S = f (T,V )或S = f (T,p )系统经历某变化后,熵值的改变取决于这些变量的综合效应。
一个典型的例子是绝热不可逆膨胀7.“不可逆过程的熵不能减小”对吗?为什么?答:不正确。

第三章 热力学第二定律思考题1.理想气体绝热向真空膨胀,则: ( )(A) ΔS = 0,W = 0(B) ΔH = 0,ΔU = 0(C) ΔG = 0,ΔH = 0(D) ΔU = 0,ΔG = 02.熵变∆S 是:(1) 不可逆过程热温商之和(2) 可逆过程热温商之和(3) 与过程无关的状态函数(4) 与过程有关的状态函数以上正确的是: ( )(A) 1,2 (B) 2,3(C) 2 (D) 43.理想气体在等温条件下反抗恒定外压膨胀,该变化过程中体系的熵变及环境的熵变应为: ( )∆S 体∆S 环 (A) >0,=0 (B ) ∆S 体∆S 环∆S 体<0,∆S 环=0(C) >0,<0 (D ) ∆S 体∆S 环∆S 体<0,∆S 环>04.下列四种表述:(1) 等温等压下的可逆相变过程中,体系的熵变ΔS =ΔH 相变/T 相变 (2) 体系经历一自发过程总有 d S > 0(3) 自发过程的方向就是混乱度增加的方向(4) 在绝热可逆过程中,体系的熵变为零两者都不正确者为: ( )(A) (1),(2) (B) (3),(4)(C) (2),(3) (D) (1),(4)5. 求任一不可逆绝热过程的熵变ΔS 时,可以通过以下哪个途径求得? ( )(A) 始终态相同的可逆绝热过程(B) 始终态相同的可逆恒温过程(C) 始终态相同的可逆非绝热过程(D) (B) 和 (C) 均可6. 理想气体经可逆与不可逆两种绝热过程:( )(A) 可以从同一始态出发达到同一终态(B) 从同一始态出发,不可能达到同一终态(C) 不能断定 (A)、(B) 中哪一种正确(D) 可以达到同一终态,视绝热膨胀还是绝热压缩而定7. 对于孤立体系中发生的实际过程,下列各式中不正确的是:( )(A) W = 0 (B) Q = 0(C) ΔS > 0 (D) ΔH = 08. 理想气体从状态 I 经自由膨胀到状态 II,可用哪个热力学判据来判断该过程的自发性?( )(A) ΔH(B) ΔG(C) ΔS (D) ΔU9.对实际气体的节流膨胀过程,有( )(A) ΔH = 0 (B) ΔS = 0(C) ΔG = 0 (D) ΔU = 010.H2和O2在绝热钢瓶中生成水的过程:( )(A) ΔH = 0 (B) ΔU = 0(C) ΔS = 0 (D) ΔG = 011.选择正确答案,将其标号字母填入括号内。
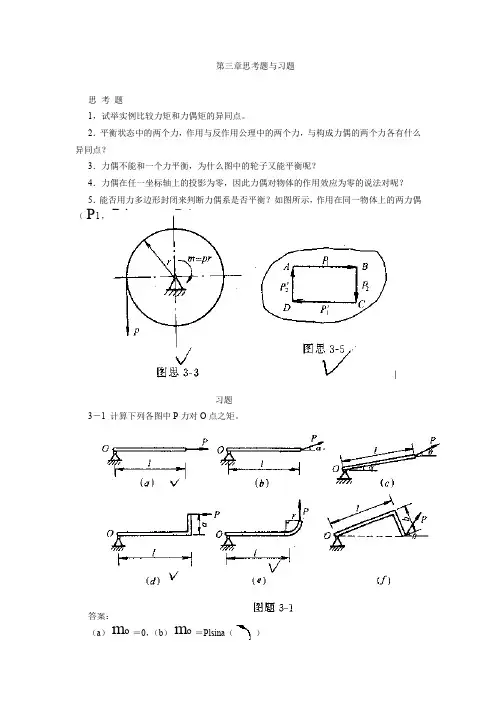
第三章思考题与习题
思考题
1,试举实例比较力矩和力偶矩的异同点。
2.平衡状态中的两个力,作用与反作用公理中的两个力,与构成力偶的两个力各有什么异同点?
3.力偶不能和一个力平衡,为什么图中的轮子又能平衡呢?
4.力偶在任一坐标轴上的投影为零,因此力偶对物体的作用效应为零的说法对呢?
5.能否用力多边形封闭来判断力偶系是否平衡?如图所示,作用在同一物体上的两力偶P,1P')、(2P,2P')其力多边形封闭,此时物体是否平衡?为什么?
(1
习题
3-1 计算下列各图中P力对O点之矩。
答案:
m=0,(b)o m=Plsina())
(a)o
(c )
o m =Plsin (θ-α)( )
(d )o m =a P ( )
(e )o m =P (l +r )( ),(f )o m
)
3-2 求图示三个力偶的合力偶矩,已知
1F =1F '=80N ;2F =2F '=130N ;3
F =3F '=100N ;
1d =70cm ;2d = 60cm ;
3d =50cm (M =28N ·m ( )
3-3 各梁受荷载情况如图所示,试求
(1)各力偶分别对A 、B 点的矩。
(2)各力偶中二个力在x 、y 轴上的投影。
3-4 求图示各梁的支座反力
cos P α
A B A B ((a )R =R =P ; (b )R =R =)
3-5如图所示,已知皮带轮上作用力偶矩m =80N ·m ,皮带轮的半径d =0.2m ,皮带紧拉边力1T =500N ,求平衡时皮带松边的拉力
2T (2T =100N )。

第三章思考题3.1刚体一般是由n (n 是一个很大得数目)个质点组成。
为什么刚体的独立变量却不是3n 而是6或者更少?3.2何谓物体的重心?他和重心是不是 总是重合在一起的? 3.3试讨论图形的几何中心,质心和重心重合在一起的条件。
3.4简化中心改变时,主矢和主矩是不是也随着改变?如果要改变,会不会影响刚体的运动?3.5已知一匀质棒,当它绕过其一端并垂直于棒的轴转动时,转动惯量为231ml ,m 为棒的质量,l 为棒长。
问此棒绕通过离棒端为l 41且与上述轴线平行的另一轴线转动时,转动惯量是不是等于224131⎪⎭⎫⎝⎛+l m ml ?为什么? 3.6如果两条平行线中没有一条是通过质心的,那么平行轴定理式(3.5.12)能否应用?如不能,可否加以修改后再用?3.7在平面平行运动中,基点既然可以任意选择,你觉得选择那些特殊点作为基点比较好?好处在哪里?又在(3.7.1)及(3.7.4)两式中,哪些量与基点有关?哪些量与基点无关? 3.8转动瞬心在无穷远处,意味着什么?3.9刚体做平面平行运动时,能否对转动瞬心应用动量矩定理写出它的动力学方程?为什么?3.10当圆柱体以匀加速度自斜面滚下时,为什么用机械能守恒定律不能求出圆柱体和斜面之间的反作用力?此时摩擦阻力所做的功为什么不列入?是不是我们必须假定没有摩擦力?没有摩擦力,圆柱体能不能滚?3.11圆柱体沿斜面无滑动滚下时,它的线加速度与圆柱体的转动惯量有关,这是为什么?但圆柱体沿斜面既滚且滑向下运动时,它的线加速度则与转动惯量无关?这又是为什么?3.12刚体做怎样的运动时,刚体内任一点的线速度才可以写为r ω⨯?这时r 是不是等于该质点到转动轴的垂直距离?为什么? 3.13刚体绕固定点转动时,r ω⨯dtd 为什么叫转动加速度而不叫切向加速度?又()r ωω⨯⨯为什么叫向轴加速度而不叫向心加速度?3.14在欧勒动力学方程中,既然坐标轴是固定在刚体上,随着刚体一起转动,为什么我们还可以用这种坐标系来研究刚体的运动?3.15欧勒动力学方程中的第二项()21I I -y x ωω等是怎样产生的?它的物理意义又是什么?第三章思考题解答3.1 答:确定一质点在空间中得位置需要3个独立变量,只要确定了不共线三点的位置刚体的位置也就确定了,故须九个独立变量,但刚体不变形,此三点中人二点的连线长度不变,即有三个约束方程,所以确定刚体的一般运动不需3n 个独立变量,有6个独立变量就够了.若刚体作定点转动,只要定出任一点相对定点的运动刚体的运动就确定了,只需3个独立变量;确定作平面平行运动刚体的代表平面在空间中的方位需一个独立变量,确定任一点在平面上的位置需二个独立变量,共需三个独立变量;知道了定轴转动刚体绕转动轴的转角,刚体的位置也就定了,只需一个独立变量;刚体的平动可用一个点的运动代表其运动,故需三个独立变量。


第三章思考题3-3 什么叫相带?相带属性如何确定?在三相电机绕组中为什么常采用60°相带而不用120°相带?【答】 相带是指把每极下的电枢表面根据相数划分,每相占一等分。
我们称每一等分为一相带。
由于60°相带绕组的合成电动势比120°相带的大,故除了单绕组变极电机外,一般都用60°相带绕组。
3-6 为什么极相组A 和极相组X 串联时必须反接?如果正接将引起什么后果?【答】 因极相组A 的电势与极相组X 的电势反相,反接后,两者电势相减,得到更高的电势。
若正接将引起电势为0的后果。
3-8 交流绕组的感应电动势公式是如何导出的?它与变压器的电动势公式有何类似和不同之处?【答】 设气隙中的主极磁场为正弦分布,即αsin 1B b =,式中1B 为气隙密度的基波幅值;设0=t 时,导体位于极间、将要进入N 极的位置,转子旋转的角频率为ϖ,则导体中的感应电动势为t E lv B blv e ϖαsin 2sin 111===;p 对极的电机一个极下的磁通量为l B lB p D p DlB d p DlB p d D l B d D bl p τπππαααααπππ111010101222sin 22sin 2=⋅⋅===⋅==Φ⎰⎰⎰电机,感应电动势的频率60pn f =,转子的线速度f pn p D n D v τππ2602260===,故导体电动势的有效值为111111222222222Φ=⎪⎭⎫ ⎝⎛====f l B f l fB f l B v l B E πτππττ;在考虑短距和分布后,整个线圈组的合成电动势()()()()11111111111222Φ=Φ=Φ==w c d p c d p c d c q k qN f k k qN f k k fN q k qE E πππ;对于双层绕组,每相绕组有p 2个极相组,设并联支路数为a ,如果一相绕组的总串联匝数表示为,c qN a p N 2=,则相电动势为1111112222Φ=Φ⎪⎭⎫ ⎝⎛==w w c q ph fNk k qN a p f K a p E ππ,对于单层绕组,每相绕组总共有p 个极相组,则每相绕组的总串联匝数为c qN a p N =。


习题一: 选择题1.下列叙述中正确的是(B)§3.7A 溶液中的反应一定比气相中的反应速率大B 反应活化能越小,反应速率越大C 增大系统压力,反应速率一定增大D 加入催化剂,使正反应活化能与逆反应活化能减少相同倍数2.升高同样温度, 一般化学反应速率增大倍数较多的是(C )§3.5 A 吸热反应 B 放热反应 C Ea 较大的反应 D Ea 较小的反应3.已知2NO(g)+Br 2=2NOBr 反应为基元反应,在一定的温度下,当总体积扩大一倍时,正反应为原来的(D )§3.3A 4倍B 2倍C 8倍 D81倍 4.一级反应的半衰期与反应物初始浓度的关系是(A)§3.4 A 无关 B 成正比 C 成反比 D 平方根成正比5.已知2A+B=C 的速率方程为r=k[C(A)]2[C(B)], 该反应一定是(A )§3.3 A 三级反应 B 复杂反应 C 基元反应 D 不能判断6.某基元反应A+B=C 的Ea(正)=600kJ/mol, Ea(逆)=150kJ/mol, 则该反应的热效应Δr H m θ为(A)§3.5A 450kJ/mol B-450kJ/mol C750kJ/mol D375kJ/mol7.对于所有的零级反应,下列叙述中正确的是(B)§3.4A 活化能很低B 反应速率与反应物浓度无关C 反应速率常数为零D 反应速率与时间无关8.一定条件下某一反应的转化率为38%,当有催化剂时,反应条件与前相同,达到平衡时反应的转化率为(C )§3.7A 大于38%B 小于38%C 等于38%D 无法判断二计算题1.某反应A+2B →2P , 试分别用各种物质的浓度随时间的变化率表示反应速率§3.1 解: r=dtc dt c dtc B APd 21d 21d =-=-2.根据质量作用定律, 写出下列基元反应的速率方程§3.3(1) A+B −→−k 2P (2) 2A+B −→−k 2P (3)A+2B −→−k2P+2S解:(1) r=dt c dt c dt c B A Pd 21d d =-=-=k ·C A ·C B (2) r=dtc dt c dt c B A Pd 21d d 21=-=-=k ·C A 2·C B(3) r=dtc dt c dt c dt c sB A d 21d 21d 21d P ==-=-=k ·C A ·C B 23.根据实验, 在一定温度范围内NO 和Cl 2反应是基元反应, 反应式如下:2NO+Cl 2→2NOCl(1)写出质量作用定律的数学表达式,反应级数是多少? (2)其他条件不变,将容积增加一倍, 反应速率变化多少?(3)容积体积不变, 将NO 浓度增加2倍, 反应速率变化多少?§3.3 解(1) r=dtc dt c dt c Cl O (NOCl))()N (d 21d d 212=-=-=k ·C(NO)2·C(Cl 2)反应对NO 是二级,对Cl 2是一级, 反应总级数是3. (2)将容积增加一倍: r ’=k ]2)C [N (O 2]2)C [2Cl (=81k C (NO)2C (Cl2)=81r (3)将NO 浓度增加2倍:r ’’=k [3C (NO)]2 C (Cl2)=9kC (NO)2C (Cl2)=9r4.某人工放射性元素放出α粒子,半衰期为15min ,试计算该试样蜕变(转化率)为80%时需要多少时间。
![第三章__思考题[1]](https://uimg.taocdn.com/542871345a8102d276a22f50.webp)
环境0702,郭雪,07233034第三章 思考题(1) 自由沉淀的颗粒沉速如何计算?答:水中所含悬浮物的大小、形状、性质是十分复杂的,因而影响颗粒沉淀的因素很多。
为了简化讨论,假定:①颗粒外形为球形,不可压缩,也无凝聚性,沉淀过程中其大小、形状和重量等均不变;②水处于静止状态;③颗粒沉淀仅受重力和水的阻力作用。
静水中的悬浮颗粒开始沉淀时,因受重力作用而产生加速运动,但同时水的阻力也增大。
经过一很短的时间后,颗粒在水中的有效重量与阻力达到平衡,此后作等速下沉运动。
等速沉淀的速度常称为沉淀末速度,简称沉速。
如以F 1、F 2分别表示颗粒的重力和水对颗粒的浮力,则颗粒在水中的有效重量为 g d g d g d F F s a )(61616133321ρρπρπρπ-=-=- (1)式中 d ——球体颗粒的直径;ρS 、ρ——分别表示颗粒及水的密度;g ——重力加速度;如以F 3表示水对颗粒沉淀的摩擦阻力,则223u A F λρ= (2)式中 A ——颗粒在沉淀方向上的投影面积,对球形颗粒,A=1/4πd 2 u ——颗粒沉速;λ——阻力系数,它是雷诺数(Re =ρud /μ)和颗粒形状的函数。
根据实验得知,对球形颗粒有如图4-2所示关系,分三段拟合该曲线得Re <1,λ=24/Re (Stokes 式)34.0Re 3Re 24,10Re 13++=<<λ (Pair 式)103<Re <105,λ=0.44 (Newton 式)在等速沉淀情况下,F 1-F 2=F 3,即23381)(61u d g d s ρλπρρπ=-λρρρ3)(4-=s gd u (3)将上述阻力系数公式代人式(4-3)得到相应流态下的沉速计算式。
对于层流,在Re <1时,218)(d g u s μρρ-= (4)这就是Stokes 公式,式中μ为水的粘度。
该式表明:①颗粒与水的密度差(ρs -ρ)愈大,沉速愈快,成正比关系。

第三章污染物毒害作用及机理思考题一、简答题1、简述生物对污染物吸收、富集和污染物对生物毒害的关系。
第一,生物对污染物的吸收---生物对污染物的富集---污染物对生物的毒害作用,总的来说是这样一个过程。
第二,生物对污染物的吸收。
(1)植物,叶片气孔对大气污染物的粘附和吸收;植物的根和叶对水溶性的污染物的吸收。
(2)动物,通过呼吸道、消化道、皮肤等途径将少量的污染物吸收,通过体内肺泡的吞噬,肠道粘膜的吸收等。
(3)微生物,吸收污染物的主要方式是沉淀作用和络合作用,将有毒的污染物转化为微毒害或无毒化合物。
第三,在吸收的基础上,当达到一定数量无法转化时就会富集。
(1)生物体内凡是能与污染物形成稳定结合的物质,都能增加生物富集,从而消除或缓解毒害作用。
(2)不同器官对污染物的富集有很大差异,不同物种对污染物的吸收积累状况也不同。
(3)生物体内污染物的富集量与环境中污染物的浓度成正相关,同时也受作用时间的影响。
(4)生物体内对污染物的富集作用是随着食物链的营养级的增加,富集量逐渐增多,污染物在体内的含量也就越来越多。
第四,污染物对生物的毒害作用必须建立在生物体吸收和富集污染物的基础上。
2、生物为什么会受污染物毒害,在什么情况下才会发生毒害?在对重金属毒害机制进行深入研究后,必须深入到分子水平才能解决受害的内部机制。
郁建栓从生物活性点位、重金属对生物毒性效应的分子机制,以及技术离子对生物大分子活性点位的竞争及其与金属生物毒性的关系方面对此进行了综述。
第一种解释是生物活性位点。
生物活性位点是生物大分子中具有生物活性的基团和物质。
当污染物(重金属)和生物大分子上的活性位点结合,也可以和其他非活性位点结合后,在一定的情况下对生物产生毒性。
第二种解释是重金属对生物毒性效应的分子机制的解释。
当污染物(毒金属离子)进入生物体后,取代生物大分子活性点位上原有的金属,也可以结合在该分子的其他位置。
当有毒金属离子与生物大分子上的活性点位或非活性点位结合后,可以改变生物大分子正常的生理和代谢功能,使生物体表现中毒现象甚至死亡。
·第三章复习题一、单项选择题1、近代中国的社会性质是:( C )A、封建主义社会B、资本主义社会C、半殖民地半封建社会D、新民主主义社会2、近代中国沦为半殖民地半封建社会的根本原因在于(B)A、中国资产阶级的软弱B、帝国主义的侵略C、清政府的腐败无能D、人民的愚昧不觉悟3、由旧民主主义革命转变为新民主主义革命的标志是:(C)A、新文化运动B、辛亥革命C、五四运动D、中国共产党成立4、中国新民主主义革命的领导力量是(C )A、民族资产阶级B、农民阶级C、无产阶级D、城市小资产阶级5、新民主主义革命的前途是:(B)A、建立资产阶级专政的资本主义社会B、经过新民主主义逐渐过渡到社会主义C、立即建立社会主义社会D、实现共产主义6、毛泽东关于党的建设思想最核心的内容和最主要的特点是(A)A、从思想上建设党B、从作风上建设党C、从组织上建设党D、从制度上建设党7、新民主主主义经济纲领规定,对民族工商业实行(C )A、没收B、赎买C、保护D、改造二、多项选择题8、新民主主义革命的对象是:(ABD )A帝国主义、B、封建主义C、农民阶级D、官僚资本主义9、新民主主义革命的的主要动力包括:(ABCD )A、工人阶级B、农民阶级C、城市小资产阶级D、民族资产阶级10、中国的红色政权能够存在和发展的原因是(ABCD)A、中国是一个政治经济发展极不平衡的半殖民地半封建的大国B、有良好的群众基础C、相当力量的正式红军的存在和党的领导D、中国革命形势的继续向前发展11、中国工人阶级的特殊优点是(ABCD)A、身受帝国主义、封建主义和官僚资本主义三重压迫,革命最坚决、最彻底B、与农民有天然的联系,易于结成工农联盟C、分布集中,便于组织,有利于形成强大的革命力量D、富于组织性和纪律性12、在民主革命中,中国共产党战胜敌人的法宝是(ABC)A、武装斗争B、、统一战线、C、党的建设D、群众路线13、毛泽东在《新民主主义论》中提出了党关于新民主主义的基本纲领是(ABD)A、政治纲领B、经济纲领C、军事纲领D、文化纲领三、问答题1.近代中国社会的主要矛盾是什么?答案要点:近代中国半殖民地半封建社会性质,决定了社会主要矛盾是帝国主义和中华民族、封建主义和人民大众的矛盾。
第3章酸碱滴定法思考题1.根据酸碱质子理论,什么是酸?什么是碱?什么是两性物质?各举例说明。
答:酸碱质子理论认为:凡能给出质子(H+)的物质都是酸;如HAc 、HCl 、NH4+凡能接受质子的物质都是碱。
如,NH3 、F-、CO3 2-,可以给出质子,又可以接受质子的物质称为两性物质。
例如HCO3-、H2PO4-。
2.质子理论和电离理论的不同点主要是什么?答:质子理论和电离理论对酸碱的定义不同;电离理论只适用于水溶液,不适用于非水溶液,而质子理论适用于水溶液和非水溶液。
3.判断下面各对物质哪个是酸?哪个是碱?试按强弱顺序排列起来。
-+ -- 2-HAc,Ac ;NH3,NH4 ;HCN,CN ;HF,F;H3PO4,CO3答:酸:H3PO4HF HAc HCN NH4+碱:CO32-NH3CN-Ac-F-4.在下列各组酸碱物质中,哪些属于共轭酸碱对?(1)H3PO4—Na2HPO4;(2)H2SO4-SO42-;(3)H2CO3-CO32-;(4)HAc-Ac-答:属于共轭酸碱对是(4)HAc-Ac-5.写出下列酸的共轭碱:H2PO4 -,NH4+,HPO42-,HCO3-,H2O,苯酚。
答:HPO42-,NH3,PO43-,CO32-,OH-,C6H5O-6.写出下列碱的共轭酸:H2PO4 -,HC2O4-,HPO42-,HCO3-,H2O,C2H5OH。
答:H3PO4,H2C2O4,H2PO4-,H2CO3,H3O+,C2H5OH2+-1-17.HCl要比HAc强得多,在1mol·LHCl和1mol·L HAc溶液中,哪一个酸度较高?它们中和NaOH的能力哪一个较大?为什么?答:1mol·L-1HCl溶液的酸度大。
由于HCl+NaOH NaCl+H2OHAc+NaOHNaAc+H2O1mol·L-1HCl和1mol·L-1HAc消耗的NaOH的量是一样的,所以1mol·L-1HCl和1mol·L-1HAc溶液中和NaOH的能力一样大。
1、棉纺织品前处理有哪几道工序?答:棉织物前处理工序一般有:坯布准备,烧毛,退浆,煮练,漂白,丝光。
2、烧毛是依据什么原理处理织物绒毛的?答:织物烧毛是将平幅织物迅速通过火焰或擦过炽热的金属表面,这时布面上存在的绒毛很快升温而燃烧,而布身比较紧密,升温较慢,在未升到着火点就已离开火焰或炽热的金属表面,从而在不损伤织物的情况下烧去绒毛,使布面光洁美观。
3、退浆几种方法各有什么特点?答: 常用的退浆方法有碱、酸、酶及氧化剂退浆等。
1)碱退浆:碱退浆使用广泛,对各种浆料都有退浆作用,可利用丝光或煮练后的废碱液,故退浆成本低。
另外,碱退浆除了有去除浆料的作用外,对棉纤维上的天然杂质也有分解和去除作用,因而可减轻碱煮练的负担。
其缺点是堆置时间较长,生产效率低。
另外,由于碱退浆时浆料不起化学降解作用,水洗槽中水溶液粘度较大,浆料易重新粘污织物,因此退浆水洗一定要充分。
2)酸退浆:在适宜的条件下,稀硫酸能使淀粉发生一定程度的水解并转化为水溶性较高的产物,易从布面上洗去,获得退浆效果。
但稀硫酸对PVA、PA浆料无分解作用,并且纤维素在酸性条件下也要发生水解,所以,为了减轻棉纤维损伤而又达到较好的退浆效果,常将酸退浆与其它方法联合使用,如碱—酸退浆或酶—酸退浆,而很少单独使用酸退浆。
酸退浆时的浓度、温度、作用时间都要严格控制好,不可过分剧烈,否则会造成纤维脆损。
3)酶退浆淀粉酶能引起淀粉的迅速降解,对去除织物上的淀粉浆极为有效,退浆率很高。
但淀粉酶的活性或活力(催化反应)与加工条件如pH、温度、活化剂或阻化剂有很大关系。
酶退浆工艺简单,操作方便,淀粉浆去除较为完整,同时不损伤纤维。
它的不足之处是不能去除浆料中的油剂和原布上的天然杂质,对化学浆料无退浆作用。
4)氧化剂退浆在氧化剂的作用下,淀粉等浆料发生氧化、降解直至分子链断裂,溶解度增大,经水洗后容易被去除。
氧化剂退浆速率快,效率高,织物白度增加,退浆后织物手感柔软。
第三章 思考题1. 给出下列公式使用条件:(1)0B B SdT Vdp n d μ−+=∑(2)mix ln B B BS R n x Δ=−∑(3)mix ln B B BG RT n x Δ=∑(4) ,ln A mA V x RT Π−=(5)B V n RT Π=(6) *B B B Bp p x γ= (7) B B B B p k c γ=(8) ln ln ()(ln ln A B T T A Bp p )x x ∂∂=∂∂ 2. 下列说法是否正确?为什么?(1) 溶液的化学势等于溶液中各组分的化学势之和。
(2) 对于纯组分,则化学势等于其自由能。
(3) 在同一稀溶液中组分B 的浓度可用B B B x m c 、、表示,其标准态的选择也不同,则相应的化学势也不同。
(4) 气体的标准态都取压力为p θ、温度为T ,且符合理想气体行为的状态,所以纯气体只有一个标准态。
(5) 在同一溶液中,若标准态规定不同,则活度也不同。
(6) 二组分理想溶液的总蒸气压大于任一组分的蒸气分压。
(7) 在298K 时糖水的渗透压与食盐水的渗透压相等。
-10.01mol kg ⋅-10.01mol kg ⋅(8) 在298K 时,A 和B 两种气体单独在某一溶剂中溶解,平衡时相应的亨利系数为和,且已知。
若A 和B 同时溶解在该溶剂中达平衡,当气A kB k A k k >B相中A 和B 的平衡分压相同时,则溶液中A 的浓度大于B 的浓度。
3. 回答下列问题:(1) 在稀溶液中,蒸气压降低,沸点升高,冰点下降,和渗透压现象本质上出于同一原因,请写出联系它们的关系式。
(2) 下列过程均为等温等压过程,根据公式dG SdT Vdp =−+计算得,此结论对否?为什么?0G Δ= (a) 的冰的水,268p θΚ,268p θ→Κ (b) 等温等压下不作非膨胀功的化学反应(c) 等温等压下食盐溶解于水(d)22,373 H O(l),373 H O(g)p p θθΚ→Κ(3) 试比较下列几种状态下水的化学势哪个大?(a)2373,,H O(l)p θΚ (b)2373,,H O(g)p θΚ (c)2373,2,H O(l)p θΚ× (d)2373,2,H O(g)p θΚ× (e)2374,,H O(l)p θΚ (f)2374,,H O(g)p θΚ a 与b 比较,c 与d 比较,e 与f 比较,a 与d 比较,d 与f 比较。
思考题:
1. 什么是自发过程?实际过程一定是自发过程?
2. 为什么热力学第二定律也可表达为:“一切实际过程都是热力学不可逆的”?
3. 可逆过程的热温商与熵变是否相等,为什么? 不可过程的热温商与熵变是否相等?
4. 以下这些说法的错误在哪里?为什么会产生这样的错误?写出正确的说法。
(1)因为
/
B
r
A
S Q T
δ
∆=⎰
,所以只有可逆过程才有熵变;而ΔS>∑δQ Ir/T,所以不可
逆过程只有热温商,但是没有熵变。
(2) 因为ΔS>∑δQ Ir/T,所以系统由初态A 经不同的不可逆过程到达终态B,其熵的变值各不相同。
(3) 因为
/
B
r
A
S Q T
δ
∆=⎰
,所以只要初、终态一定,过程的热温商的值就是一定的,
因而ΔS 是一定的。
5.“对于绝热过程有ΔS≥0,那末由A态出发经过可逆与不可逆过程都到达B态,这样同
一状态B就有两个不同的熵值,熵就不是状态函数了”。
显然,这一结论是错误的,
错在何处?请用理想气体绝热膨胀过程阐述之。
6. 263K 的过冷水结成263K 的冰,ΔS<0,与熵增加原理相矛盾吗?为什么?
7.“p⊙、298K过冷的水蒸气变成298K 的水所放的热Q p,Q p=ΔH,而ΔH只决定于
初、终态而与等压过程的可逆与否无关,因而便可用该相变过程的热Q p,根据ΔS=
Q p/T (T为298 K)来计算系统的熵变”这种看法是否正确?为什么?
8. 如有一化学反应其等压热效应ΔH<0,则该反应发生时一定放热,且ΔS<0,对吗?
为什么?
9. 根据S=lnΩ,而Ω是微粒在空间与能量分布上混乱程度的量度,试判断下述等
温等压过程的ΔS是大于零? 小于零? 还是等于零?
(1) NH4NO3(s)溶于水;
(2) Ag+(aq)+2NH3(g)—→Ag(NH3)2+;
(3)2KClO3(s)—→KCl(s)+3O2(g);
(4)Zn(s)+H2SO4(aq)—→ZnSO4(aq)+H2(g)
10. 物质的标准熵S⊙(298K)值就是该状态下熵的绝对值吗?
11. 式dG T,p,W'=0≤0与式ΔG T,p≤0在意义上有何不同? 为什么用后式判定过程的自发性时不需加上无非体积功的条件呢?
12. “ΔG T,p,W'=0≤0 说明ΔG<0 的过程只能在T,p一定,且W'=0 的条件下才能发生”,这种说法对吗? 为什么?
13. 关于公式ΔG T,p=W R'的下列说法是否正确?为什么?
(1) “系统从A 态到B 态不论进行什么过程ΔG 值为定值且一定等于W'”;
(2) “等温等压下只有系统对外做非体积功时G 才降低”;
(3) “G就是系统中能做非体积功的那一部分能量”。
14. 为什么等温等压下化学反应的自发性不能用ΔH作判据;但有些情况下用ΔH作判据,又能得到正确的结论?
15. 对于ΔH>0,ΔS>0而在常温下不能自发进行的反应改变温度能否使反应自发进
行?为什么?
16. 一般固体分解产生气体时,常常大量吸热,试比较这类固体在低温与高温下的稳定性。
17. 为什么ΔU =∫T dS-∫p d V适用于单组分均相封闭系统的任何过程? 这是否意味着对
这种简单的热力学系统的任何过程∫T dS及∫p d V都分别代表热与功呢?
18. 分别讨论定压下升高温度及定温下增大压力时以下过程的ΔG值如何变化?
(1) 沸点下液体气化为蒸气;
(2) 凝固点下液体凝为固体(如V m(l)>V m(s))。