化学平衡状态的判断
- 格式:pptx
- 大小:179.20 KB
- 文档页数:15


1化学平衡状态的判断1.可逆反应:在密闭容器反应,达到平衡状态的标志是单位时间内生成的同时生成单位时间内生成的同时,生成2n mol NO用、NO、的物质的量浓度变化表示反应速率的比为2:2:1的状态混合气体的颜色不再改变的状态混合气体的平均相对分子质量不再改变的状态.A. B. C. D.2.时,将置于1L密闭的烧瓶中,然后将烧瓶放入的恒温槽中,烧瓶内的气体逐渐变为红棕色:下列结论不能说明上述反应在该条件下已经达到平衡状态的是的消耗速率与的生成速率之比为1:2生成速率与消耗速率相等烧瓶内气体的压强不再变化烧瓶内气体的质量不再变化的物质的量浓度不再改变烧瓶内气体的颜色不再加深烧瓶内气体的平均相对分子质量不再变化烧瓶内气体的密度不再变化.A. B. C. 只有 D. 只有3.对于可逆反应,下列叙述正确的是A. 和化学反应速率关系是B. 达到化学平衡时,C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大D. 若单位时间内生成xmolNO的同时,消耗,则反应达到平衡状态4.对可逆反应,下列叙述正确的是A. 达到化学平衡时,B. 若单位时间内生成x mol NO的同时,消耗x mol ,则反应达到平衡状态C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大D. 化学反应速率关系是:5.一定条件下,容积为1L的密闭容器中发生反应:下列各项中不能说明该反应已达化学平衡状态的是A. B. HF的体积分数不再变化C. 容器内气体压强不再变化D. 容器内气体的总质量不再变化6.下列方法中一定能证明已达平衡状态的是A. 一个键断裂的同时有一个键断裂B. 温度和体积一定时,某一生成物浓度不再变化C. 温度和体积一定时,容器内压强不再变化D. 温度和压强一定时混合气体密度不再变化化学平衡状态的判断1.在一个不传热的固定容积的密闭容器中,可逆反应:,达到平衡的标志是反应速率:::3:2 各组分的物质的量浓度不再改变体系的压强不再发生变化混合气体的密度不变体系的温度不再发生变化单位时间内3mol 断键反应同时2mol 也断键反应.A. 、、、、B. 、、、C. 、、、、 D. 、、、、2.可逆反应达到平衡状态的主要特征是A. 正、逆反应的速率均为零B. 正、逆反应都还在进行C. 正、逆反应的速率相等D. 反应停止了3.在一密闭容器中进行反应:已知反应过程中某一时刻、、的浓度分别为、、当反应达到平衡时,可能存在的数据是A. 为,为B. 为C. 、分别为、D. 为4.在一定温度下,容积一定的密闭容器中发生反应,当下列物理量不再发生变化时,表明反应已达平衡的是混合气体的密度混合气体的压强的物质的量浓度混合气体的总物质的量.A. B. C. D.5.在一个密闭容器中进行如下反应:,反应过程中某一时刻、、Z的浓度分别为、、当反应达到平衡时,下列数据可能合理的是A. Z的浓度为B. 、Z的浓度均为C. 与Z的浓度之和为D. 的浓度为单位时间内生成n mol 的同时生成单位时间内生成n mol 的同时生成2nmolNO用、NO、的物质的量浓度变化表示的反应速率之比为2:2:1的状态混合气体的颜色不再改变的状态混合气体的密度不再改变的状态混合气体的压强不再改变的状态混合气体的平均相对分子质量不再改变的状态、NO、的分子数之比为2:2:1的状态.A. B. C. D.7.在一定条件下,反应紫红色,达到平衡时,要使混合气体的颜色加深,可采取的措施是增大氢气的浓度升高温度降低温度缩小体积增大HI的浓度减小压强.A. B. C. D.8.在一定温度下的密闭固定容积容器中,当下列物理量不再变化时,表明已达平衡的是A. 混合气体的压强B. 混合气体的平均相对分子质量C. 混合气体的分子数目D. 混合气体的总物质的量1化学平衡状态的判断1.恒温条件下,可逆反应:在体积固定的密闭容器中进行,达到平衡状态的标志的是的体积分数不再改变的状态单位时间内生成n mol 的同时生成2n mol NO混合气体的颜色不再改变的状态混合气体的密度不再改变的状态混合气体的平均相对分子质量不再改变的状态.A. B. C. D. 全部2.可逆反应在一定条件下达到化学平衡时,下列说法正确的是A. 正反应速率等于逆反应速率,且都为零B. 反应物和生成物浓度相等C. 反应体系中混合物的组成保持不变D. 断开化学键吸收的能量等于形成化学键所放出的能量.单位时间内生成n 的同时生成2n ;单位时间内生成n 的同时生成2n mol NO;混合气体的颜色不再改变的状态;混合气体中不变;的消耗速率与NO的生成速率相等;容器内压强不随时间变化而变化.A. B. C. D.4.一定条件下,在密闭容器中,能表示反应一定达到化学平衡状态的是、Y、Z的物质的量之比是1:2:2 、Y、Z的浓度不再发生变化容器中的压强不再发生变化单位时间内生成n molZ,同时生成2n mol Y容器中平均相对分子质量不再发生变化,正,逆A. B. C. D.5.可逆反应:在一固定容积的密闭容器中反应,达到平衡状态的标志是单位时间内生成的同时生成单位时间内生成的同时,生成2nmolNO用、NO、物质的量浓度变化表示的反应速率的比为2:2:1的状态混合气体的颜色不再改变的状态混合气体的密度不再改变的状态混合气体的平均相对分子质量不再改变的状态.A. B. C. D.6.温度下反应正反应为吸热反应,在密闭容器中达到平衡,下列说法正确的是加压时体积变小,将使正反应速率增大保持体积不变,加入少许,将使正反应减小;保持体积不变,加入少许,再达到平衡时颜色变深;保持体积不变,升高温度,再达平衡时颜色变深升高温度,正反应速率减小,平衡逆向移动.A. B. C. D.7.时,将置于1L密闭的烧瓶中,然后将烧瓶放入的恒温槽中,烧瓶内的气体逐渐变为红棕色:。

化学平衡状态的判断标准1、本质: V正 = V逆2、现象:浓度保持不变mA(g) + nB(g) = pC(g) + qD(g)本质:v A耗 = v A生 v B耗 = v B生 v C耗 = v C生 v D耗 = v D生v A耗﹕ v B生 = m﹕n ……现象:1、A、B、C、D的浓度不再改变 2、A、B、C、D的分子数不再改变。
3、A、B、C、D的百分含量不再改变。
4、A、B、C、D的转化率或生成率不再改变5、体系温度不再改变6、若某物质有色,体系的颜色不再改变。
引申:mA(g) + nB(g) = pC(g) + qD(g) + Q对 m+n ≠ p+q 的反应(即反应前后气体分子数改变),还可从以下几个方面判断:1、体系的分子总数不再改变2、体系的平均分子量不再改变3、若为恒容体系,体系的压强不再改变4、若为恒压体系,体系的体积、密度不再改变注意:以上几条对m+n = p+q的反应不成立。
以反应mA(g)+nB (g) pC(g)为例,达到平衡的标志为:A的消耗速率与A的生成速率A的消耗速率与C的速率之比等于B的生成速率与C的速率之比等于A的生成速率与B的速率之比等于例题:1、在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明A(s)+3B(g)2C(g)+D(g)已达平衡状态的是 ( )A.混合气体的压强B.混合气体的密度的物质的量浓度 D.气体的总物质的量2、在一定温度下,下列叙述不是可逆反应A(g)+3B(g) 2C(g)+2D(s)达到平衡的标志的是:( )①C的生成速率与C的分解速率相等②单位时间内生成a molA,同时生成3a molB③A、B、C的浓度不再变化④A、B、C的分压强不再变化⑤混合气体的总压强不再变化⑥混合气体的物质的量不再变化⑦ A、B、C、D的分子数之比为1:3:2:2A.②⑦B.②⑤⑦C.①③④⑦D.②⑤⑥⑦元素推断:已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。

专题化学平衡状态的判断文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688]专题——化学平衡状态的判断一、考点分析 化学平衡是高考的热点,化学平衡状态的判断是化学平衡的考点之一,在历年的高考试题中屡有出现。
难度系数在~左右。
二、考查方向1、主要以选择题的形式考查。
2、主要从浓度、速率、压强、密度、颜色、温度、平均摩尔质量等角度考查。
三、解题指导思想1、细心审题,注意关键字词,留心陷阱。
2、运用公式并注意状态与系数。
四、判断方法(大部分资料都介绍以下方法) (一)、判断化学平衡状态的标志1、什么是化学平衡状态 : 化学平衡状态是指一定条件下的可逆反应里,正反应速率=逆反应速率,反应混合物中各组分的含量保持不变的状态。
2、平衡状态的判断方法 : 直接判定: V 正=V 逆 >0①同一物质,该物质的生成速率等于它的消耗速率。
②不同的物质分两种情况:在方程式同一侧的不同物质,它们的生成速率与消耗速率之比(或消耗速率与生成速率之比,前后比较项必须相反)等于反应方程式中化学计量数之比;方程式不同侧的物质,它们的生成速率与生成速率之比(或消耗速率与消耗速率之比,前后比较项必须相同)等于反应方程式中化学计量数之比。
③从微观化学键的断裂与生成判断。
如N 2(g )+3H 2(g )== 2NH 3(g ) 化学键 N ≡N 3H-H 6 N-H 同种物质,新键生成和旧键断裂数目相同同侧不同物质,生成与断裂(或断裂与生成)数目; 不同侧物质,生成与生成(断裂与断裂)数目例1、可逆反应N 2(g )+3H 2(g )== 2NH 3(g )的正逆反应速率可用反应物或生成物的生成或消耗速度来表示下列各关系中能说明反应已达平衡状态的是( )A. 3V (N 2消耗)=V (H 2消耗)B. V (N 2生成)=V (N 2消耗)C. 2V (H 2消耗)=3V (NH 3消耗)D. 2V (N 2生成)=V (NH 3消耗)例2、可逆反应2NO 2(g)= 2NO(g) + O 2(g),在体积固定的密闭容器中,达到平衡状态的( )A 单位时间内生成n mol O 2的同时生成2n mol NO 2B 单位时间内生成n mol O 2的同时生成2n mol NOC 单位时间内生成n mol NO 2的同时消耗n mol NO 2D 用NO 2、NO 、O 2表示的反应速率的比为2 : 2 : 1的状态例3、对可逆反应4NH 3(g) + 5O 2(g)==4NO(g) + 6H 2O(g)下列叙述正确的是( )A 达到化学平衡时4v 正(O 2)=5v 逆(NO)B 若单位时间内生成x mol NO 的同时消耗x mol NH 3则反应达到平衡状态C 达到化学平衡时若增大容器体积,则正反应速率减小,逆反应速率增大D 化学反应速率关系是2v 正(NH 3)=3v 正(H 2O)例3、下列方法中可以说明N 2+3H 2 = 2NH 3已达到平衡的是( )A 一个N ≡N 键断裂的同时有三个H-H 键形成B 一个N ≡N 键断裂的同时有三个H-H 键断裂C 一个N ≡N 键断裂的同时有六个N-H 键断裂D 一个N ≡N 键断裂的同时有六个N-H 键形成间接判定①组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度保持不变。

化学平衡的标志和判断长乐高级中学 黄炳生化学平衡状态的判断:具体表现为“一等六定”:一等:正逆反应速率相等;六定:① 物质的量一定,② 平衡浓度一定,③ 百分含量保持一定,④ 反应的转化率一定,⑤ 产物的产率一定,⑥ 正反应和逆反应速率一定。
除了上述的“一等六定"外,还可考虑以下几点:①同一物质单位时间内的消耗量与生成量相等。
②不同物质间消耗物质的量与生成物质的量之比符合化学方程式中各物质的化学计量数比。
③在一定的条件下,反应物的转化率最大,或产物的产率最大.④对于有颜色变化的可逆反应,颜色不再改变时。
对于反应前后气体总体积变的可逆反应,还可考虑以下几点:①反应混合物的平均相对分子量不再改变.②反应混合物的密度不再改变。
③反应混合物的压强不再改变。
还可以从化学键的生成和断裂的关系去判断是否处于化学平衡状态。
1、等速标志:指反应体系中用同一种物质来表示的正反应速率和逆反应速率相等。
即 V (正)= V (逆)2、各组分浓度不变标志:因为V (正)= V (逆)≠0,所以在同一瞬间、同一物质的生成量等于消耗量。
总的结果是混合体系中各组成成分的物质的量、质量、物质的量浓度;各成分的体积分数、质量分数;转化率等不随时间变化而改变。
3.有气体参与的可逆反应:(1)从反应混合气体的平均相对分子质量(M )考虑:M=m (总)/n (总) ①若各物质均为气体:当气体△n(g )≠0时,若M 一定时,则标志达平衡.如2SO 2(g )+O 2(g ) 2SO 3(g )当气体△n(g )=0时,若M 为恒值,无法判断是否平衡.如H 2(g )+I 2(g) 2HI (g )②若有非气体参加:无论△n(g)≠0或△n(g)=0时,当若M一定时,则标志达平衡。
如C(s)+O2(g)CO2(g)、CO2(g)+ C(s) 2CO(g)(2)从气体密度考虑:密度=质量/体积①若各物质均为气体:A.恒容:密度总为恒值,不能作为平衡标志.B.恒压:a. △n(g)=0时,密度总为恒值,不能作为平衡标志.b. △n(g)≠0时,密度为一定值,则可作为平衡的标志。

专题—-化学平衡状态的判断一、考点分析化学平衡是高考的热点,化学平衡状态的判断是化学平衡的考点之一,在历年的高考试题中屡有出现。
难度系数在0.50~0。
55左右。
二、考查方向1、主要以选择题的形式考查。
2、主要从浓度、速率、压强、密度、颜色、温度、平均摩尔质量等角度考查.三、解题指导思想1、细心审题,注意关键字词,留心陷阱。
2、运用公式并注意状态与系数。
四、判断方法(大部分资料都介绍以下方法)(一)、判断化学平衡状态的标志1、什么是化学平衡状态:化学平衡状态是指一定条件下的可逆反应里,正反应速率=逆反应速率,反应混合物中各组分的含量保持不变的状态。
2、平衡状态的判断方法:直接判定: V正=V逆>0①同一物质,该物质的生成速率等于它的消耗速率。
②不同的物质分两种情况:在方程式同一侧的不同物质,它们的生成速率与消耗速率之比(或消耗速率与生成速率之比,前后比较项必须相反)等于反应方程式中化学计量数之比;方程式不同侧的物质,它们的生成速率与生成速率之比(或消耗速率与消耗速率之比,前后比较项必须相同)等于反应方程式中化学计量数之比。
③从微观化学键的断裂与生成判断.如N2(g)+3H2(g)== 2NH3(g)化学键N≡N 3H-H 6 N—H同种物质,新键生成和旧键断裂数目相同同侧不同物质,生成与断裂(或断裂与生成)数目;不同侧物质,生成与生成(断裂与断裂)数目例1、可逆反应N2(g)+3H2(g)== 2NH3(g)的正逆反应速率可用反应物或生成物的生成或消耗速度来表示下列各关系中能说明反应已达平衡状态的是()A。
3V(N2消耗)=V(H2消耗) B。
V(N2生成)=V(N2消耗)C。
2V(H2消耗)=3V(NH3消耗) D. 2V(N2生成)=V(NH3消耗)例2、可逆反应2NO2(g)= 2NO(g)+ O2(g),在体积固定的密闭容器中,达到平衡状态的( )A 单位时间内生成n mol O2的同时生成2n mol NO2B 单位时间内生成n mol O2的同时生成2n mol NOC单位时间内生成n mol NO2的同时消耗n mol NO2D用NO2、NO、O2表示的反应速率的比为2 : 2 :1的状态例3、对可逆反应4NH3(g)+ 5O2(g)==4NO(g)+ 6H2O(g)下列叙述正确的是( ) A达到化学平衡时4v正(O2)=5v逆(NO)B若单位时间内生成x mol NO的同时消耗x mol NH3则反应达到平衡状态C达到化学平衡时若增大容器体积,则正反应速率减小,逆反应速率增大D化学反应速率关系是2v正(NH3)=3v正(H2O)例3、下列方法中可以说明N2+3H2 = 2NH3已达到平衡的是()A一个N≡N键断裂的同时有三个H—H键形成B一个N≡N键断裂的同时有三个H-H键断裂C一个N≡N键断裂的同时有六个N-H键断裂D一个N≡N键断裂的同时有六个N—H键形成间接判定①组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度保持不变。


一、判断化学平衡状态的标志1、什么是化学平衡状态化学平衡状态是指一定条件下的可逆反应里,正反应速率=逆反应速率,反应混合物中各组分的含量保持不变的状态。
2、平衡状态的判断方法:直接判定: V正=V逆①同一物质:该物质的生成速率等于它的消耗速率。
②不同的物质:速率之比等于方程式中的系数比,但必须是不同方向的速率。
即必须是一个V正一个是V逆之比等于系数比才能判断是平衡状态。
例1、可逆反应:2NO2(g)= 2NO(g) + O2(g),在体积固定的密闭容器中,达到平衡状态的标志是( B )A 单位时间内生成n mol O2的同时生成2n mol NO2B 单位时间内生成n mol O2的同时生成2n mol NOC 用NO2、NO、O2表示的反应速率的比为2 : 2 : 1的状态例2、判断在反应2HI(g) H2(g)+I2(g)中能判断达平衡状态的有2molH-I键断裂就有1molH-H生成(错误)间接判定:①各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度保持不变。
②各组成成分的质量分数、物质的量分数、气体的体积分数保持不变。
③若反应前后的物质都是气体,且系数不等,总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)保持不变。
④反应物的转化率、产物的产率保持不变。
总之:能变的量保持不变说明已达平衡。
二、具体方法注意事项:在研究化学平衡时注意各物质的状态,和左右两边气体系数和是否相等。
在做题时注意用公式推出结论,在进行讨论,在此要注意哪些是可变量,哪些是不变量。
一、密度ρ密度=质量/体积①可逆反应:2NO2(g) =2NO(g) + O2(g),在体积固定的密闭容器中,密度保持不变能否判断是平衡状态(否)原因:在反应中质量不变,体积不变,密度是个恒定量,不随时间的变化而变化。
②可逆反应:2NO2(g) =2NO(g) + O2(g),在压强固定的密闭容器中,密度保持不变能否判断是平衡状态(能)原因:该反应左右两边气体系数不等,说明随着反应的进行体积是变化的,而气体总质量保持不变,所以密度是个变化量,现在不变说明已经达到平衡。

化学平衡状态的判断一、概念:在一定条件下的里,和的速率相等,反应混合物中各组分的浓度的状态叫做化学平衡。
二、特征:“逆”——可逆反应:在同一条件下,和均能进行的化学反应“等”——达到平衡时正反应速率等于逆反应速率,即v(正)=v(逆)≠0。
这是可逆反应达到平衡状态的重要标志。
“定”——达到平衡时,反应混合物中各组分的浓度,这是判断体系是否处于化学平衡状态的重要依据。
“动”——由于化学平衡状态时反应仍在进行,故其是一种“变”——条件改变平衡会发生移动三、判断化学平衡状态的方法(1)利用化学平衡状态的本质:v(正)=v(逆);(异边同,同边异,比例别忘记!)方向:必须代表方向的速率数量:速率之比等于【例1】对可逆反应A(g)+B(g) C(g) 在一定条件下,达到平衡状态的标志是A、v(A消耗)=v(B消耗)B、v(A消耗)=v(B生成)C、v(A消耗)=v(C消耗)D、v(A消耗)=v(C生成)答案:BC解析:四个选项全部和速率有关,且系数均为1,判断是否一个代表v(正),一个代表v(逆):A选项,两个均代表v(正),错误;B选项,v(A消耗)代表v(正),v(B生成)代表v(逆),正确;C选项v(C消耗)也代表v(逆),正确;D选项两个选项代表的均是v(正),错误。
对于这种类型的题目,有六字口诀“同边异,异边同”。
同一边的物质(都是反应物或者都是生成物)一个“消耗”一定量,同时另一个“生成”一定量才可以说明是达到了平衡;而两个不同一边的物质(一个是反应物而另一个是生成物)都“同时消耗”一定量或者“同时生成”一定量也可以表示达到了平衡。
+3H22NH3的正、逆反应速率可用各反应物或生成物浓度的变化【例2】可逆反应N来表示,下列各关系中能说明反应已达到平衡状态的是( )A、v(N2消耗)=v(N2生成)B、2v(N2消耗)=v(NH3生成)C、2v(H2生成)=3v逆(NH3生成)D、v正(N2消耗)=3v(H2生成)答案:AC解析:首先根据方向排除B,然后根据反应速率比等于方程式计量系数比判断D错误。
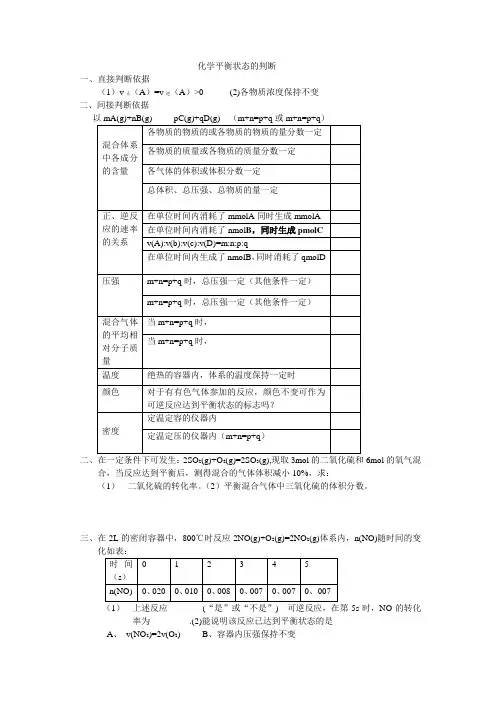
化学平衡状态的判断一、直接判断依据(1)v正(A)=v逆(A)>0 (2)各物质浓度保持不变二、间接判断依据二、在一定条件下可发生:2SO2(g)+O2(g)=2SO3(g),现取3mol的二氧化硫和6mol的氧气混合,当反应达到平衡后,测得混合的气体体积减小10%,求:(1)二氧化硫的转化率。
(2)平衡混合气体中三氧化硫的体积分数。
三、在2L的密闭容器中,800℃时反应2NO(g)+O2(g)=2NO2(g)体系内,n(NO)随时间的变化如表:(1)上述反应________(“是”或“不是”) 可逆反应,在第5s时,NO的转化率为_________.(2)能说明该反应已达到平衡状态的是A、v(NO2)=2v(O2)B、容器内压强保持不变C、v逆(NO)=2v正(O2)D、容器内密度保持不变四、一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)=2C(g)达到平衡标志的是①C 的生成速率与C的消耗速率相等②单位时间内生成a molA,同时生成3 molB③A、B、C的浓度不再变化④C的物质的量不再发生变化⑤混合气体的总压强不再发生变化⑥混合气体的总物质的量不再变化⑦单位时间消耗a molA,同时生成3a molB⑧A、B、C的分子数之比为1:3:2A、②⑧B、④⑦C、①③D、⑤⑥五、在密闭的容器中进行反应:X2(g)+Y2(g)=2Z(g),已知X2、Y2、Z的起始浓度为0.1 mol/L,0.3mol/L,0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是A、Z为0.3mol/L B、Y2为0.4mol/LC、X2为0.2mol/LD、Z为0.4mol/L六、可逆反应:2NO2(g)= 2NO(g)+O2(g),在体积固定的密闭容器内进行,达到平衡状态的标志是:①单位时间内生成n mol的氧气的同时生成2n molNO2②单位时间内生成n mol的氧气的同时生成2n molNO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态七、下列说法可以证明H2(g)+I2(g)= 2HI(g)已达到平衡状态的是_________________(填序号) ①单位时间内生成n molH2的同时,生成n mol的HI②一个H-H键断裂的同时有两个H-I键断裂③百分含量HI%=I2%④反应速率v(H2)=v(I2)=1/2HI(g)⑤c(HI):c(H2):c(I2)=2:1:1⑥温度和体积一定时,某一生成物浓度不再变化⑦温度和体积一定时,容器内压强不再发生变化⑧条件一定,混合气体的平均相对分子质量不再发生变化⑨温度和体积一定时,混合气体颜色不再变化⑩温度和压强一定时,混合气体的密度不再变化八、在一恒温、恒容的密闭容器中发生反应:A(s)+2B(g)= C(g)+D(g),当下列物理量不再发生变化时,能够表明该反应已达到平衡状态的是A、混合气体的压强B、混合气体的平均相对分子质量C、A的物质的量浓度D、气体的总的物质的量稀有气体对化学反应速率的景响定温定容下,向合成氨气的反应中充入稀有气体---------反应的速率___________定温定压下,向合成氨气的反应体系中充入稀有气体------反应的速率___________化学反应的限度任何可逆反应都有一定的限度。

化学平衡状态的判断方法
化学平衡状态的判断方法主要有以下几种:
1、按照反应物和生成物之间的浓度比值来判断,即根据反应物和生成物的浓度在一定条件下是否满足K=
[A]/[B]的关系,如果满足,则表明该反应已经处于平衡状态。
2、根据反应的不变量(不变量指反应过程中,所有相关反应物和生成物的总量)来判断,即反应开始时反应物和生成物的总量与反应结束时反应物和生成物的总量是否相等,若相等,则表明反应已经处于平衡状态。
3、根据反应速率来判断,即反应开始时反应物和生成物的变化速率是否大致相等,若是,则表明反应已经处于平衡状态。
化学平衡状态的判断⽅法有哪些
在⼀定条件下,当⼀个可逆反应的正反应速率与逆反应速率相等时,反应物的浓度与⽣成物的浓度不再改变,达到⼀种表⾯静⽌的状态,即"化学平衡状态"。
如何判断化学反应达到平衡
1.同⼀物质的⽣成速率和分解速率相等
2.反应体系中各物质的物质的量或者浓度,百分含量,体积分数,质量分数,物质的量分数不再改变
3.同⼀物种化学键的断裂和形成数⽬相等
4.有⽓体参加反应,当反应前后⽓体总体积不等的时候,⽓体的平均相对分⼦质量,密度,压强不变
5.若反应为绝热体系,反应体系温度⼀定
6.转化率相同
7.若反应有颜⾊的改变,则颜⾊不变时平衡。
化学平衡状态的特点
化学平衡状态具有逆,等,动,定,变、同六⼤特征。
逆:化学平衡研究的对象是可逆反应。
等:平衡时,正、逆反应速率相等,即v正=v逆。
动:平衡时,反应仍在进⾏,是动态平衡,反应进⾏到了最⼤限度。
定:达到平衡状态时,反应混合物中各组分的浓度保持不变,反应速率保持不变,反应物的转化率保持不变,各组分的含量保持不变。
变:化学平衡跟所有的动态平衡⼀样,是有条件的,暂时的,相对的,当条件发⽣变化时,平衡状态就会被破坏,由平衡变为不平衡,再在新的条件下建⽴新平衡,即化学平衡发⽣了移动。
同:⼀定条件下化学平衡状态的建⽴与反应的途径⽆关。
即⽆论是从正反应开始,还是从逆反应开始,或是从任⼀中间状态开始建⽴,只要外界条件相同,达到平衡时的效果都相同。
1专题——化学平衡状态的判断一、考点分析 化学平衡是高考的热点,化学平衡状态的判断是化学平衡的考点之一,在历年的高考试题中屡有出现。
难度系数在0.50~0.55左右。
二、考查方向1、主要以选择题的形式考查。
2、主要从浓度、速率、压强、密度、颜色、温度、平均摩尔质量等角度考查。
三、解题指导思想1、细心审题,注意关键字词,留心陷阱。
2、运用公式并注意状态与系数。
四、判断方法(大部分资料都介绍以下方法)(一)、判断化学平衡状态的标志1、什么是化学平衡状态 : 化学平衡状态是指一定条件下的可逆反应里,正反应速率=逆反应速率,反应混合物中各组分的含量保持不变的状态。
2、平衡状态的判断方法 :直接判定: V 正=V 逆 >0①同一物质,该物质的生成速率等于它的消耗速率。
②不同的物质分两种情况:在方程式同一侧的不同物质,它们的生成速率与消耗速率之比(或消耗速率与生成速率之比,前后比较项必须相反)等于反应方程式中化学计量数之比;方程式不同侧的物质,它们的生成速率与生成速率之比(或消耗速率与消耗速率之比,前后比较项必须相同)等于反应方程式中化学计量数之比。
③从微观化学键的断裂与生成判断。
如N 2(g )+3H 2(g )== 2NH 3(g )化学键 N ≡N 3H-H 6 N-H同种物质,新键生成和旧键断裂数目相同同侧不同物质,生成与断裂(或断裂与生成)数目;不同侧物质,生成与生成(断裂与断裂)数目例1、N 2(g )+3H 2(g )== 2NH 3(g )的生成或消耗速度来表示下列各关系中能说明反应已达平衡状态的是( )A. 3V (N 2消耗)=V (H 2消耗)B. V (N 2生成)=V (N 2消耗)C. 2V (H 2消耗)=3V (NH 3消耗)D. 2V (N 2生成)=V (NH 3消耗)例2、可逆反应2NO 2(g)= 2NO(g) + O 2(g),在体积固定的密闭容器中,达到平衡状态的( )A 单位时间内生成n mol O 2的同时生成2n mol NO 2B 单位时间内生成n mol O 2的同时生成2n mol NOC 单位时间内生成n mol NO 2的同时消耗n mol NO 2D 用NO 2、NO 、O 2表示的反应速率的比为2 : 2 : 1的状态例3、4NH 3(g) + 5O 2(g)==4NO(g) + 6H 2O(g)( ) A 4v 正(O 2)=5v 逆(NO) B x mol NO 的同时消耗x mol NH3 C ,则正反应速率减小,逆反应速率增大 D 2v 正(NH 3)=3v 正(H 2O)例3、下列方法中可以说明N 2+3H 2 = 2NH 3已达到平衡的是( ) A N ≡N 键断裂的同时有三个H-H 键形成 B N ≡N 键断裂的同时有三个H-H 键断裂 C N ≡N 键断裂的同时有六个N-H 键断裂 D N ≡N 键断裂的同时有六个N-H 键形成间接判定①组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度保持不变。
快速准确判断化学平衡状态的方法景全国赵明翠1.用“等”即v正=v逆①同一物质表示的v正= v逆②不同物质表示的v正︰v逆=它们的化学计量数之比。
例如:4NH3(g)+5O2(g)催化剂加热4NO(g)+6H2O(g)①单位时间内断开3molN-H,同时形成3molN-H,即v(NH3)正= v(NH3)逆②单位时间内断开3molN-H,同时断开3molO-H,即v(NH3)正︰v(H2O)逆=2︰3以上两种状态均为化学平衡状态。
小结:用“等”来判断是否为平衡状态时,第一看描述中有无v正和v逆,第二看是否满足速率与化学计量数成正比。
2.用“定”即各组分浓度不再改变。
①直接有关于某组分浓度不变的描述;②组分中存在有色气体,颜色不再改变;③对于固定容积,有非气体参加或生成时,密度不变;④对于反应前后气体总体积改变的反应,总压强不变;⑤对于全气体且反应前后气体总体积改变的反应,平均相对分子质量不变;⑥对于有非气体参加或生成且气体总体积不变的反应,平均相对分子质量不变;⑦体系温度不再改变;以上7种状况均为化学平衡状态(一定条件下)。
例如:③4NH3(g)+5O2(g)催化剂加热4NO(g)+6H2O(g),密度=m(总)/V,由质量守恒定律知,m(总)不变,V固定不变,密度就不会变,所以不管什么状态密度均不变。
C(s)+ H2O(g)△CO(g)+H2(g),密度不变,则为平衡状态。
④4NH3(g)+5O2(g)催化剂加热4NO(g)+6H2O(g),4+5=9,4+6=10,即反应前后气体总体积改变,总压强不变,为平衡状态;而H2(g)+I2(g)=2HI(g),1+1=2,即反应前后气体总体积不变,总压强不变,不能确定为平衡状态。
⑤4NH3(g)+5O2(g)催化剂加热4NO(g)+6H2O(g),4+5=9,4+6=10,即反应前后气体总物质的量改变,由质量守恒定律知,m(总)不变,气体平均相对分子质量= m(总)/n(总)改变。