硅及其化合物知识结构(附详细方程式)
- 格式:doc
- 大小:38.00 KB
- 文档页数:2

硅及其化合物年月日硅元素在地壳中的含量排第二,在自然界中没有游离态的硅,只有以化合态存在的硅,常见的是二氧化硅、硅酸盐等。
硅的原子结构示意图为,硅元素位于元素周期表第三周期第ⅣA族,硅原子最外层有4个电子,既不易失去电子又不易得到电子,主要形成四价的化合物。
1、单质硅(Si):(1)物理性质:有金属光泽的灰黑色固体,熔点高,硬度大。
(2)化学性质:①常温下化学性质不活泼,只能跟F2、HF和NaOH溶液反应。
Si+2F2=SiF4Si+4HF=SiF4↑+2H2↑Si+2NaOH+H2O=Na2SiO3+2H2↑②在高温条件下,单质硅能与O2和Cl2等非金属单质反应。
Si+O2SiO2Si+2Cl2SiCl4(3)用途:太阳能电池、计算机芯片以及半导体材料等。
(4)硅的制备:工业上,用C在高温下还原SiO2可制得粗硅。
SiO2+2C=Si(粗)+2CO↑Si(粗)+2Cl2=SiCl4SiCl4+2H2=Si(纯)+4HCl2、二氧化硅(SiO2):(1)SiO2的空间结构:立体网状结构,SiO2直接由原子构成,不存在单个SiO2分子。
(2)物理性质:熔点高,硬度大,不溶于水。
(3)化学性质:SiO2常温下化学性质很不活泼,不与水、酸反应(氢氟酸除外),能与强碱溶液、氢氟酸反应,高温条件下可以与碱性氧化物反应:①与强碱反应:SiO2+2NaOH=Na2SiO3+H2O(生成的硅酸钠具有粘性,所以不能用带磨口玻璃塞试剂瓶存放NaOH溶液和Na2SiO3溶液,避免Na2SiO3将瓶塞和试剂瓶粘住,打不开,应用橡皮塞)。
②与氢氟酸反应[SiO2的特性]:SiO2+4HF=SiF4↑+2H2O(利用此反应,氢氟酸能雕刻玻璃;氢氟酸不能用玻璃试剂瓶存放,应用塑料瓶)。
③高温下与碱性氧化物反应:SiO2+CaO CaSiO3(4)用途:光导纤维、玛瑙饰物、石英坩埚、水晶镜片、石英钟、仪器轴承、玻璃和建筑材料等。

高中化学——非金属及化合物知识点总结一、硅及其化合物(一)硅1、硅的存在和物理性质(1)存在:只以化合态存在,主要以SiO2和硅酸盐的形式存在于地壳岩层里,在地壳中含量居第二位。
(2)物理性质:晶体硅是一种灰黑色固体,具有金属光泽,硬而脆的固体,熔沸点较高,能导电,是良好的半导体材料。
2、硅的化学性质3、用途:制造半导体、计算机芯片、太阳能电池。
(二)CO2和SiO2的比较(三)硅酸及硅酸盐1、硅酸(1)物理性质:与一般的无机含氧酸不同,硅酸难溶于水。
(2)化学性质:①弱酸性:是二元弱酸,酸性比碳酸弱,与NaOH溶液反应的化学方程式为:②. 不稳定性:受热易分解,化学方程式为:(3)制备:通过可溶性硅酸盐与其他酸反应制得,如Na2SiO3溶液与盐酸反应:(4)用途:硅胶可用作干燥剂、催化剂的载体等。
2、硅酸盐定义:硅酸盐是由硅、氧、金属所组成的化合物的总称。
(1)硅酸盐结构复杂,一般不溶于水,性质很稳定。
通常用氧化物的形式来表示其组成。
例如:硅酸钠Na2SiO3(Na2O·SiO2),高岭石Al2Si2O5(OH)4(Al2O3·2SiO2·2H2O)。
书写顺序为:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水。
注意事项:① 氧化物之间以“·”隔开;②计量数配置出现分数应化为整数。
(2)硅酸钠:Na2SiO3,其水溶液俗名水玻璃,是一种无色粘稠液体,是一种矿物胶,用作黏合剂和木材防火剂。
(四)常见无极非金属材料及其主要用途(五)总结提升1、硅(1)硅的非金属性弱于碳,但碳在自然界中既有游离态又有化合态,而硅却只有化合态。
(2)硅的还原性强于碳,但碳能还原SiO2产生,但Si能跟碱溶液作用放出(3)非金属单质跟碱溶液作用一般无H2H:2(4)非金属单质一般不跟非氧化性酸反应,但硅能跟氢氟酸反应。
(5)非金属单质一般为非导体,但硅为半导体。
2、二氧化硅(1)非金属氧化物的熔沸点一般较低,但SiO2的熔点却很高。

方程式6 硅及其化合物方程式1. Si与氧气反应的化学方程式:Si + O2高温SiO22.Si与氟气反应的化学方程式:Si + 2F2∆SiF43. Si与Cl2反应的化学方程式:Si + 2Cl2高温SiCl44. Si与NaOH溶液反应化学方程式:Si + 2NaOH + H2O =Na2SiO3 + 2H2 ↑离子方程式:Si + 2OH- + H2O =SiO32- + 2H2 ↑5.Si与HF反应化学方程式:Si + 4HF = SiF4↑ + 2H2↑6.工业制粗硅的化学方程式:SiO2 + 2C高温Si + 2CO↑7.工业由SiCl4制纯硅的化学方程式:SiCl4 + 2H2高温Si + 4HCl8.SiO2与氢氟酸反应的化学方程式:SiO2 + 4HF = SiF4↑ + 2H2O9.SiO2与碱性氧化物(CaO)反应的化学方程式:SiO2 + CaO 高温CaSiO310.SiO2与石灰石反应的化学方程式:S iO2 + CaCO3高温CaSiO3 + CO2↑11.SiO2与强碱NaOH溶液反应的化学方程式:SiO2 + 2NaOH = Na2SiO3 + H2O离子方程式:SiO2 + 2OH -= SiO32-+ H2O12.工业制玻璃的两个反应化学方程式:SiO2 + CaCO3高温CaSiO3 + CO2↑SiO2 + Na2CO3高温Na2SiO3 + CO2↑13.H2SiO3与强碱NaOH溶液的反应:化学方程式:H2SiO3+2NaOH=Na2SiO3+ H2O离子方程式:H2SiO3+2OH-=SiO32-+ H2O14.硅酸的热稳定性很弱,受热分解:化学方程式:H2SiO3∆H2O + SiO215.向硅酸钠溶液中通入足量的CO2的反应:化学方程式:Na2SiO3 + 2CO2 + 2H2O =H2SiO3↓+2NaHCO3离子方程式:SiO32- + 2CO2 + 2H2O =H2SiO3↓+2HCO3-16.向硅酸钠溶液中通入少量的CO2的反应:化学方程式:Na2SiO3 + CO2 + H2O=H2SiO3↓+Na2CO3离子方程式:SiO32- + CO2 + H2O=H2SiO3↓+CO32-17. 向硅酸钠溶液中滴加稀盐酸的反应:化学方程式:Na2SiO3 + 2HCl =H2SiO3↓+2NaCl离子方程式:SiO32- + 2H+=H2SiO3↓方程式7 铝及其化合物方程式1.铝在氧气中燃烧化学方程式4Al + 3O2点燃2Al2O32.铝在氯气中燃烧化学方程式2Al + 3Cl2点燃2AlCl33.铝与硫共热化学方程式2Al + 3S2AlCl34.铝和盐酸反应化学方程式2Al + 6HCl = 2AlCl3 + 3H2↑离子方程式2Al + 6H+ = 2Al3++ 3H2↑硅、铝方程式1。

硅及其化合物TTA standardization office【TTA 5AB- TTAK 08- TTA 2C】硅及其化合物1、硅硅(Si)物理性质灰黑色,有金属光泽,硬而脆的固体,是半导体,具有较高的硬度和熔点。
化学性质与氟气反应Si+2F2=SiF4与氢氟酸反应Si + 4HF = SiF4↑+ 2H2↑与强碱溶液反应Si + 2NaOH + H2O = Na2SiO3 + 2H2↑与氧气反应Si + O2 SiO2粗硅工业制取SiO2 + 2C 高温Si + 2CO↑存在硅元素在地壳中的含量排第二,仅次于氧,是构成矿物和岩石的主要成分。
硅在地壳中全部以化合态形式存在,没有游离态的硅。
用途太阳能电池、计算机芯片以及良好的半导体材料等。
2、二氧化硅二氧化硅(SiO2)空间结构SiO2直接由原子构成,不存在单个SiO2分子。
一个硅连接四个氧原子,一个氧连接两个硅原子,硅、氧原子个数比为2:1.物理性质坚硬难熔的固体,硬度、熔点都很高。
纯净的晶体俗称水晶化学性质与碱性氧化物反应SiO2+ CO2高温 CaSiO3与强碱溶液反应SiO2 + 2NaOH = Na2SiO3 + H2O(碱溶液不能在使用磨口玻璃塞的试剂瓶中)与碳酸盐反应SiO2 + Na2CO3高温 Na2SiO3 + CO2↑ SiO2 + CaCO3高温CaSiO3 + CO2↑与氢氟酸反应SiO2 + 4HF = SiF4↑+ 2H2O(利用此反应,氢氟酸能雕刻玻璃;氢氟酸不能用玻璃试剂瓶存放,应用塑料瓶)存在石英、水晶、玛瑙、硅石、沙子用途光导纤维、玛瑙饰物、石英坩埚、石英钟、仪器轴承、玻璃和建筑材料等。
3、硅酸硅酸(H2SiO3)物理性质不溶于水的白色胶状物,能形成硅胶,吸附水分能力强。
化学性质与强碱溶液反应H2SiO3 + 2NaOH = Na2SiO3 +2H2O加热H2SiO3 H2O + SiO2实验室制取原理H2SiO3是一种弱酸,酸性比碳酸还要弱,但SiO2不溶于水,故不能直接由SiO2溶于水制得,而用可溶性硅酸盐与酸反应制取:(强酸制弱酸原理)Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3(此方程式证明酸性:H2SiO3<H2CO3)Na2SiO3 + 2HCl = H2SiO3↓+ 2NaCl用途硅胶作干燥剂、催化剂的载体。


硅及其化合物年月日硅元素在地壳中的含量排第二,在自然界中没有游离态的硅,只有以化合态存在的硅,常见的是二氧化硅、硅酸盐等。
硅的原子结构示意图为,硅元素位于元素周期表第三周期第ⅣA族,硅原子最外层有4个电子,既不易失去电子又不易得到电子,主要形成四价的化合物。
1、单质硅(Si):(1)物理性质:有金属光泽的灰黑色固体,熔点高,硬度大。
(2)化学性质:①常温下化学性质不活泼,只能跟F2、HF和NaOH溶液反应。
Si+2F2=SiF4Si+4HF=SiF4↑+2H2↑Si+2NaOH+H2O=Na2SiO3+2H2↑②在高温条件下,单质硅能与O2和Cl2等非金属单质反应。
Si+O2高温SiO2Si+2Cl2高温SiCl4(3)用途:太阳能电池、计算机芯片以及半导体材料等。
(4)硅的制备:工业上,用C在高温下还原SiO2可制得粗硅。
SiO2+2C=Si(粗)+2CO↑Si(粗)+2Cl2=SiCl4SiCl4+2H2=Si(纯)+4HCl2、二氧化硅(SiO2):(1)SiO2的空间结构:立体网状结构,SiO2直接由原子构成,不存在单个SiO2分子。
(2)物理性质:熔点高,硬度大,不溶于水。
(3)化学性质:SiO2常温下化学性质很不活泼,不与水、酸反应(氢氟酸除外),能与强碱溶液、氢氟酸反应,高温条件下可以与碱性氧化物反应:①与强碱反应:SiO2+2NaOH=Na2SiO3+H2O(生成的硅酸钠具有粘性,所以不能用带磨口玻璃塞试剂瓶存放NaOH溶液和Na2SiO3溶液,避免Na2SiO3将瓶塞和试剂瓶粘住,打不开,应用橡皮塞)。
②与氢氟酸反应[SiO2的特性]:SiO2+4HF=SiF4↑+2H2O(利用此反应,氢氟酸能雕刻玻璃;氢氟酸不能用玻璃试剂瓶存放,应用塑料瓶)。
③高温下与碱性氧化物反应:SiO2+CaO高温CaSiO3(4)用途:光导纤维、玛瑙饰物、石英坩埚、水晶镜片、石英钟、仪器轴承、玻璃和建筑材料等。

高考重要的无机化学方程式汇总05 碳、硅及其化合物知识点1单质碳的性质1.可燃性:量不同,反应不同(1)少量氧气:2C+O22CO(2)过量氧气:C+O2CO22.与弱氧化性的非金属氧化物反应(1)与水蒸气反应①反应:C+H2O(g)CO+H2②特点:典型的吸热反应③应用:工业上制水煤气(2)与二氧化硅反应①反应:SiO2+2C Si+2CO↑②应用:工业上制粗硅的反应3.与CO2发生归中反应(1)反应:C+CO22CO(2)特点:典型的吸热反应4.与强氧化性的金属氧化物反应(1)与氧化铜反应①碳少量:C+2CuO2Cu+CO2↑②碳过量:C+CuO Cu+CO↑(2)与氧化铁反应①碳少量:3C+2Fe2O34Fe+3CO2↑②碳过量:3C+Fe2O32Fe+3CO↑知识点2碳氧化物的性质1.一氧化碳的性质(1)灼热的CuO①反应:CO+CuO Cu+CO2②应用:检验CO气体③现象:先将气体通过灼热的CuO,变红,再将产生的气体通入澄清石灰水,变浑浊(2)热的高锰酸钾溶液①反应:5CO+2KMnO4+3H2SO45CO2+K2SO4+2MnSO4+3H2O②现象:高锰酸钾溶液紫红色褪去③应用:除去尾气中的CO2.二氧化碳的性质(1)自然界溶洞形成的原因①化学反应:CaCO3+H2O+CO2Ca(HCO3)2②离子反应:CaCO3+H2O+CO2Ca2++2HCO3-(2)自然界钟乳石形成的原因①化学反应:Ca(HCO3)2CaCO3↓+H2O+CO2↑②离子反应:Ca2++2HCO3-CaCO3↓+H2O+CO2↑3.二氧化碳的制备(1)实验室制备二氧化碳①化学反应:CaCO3+2HCl CaCl2+CO2↑+H2O②离子反应:CaCO3+2H+Ca2++CO2↑+H2O(2)工业上制备二氧化碳①反应:CaCO3CaO+CO2↑②特点:典型的吸热反应知识点3单质硅的性质1.与氢氟酸反应(1)反应:Si+4HF SiF4↑+2H2↑(2)应用:用氢氟酸腐蚀芯片2.与氢氧化钠溶液反应(1)化学反应:Si+2NaOH+H2O Na2SiO3+2H2↑(2)离子反应:Si+2OH-+H2O SiO32-+2H2↑(3)反应原理①置换反应:Si+3H2O H2SiO3+2H2↑②中和反应:H2SiO3+2NaOH Na2SiO3+2H2O③转移电子的表示④还原剂是Si,氧化剂是H2O3.工业制法(1)流程一:SiO2粗硅SiCl4高纯硅①SiO2+2C Si+2CO↑②Si+2Cl2SiCl4③SiCl4+2H2Si+4HCl(2)流程二:SiO2粗硅SiHCl3高纯硅①Si+3HCl SiHCl3+H2②SiHCl3+H2Si+3HCl(3)特别提醒①SiHCl3中,硅显+4价,氢和氯均显-1价②SiHCl3的水解反应:SiHCl3+3H2O H2SiO3↓+3HCl+H2↑知识点4二氧化硅的性质1.与氢氟酸反应(特殊反应)(1)反应:SiO2+4HF SiF4↑+2H2O(2)应用①雕刻玻璃的原理②氢氟酸盛放在塑料瓶或铅制容器中2.工业上制玻璃(1)反应①SiO2+Na2CO3Na2SiO3+CO2↑②CaCO3+SiO2CaSiO3+CO2↑(2)原理:难挥发性酸性氧化物制挥发性酸性氧化物知识点5硅酸钠的性质1.与盐酸反应(1)化学反应:Na2SiO3+2HCl2NaCl+H2SiO3↓(2)离子反应:SiO32-+2H+H2SiO3↓2.与碳酸反应:量不同,反应不同(1)少量CO2①化学反应:Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3②离子反应:SiO32-+CO2+H2O H2SiO3↓+CO32-(2)过量CO2①化学反应:Na2SiO3+2CO2+2H2O H2SiO3↓+2NaHCO3②离子反应:SiO32-+2CO2+2H2O H2SiO3↓+2HCO3-。

硅及其化合物硅元素在地壳中的含量排第二,在自然界中没有游离态的硅,只有以化合态存在的硅,常见的是二氧化硅、硅酸盐等。
硅原子最外层有4个电子,既不易失去电子又不易得到电子,主要形成四价的化合物。
1、单质硅(Si):⑴物理性质:有金属光泽的灰黑色固体,熔点高,硬度大。
⑵化学性质:①常温下化学性质不活泼,只能跟F2、HF和NaOH溶液反应。
Si+2F2=SiF4Si+4HF=SiF4↑+2H2↑Si+2NaOH+H2O=Na2SiO3+2H2↑②在高温条件下,单质硅能与O2和Cl2等非金属单质反应。
Si+O2高温SiO2Si+2Cl2高温SiCl4⑶用途:太阳能电池、计算机芯片以及半导体材料等。
⑷硅的制备:工业上,用C在高温下还原SiO2可制得粗硅。
SiO2+2C=Si(粗)+2CO↑ Si(粗)+2Cl2=SiCl4SiCl4+2H2=Si(纯)+4HCl2、二氧化硅(SiO2):⑴SiO2的空间结构:立体网状结构,SiO2直接由原子构成,不存在单个SiO2分子。
⑵物理性质:熔点高,硬度大,不溶于水。
⑶化学性质:SiO2常温下化学性质很不活泼,不与水、酸反应(氢氟酸除外),能与强碱溶液、氢氟酸反应,高温条件下可以与碱性氧化物反应:①与强碱反应:SiO2+2NaOH=Na2SiO3+H2O(生成的硅酸钠具有粘性,所以不能用带磨口玻璃塞试剂瓶存放NaOH溶液和Na2SiO3溶液,避免Na2SiO3将瓶塞和试剂瓶粘住,打不开,应用橡皮塞)。
②与氢氟酸反应[SiO2的特性]:SiO2+4HF=SiF4↑+2H2O(利用此反应,氢氟酸能雕刻玻璃;氢氟酸不能用玻璃试剂瓶存放,应用塑料瓶)。
③高温下与碱性氧化物反应:SiO2+CaO 高温CaSiO3⑷用途:光导纤维、玛瑙饰物、石英坩埚、水晶镜片、石英钟、仪器轴承、玻璃和建筑材料等。
3、硅酸(H2SiO3):⑴物理性质:不溶于水的白色胶状物,能形成硅胶,吸附水分能力强。
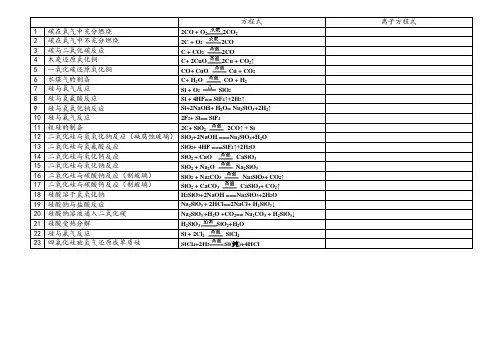
方程式离子方程式1 碳在氧气中充分燃烧2CO + O2CO222 碳在氧气中不充分燃烧2C + O22CO3 碳与二氧化碳反应 C + CO2CO24 木炭还原氧化铜C+ 2CuO2Cu + CO↑25 一氧化碳还原氧化铜CO+ CuO Cu + CO26 水煤气的制备C+ HO CO + H227 硅与氧气反应Si + O2SiO28 硅与氢氟酸反应Si + 4HF== SiF4↑+2H2↑9 硅与氢氧化钠反应Si+2NaOH+ H2O= Na2SiO3+2H2↑10 硅与氟气反应2F2+ Si== SiF411 粗硅的制备2C+ SiO2CO↑ + Si212 二氧化硅与氢氧化钠反应(碱腐蚀玻璃)SiO2+2NaOH ===Na2SiO3+H2O13 二氧化硅与氢氟酸反应SiO2+ 4HF ===SiF4↑+2H2O14 二氧化硅与氧化钙反应SiO+ CaO CaSiO3215 二氧化硅与氧化钠反应SiO+ Na2O Na2SiO3216 二氧化硅与碳酸钠反应(制玻璃)SiO+ Na2CO3Na2SiO3+ CO2↑217 二氧化硅与碳酸钙反应(制玻璃)SiO+ CaCO3CaSiO3+ CO2↑218 硅酸溶于氢氧化钠H2SiO3+2NaOH ===Na2SiO3+2H2O19 硅酸钠与盐酸反应Na2SiO3 + 2HCl==2NaCl+ H2SiO3↓20 硅酸钠溶液通入二氧化碳Na2SiO3 +H2O +CO2== Na2CO3 + H2SiO3↓21 硅酸受热分解H2SiO3SiO2+H2O22 硅与氯气反应Si + 2ClSiCl4223 四氯化硅被氢气还原成单质硅SiCl+2H2Si(纯)+4HCl4。

硅及其化合物知识总结1.硅单质(Si)(1)存在:硅是一种亲氧元素,在自然界中以化合态存在,在地壳中的含量仅次于氧。
(2)物理性质:晶体硅是灰黑色固体,硬度大,熔、沸点高,具有金属光泽。
(3)化学性质:常温下能与F 2、HF 、NaOH 反应;加热时能与H 2化合生成不稳定的氢化物SiH 4,还能与Cl 2、O 2化合分别生成SiCl 4、SiO 2。
涉及的化学方程式如下:2:Si +O 2=====△SiO 22:Si +2F 2===SiF 42:Si +2Cl 2=====△SiCl 4②与氢氟酸反应:Si +4HF===SiF 4↑+2H 2↑。
③与NaOH 溶液反应:Si +2NaOH +H 2O===Na 2SiO 3+2H 2↑(4)用途:①良好的半导体材料;②太阳能电池;③计算机芯片。
(5)高纯硅的制备①SiO 2+2C=====高温Si(粗)+2CO ↑(1800~2000℃)②③2.二氧化硅(SiO 2)(1)存在与形态SiO 2的存在形态有结晶形和无定形两大类。
自然界中的二氧化硅,存在于沙子、水晶、玛瑙,石英等中。
(2)结构SiO 2是由Si 原子和O 原子按个数比1∶2直接构成的立体网状结构的晶体。
(3)二氧化硅与二氧化碳都是酸性氧化物,二者的性质与用途比较性质与用途二氧化硅二氧化碳物理性质硬度大,熔、沸点高,不溶于水熔、沸点低,可溶于水化学性质与水反应不反应CO 2+H 2OH 2CO 3与酸反应(只与HF 反应)氢氟酸用于刻蚀玻璃:SiO 2+4HF===SiF 4↑+2H 2O不反应与碱反应(如NaOH)SiO 2+2NaOH===Na 2SiO 3+H 2O(盛碱液的试剂瓶不能用玻璃塞)CO 2+2NaOH===Na 2CO 3+H 2O 或CO 2+NaOH===NaHCO 3与盐反应(如Na 2CO 3)SiO 2+Na 2CO 3=====高温Na 2SiO 3+CO 2↑CO 2+Na 2CO 3+H 2O===2NaHCO 3与碱性氧化物反应与CaO 反应:SiO 2+CaO=====高温CaSiO 3与Na 2O 反应:CO 2+Na 2O===Na 2CO 3与碳反应2C +SiO 2=====高温Si +2CO ↑C +CO 2=====高温2CO 主要用途制光学仪器、石英玻璃;水晶和玛瑙可制作饰品;常用来制造通讯材料——光导纤维;以SiO 2为主要成分的沙子是基本的建筑材料化工原料、灭火剂;干冰用作制冷剂,人工降雨3.硅酸(H 2SiO 3)(1)物理性质:难溶于水的白色胶状物质。
方程式离子方程式1碳在氧气中充分燃烧2CO + O22CO22碳在氧气中不充分燃烧2C + O22CO3碳与二氧化碳反应 C + CO22CO4木炭还原氧化铜C+ 2CuO2Cu + CO2↑5一氧化碳还原氧化铜CO+ CuO Cu + CO26水煤气的制备C+ H2O CO + H27硅与氧气反应Si + O2 SiO28硅与氢氟酸反应Si + 4HF== SiF4↑+2H2↑9硅与氢氧化钠反应Si+2NaOH+ H2O= Na2SiO3+2H2↑10硅与氟气反应2F2+ Si== SiF411粗硅的制备2C+ SiO22CO↑ + Si12二氧化硅与氢氧化钠反应(碱腐蚀玻璃)SiO2+2NaOH ===Na2SiO3+H2O13二氧化硅与氢氟酸反应SiO2+ 4HF ===SiF4↑+2H2O14二氧化硅与氧化钙反应SiO2 + CaO CaSiO315二氧化硅与氧化钠反应SiO2 + Na2O Na2SiO316二氧化硅与碳酸钠反应(制玻璃)SiO2 + Na2CO3 Na2SiO3+ CO2↑17二氧化硅与碳酸钙反应(制玻璃)SiO2 + CaCO3 CaSiO3+ CO2↑18硅酸溶于氢氧化钠H2SiO3+2NaOH ===Na2SiO3+2H2O19硅酸钠与盐酸反应Na2SiO3 + 2HCl==2NaCl+ H2SiO3↓20硅酸钠溶液通入二氧化碳Na2SiO3 +H2O +CO2== Na2CO3 + H2SiO3↓21硅酸受热分解H2SiO3SiO2+H2O22硅与氯气反应Si + 2Cl2 SiCl423四氯化硅被氢气还原成单质硅SiCl4+2H2Si(纯)+4HCl。