碳、硅及其化合物知识系统及重要化学方程式的再书写
- 格式:docx
- 大小:674.38 KB
- 文档页数:5

第 1 页 共 1 页 碳、硅和碳、硅的化合物常用化学方程式与碳有关的化学方程式:)、(——————3233224HCO CO CO H CO CO C CH 一、C +CO 22CO C +H 2O CO +H 2(生成水煤气) 二、Fe 2O 3+3CO2Fe +3CO 2 CO +H 2O CO 2+H 2 三、Ca(HCO 3)2CaCO 3+CO 2↑+H 2O CaCO 3CaO +CO 2↑ MgCO 3MgO +CO 2↑ 四、C 与浓硫酸共热:C +2H 2SO 4CO 2↑+2SO 2↑+2H 2O C 与浓硝酸共热:C +4HNO 3CO 2↑+4NO 2↑+2H 2O 与硅有关的化学方程式:)(————233224SiO S iO H S iO S i S iH 一、硅的制取:①SiO 2+2CSi +2CO ↑(制得粗硅) ②Si (粗)+2Cl 2SiCl 4 ③SiCl 4+2H 2Si (纯)+4HCl 二、Si 的性质1.与非金属反应:Si +O 2SiO 2 Si +2F 2===SiF 42.Si 和氢氟酸反应:Si +4HF===SiF 4+2H 2↑3.Si 和NaOH 溶液反应:Si +2NaOH +H 2O===Na 2SiO 3+2H 2↑ Si +2OH -+H 2O===SiO 32-+2H 2↑三、SiO 2的性质(酸性氧化物)1.和NaOH 溶液反应:2NaOH +SiO 2===Na 2SiO 3+H 2O (常温下强碱缓慢腐蚀玻璃)2OH -+SiO 2===SiO 32-+H 2O2.和氢氟酸反应:SiO 2+4HF===SiF 4+2H 2O (氢氟酸腐蚀玻璃)3.和CaO 反应:CaO +SiO 2===CaSiO 3四、H 2SiO 3(弱酸性,不溶于水)1.H 2SiO 3制取:Na 2SiO 3+2HCl===2NaCl +H 2SiO 3↓(H 4SiO 4===H 2SiO 3↓+H 2O )五、Na 2SiO 31.与酸反应:Na 2SiO 3+CO 2+H 2O===H 2SiO 3↓+Na 2CO 3(说明H 2SiO 3酸性比碳酸弱)SiO 32-+CO 2+H 2O===CO 32-+H 2SiO 3↓(CO 2过量则生成HCO 3-) SiO 32-+2CO 2+2H 2O===2HCO 3-+H 2SiO 3↓2.Na 2CO 3高温条件下与SiO 2反应:Na 2CO 3+SiO 2Na 2SiO 3+CO 2↑ 3.CaCO 3高温条件下与SiO 2反应:CaCO 3+SiO 2CaSiO 3+CO 2↑。

碳硅及其重要化合物的化学方程式总结碳是地壳中被广泛存在的元素之一,它在地球上的循环过程中起着重要作用。
碳的化学方程式既可以描述它与其他元素的反应,也可以描述其重要化合物的合成和分解过程。
下面是一些碳及其重要化合物的化学方程式:碳与氧气反应会产生二氧化碳:C+O2-->CO2碳与水蒸气反应会产生一氧化碳和氢气:C+H2O-->CO+H2碳和硫的反应会产生二硫化碳:C+2S-->CS2碳和氯气反应会产生四氯化碳:C+2Cl2-->CCl4碳与氧化钙反应会生成氧化碳:C+CaO-->CaCO3碳和氢气反应会产生甲烷:C+2H2-->CH4碳与氯乙烯反应会生成四氯化碳和乙烯:C2H3Cl+5Cl2-->CCl4+2C2H4碳与氢氧化钠反应可以制备乙炔:2C+NaOH-->Na2CO3+C2H2这些化学方程式描述了碳与氧、氢、硫以及其他元素的反应。
除此之外,碳还能与其他非金属元素如氮、氟和氯等进行反应,生成一系列化合物。
硅是地壳中含量最丰富的非金属元素之一,它也具有重要的化学性质。
硅的化学方程式可以描述其与氧气、水和酸的反应,以及其重要化合物的合成和分解过程。
硅与氧气反应会生成二氧化硅:Si+O2-->SiO2硅与水反应会生成硅酸:Si+2H2O-->Si(OH)4硅与氢氟酸反应会产生气体六氟硅酸:Si+6HF-->H2SiF6+2H2硅与氯气反应会生成硅四氯化物:Si+2Cl2-->SiCl4硅与氢气反应会生成硅化钙:Si+CaH2-->CaSi2硅与硝酸反应会生成硝酸硅酯:Si+4HNO3-->Si(ONO)4+2H2O除了与氧、氢、氟和氯等元素的反应,硅还能与其他非金属元素如硫、磷等发生反应并形成相应的化合物。
总结起来,碳和硅是地壳中含量较丰富的元素之一,它们的化学方程式描述了它们与其他元素的反应以及重要化合物的合成和分解过程。

高中化学必修一非金属单质碳硅知识点总结
虽然考前刷历年真题很重要,但是在刷题之前一定要扎实基础。
高中化学知识点又繁多,所以一定要梳理清思路。
小编整理了高考考前复习,高中化学必修一非金属单质碳硅知识点如下。
1.碳、硅元素的原子结构与存在
2.碳、硅单质的性质
(1)碳、硅的物理性质和用途
(2)碳、硅的化学性质
①碳单质的化学性质——还原性
②硅的化学性质——还原性
3.硅的工业制法
(1)制取粗硅
工业上,用焦炭在电炉中还原二氧化硅得到含有少量杂质的粗硅。
注意:
A.用焦炭还原SiO2,产物是CO而不是CO2。
B.粗硅中含碳等杂质,与Cl2反应生成的SiCl4中也含CCl4等杂质,经过分馏提纯SiCl4后,再用H2还原,得到高纯度硅。


课时1 碳、硅及其重要化合物知识点一 碳、硅单质及其氧化物【考必备·清单】1.碳、硅的存在形态、物理性质和用途[名师点拨] ①碳单质的结构不同导致物理性质不同,但化学性质相似。
②同素异形体之间的转化是化学变化,但不是氧化还原反应。
2.碳、硅单质的化学性质 (1)碳单质的化学性质——还原性 ①与O 2的反应(用化学方程式表示) O 2不足:2C +O 2=====点燃2CO ; O 2充足:C +O 2=====点燃CO 2。
②与其他物质的反应(用化学方程式表示)a .与CuO 反应:C +2CuO=====高温2Cu +CO 2↑(可用于金属的冶炼); b .与CO 2反应:C +CO 2=====高温2CO ;c .与水蒸气反应:C +H 2O(g)=====高温CO +H 2(制水煤气);d .与浓硫酸反应:C +2H 2SO 4(浓)=====△CO 2↑+2SO 2↑+2H 2O 。
(2)硅单质的化学性质——还原性 ①与O 2反应:Si +O 2=====△SiO 2;②与氢氟酸反应(用化学方程式表示,下同):Si +4HF===SiF 4↑+2H 2↑; ③与NaOH 溶液反应:Si +2NaOH +H 2O===Na 2SiO 3+2H 2↑。
3.硅的制备(1)原料:二氧化硅、焦炭。
(2)原理:SiO 2+2C=====高温Si(粗)+2CO↑。
(3)提纯:Si(粗)+2Cl 2=====△SiCl 4,SiCl 4+2H 2=====高温Si(纯)+4HCl 。
4.碳和硅的氧化物(1)一氧化碳:无色无味的有毒气体,不溶于水,可用作气体燃料和冶金工业的还原剂。
(2)二氧化碳和二氧化硅 CO 2+H 2OH 2CO 3[名师点拨] ①CO 2与水反应生成碳酸,但SiO 2不溶于水,不能用SiO 2与水反应制备硅酸。
②SiO 2既能与HF 反应,又能与NaOH 溶液反应,但SiO 2不是两性氧化物。

物理曲线运动练习全集含解析一、高中物理精讲专题测试曲线运动1.如图所示,在风洞实验室中,从A 点以水平速度v 0向左抛出一个质最为m 的小球,小球抛出后所受空气作用力沿水平方向,其大小为F ,经过一段时间小球运动到A 点正下方的B 点 处,重力加速度为g ,在此过程中求(1)小球离线的最远距离; (2)A 、B 两点间的距离; (3)小球的最大速率v max .【答案】(1)202mv F(2)22022m gv F (3)2220 4v F m g F【解析】 【分析】(1)根据水平方向的运动规律,结合速度位移公式和牛顿第二定律求出小球水平方向的速度为零时距墙面的距离;(2)根据水平方向向左和向右运动的对称性,求出运动的时间,抓住等时性求出竖直方向A 、B 两点间的距离;(3)小球到达B 点时水平方向的速度最大,竖直方向的速度最大,则B 点的速度最大,根据运动学公式结合平行四边形定则求出最大速度的大小; 【详解】(1)将小球的运动沿水平方向沿水平方向和竖直方向分解 水平方向:F =m a x v 02=2a x x m解得:202m mv x F= (2)水平方向速度减小为零所需时间01xv t a = 总时间t =2t 1竖直方向上:22202212m gv y gt F== (3)小球运动到B 点速度最大 v x =v 0 V y =gt222220max 4x y v v v v F m g F==++【点睛】解决本题的关键将小球的运动的运动分解,搞清分运动的规律,结合等时性,运用牛顿第二定律和运动学公式进行求解.2.如图所示,半径R=2.5m 的竖直半圆光滑轨道在B 点与水平面平滑连接,一个质量m=0.50kg 的小滑块(可视为质点)静止在A 点.一瞬时冲量使滑块以一定的初速度从A 点开始运动,经B 点进入圆轨道,沿圆轨道运动到最高点C,并从C 点水平飞出,落在水平面上的D 点.经测量,D 、B 间的距离s1=10m,A 、B 间的距离s2=15m,滑块与水平面的动摩擦因数 ,重力加速度.求:(1)滑块通过C 点时的速度大小;(2)滑块刚进入圆轨道时,在B 点轨道对滑块的弹力; (3)滑块在A 点受到的瞬时冲量的大小. 【答案】(1) (2)45N (3)【解析】 【详解】(1)设滑块从C 点飞出时的速度为v c ,从C 点运动到D 点时间为t 滑块从C 点飞出后,做平抛运动,竖直方向:2R=gt 2 水平方向:s 1=v c t 解得:v c =10m/s(2)设滑块通过B 点时的速度为v B ,根据机械能守恒定律 mv B 2=mv c 2+2mgR 解得:v B =10m/s设在B 点滑块受轨道的压力为N ,根据牛顿第二定律:N-mg=m解得:N=45N(3)设滑块从A 点开始运动时的速度为v A ,根据动能定理;-μmgs 2=mv B 2-mv A 2 解得:v A =16.1m/s设滑块在A点受到的冲量大小为I,根据动量定理I=mv A解得:I=8.1kg•m/s;【点睛】本题综合考查动能定理、机械能守恒及牛顿第二定律,在解决此类问题时,要注意分析物体运动的过程,选择正确的物理规律求解.3.如图所示,光滑的水平地面上停有一质量,长度的平板车,平板车左端紧靠一个平台,平台与平板车的高度均为,一质量的滑块以水平速度从平板车的左端滑上平板车,并从右端滑离,滑块落地时与平板车的右端的水平距离。

碳、硅及其化合物的化学方程式和离子方程式碳硅及其化合物的化学方程式和离子方程式碳及其化合物的化学方程式和离子方程式一、碳1、碳在少量的氧气中燃烧:2C+O22、碳在足量的氧气中燃烧:C+O23、碳和硫蒸气高温反应:C+2S2CO CO2 CS22Fe+3CO2 ↑4、碳和氧化铁在高温下反应:2Fe2O3+3C5、碳粉与氧化铜共热:2CuO+C6、碳和水蒸气高温反应:C+H2O7、碳和二氧化碳在高温下反应:C+CO28、碳与浓硫酸共热:C+2H2SO49、碳与浓硝酸共热:C+4HNO310、碳与稀硝酸共热:3C+4HNO311、工业上制备粗硅:SiO2+2C12、工业上制备金刚砂:SiO2+3C13、工业上制备碳化钙:CaO+3C二、一氧化碳1、一氧化碳在氧气中燃烧:2CO+O22Cu+CO2 ↑ CO+H22COCO2 ↑+2SO2 ↑+2H2O CO2 ↑+4NO2 ↑+2H2O 3CO2 ↑+4NO ↑+2H2O Si +2CO↑ SiC+2CO↑ CaC2+CO↑2CO22Fe+3CO22、一氧化碳气体和氧化铁在高温下反应:Fe2O3+3CO3、一氧化碳通过灼热的氧化铜:CuO+CO4、一氧化碳和水蒸气反应:CO+H2O三、二氧化碳1、镁在二氧化碳中燃烧:2Mg+CO22、碳和二氧化碳在高温下反应:C+CO2 Cu+CO2 CO2+H22MgO+C2CO3、氧化钠与二氧化碳反应:Na2O+CO24、氧化钙与二氧化碳反应:CaO+CO2Na2CO3 CaCO32Na2CO3+O2 ↑5、过氧化钠与二氧化碳反应:2Na2O2+2CO26、二氧化碳和水反应:CO2+H2OH2CO37、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO22OH+CO28、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2OH+CO29、工业上生产碳铵:NH3+CO2+H2ONH4HCO3--Na2CO3+H2O CO32+H2O-NaHCO3 HCO3-10、向澄清石灰水中通入二氧化碳:Ca(OH)2+CO2 Ca2+2OH+CO2+-CaCO3 ↓+H2OCaCO3 ↓+H2O 2NaHCO3 2HCO32NaHCO32NaHCO3↓-11、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2 OCO32+CO2+H2O-12、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2 O+-2Na+CO32+CO2+H2O13、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2 O2AlO2+CO2+3H2O14、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2 OAlO2+CO2+2H2O15、向硅酸钠通入中通入少量的二氧化碳:Na2SiO3+CO2+H2OSiO32+CO2+H2---2Al(OH)3 ↓+Na2CO3 2Al(OH)3 ↓+CO32-Al(OH)3 ↓+NaHCO3 Al(OH)3 ↓+HCO3 H2SiO3 ↓+Na2CO3 CO32+H2SiO3 ↓--16、向硅酸钠通入中通入过量的二氧化碳:Na2SiO3+2CO2+2H2OSiO32+2CO2+2H2O-H2SiO3 ↓+2NaHCO3 2HCO3+H2SiO3 ↓-17、向碳酸钙的悬浊液通入二氧化碳气体:CaCO3+CO2+H2OCaCO3+CO2+H2O18、向苯酚钠溶液中通入二氧化碳气体:C6H5ONa+CO2+H2C6H5O+CO2+H2O19、向次氯酸钠溶液中通入二氧化碳气体:NaClO+CO2+H2OClO+CO2+H2O20、向次氯酸钙溶液中通入二氧化碳: Ca(ClO)2+CO2+H2OCa2+2ClO+CO2+H2O+---Ca(HCO3)2 Ca2+2HCO3+-C6H5OH+NaHCO3 C6H5OH+HCO3 HClO+NaHCO3 HClO+HCO3 --CaCO3 ↓+2HClOCaCO3 ↓+2HClO四、碳酸钙1、碳酸钙溶于稀盐酸:CaCO3+2HClCaCO3+2H+CaCl2+CO2 ↑+H2O Ca2+CO2 ↑+H2O+2、碳酸钙溶于醋酸:CaCO3+2CH3COOH CaCO3+2CH3COOH3、碳酸钙溶于氯化铁溶液: 3CaCO3+2FeCl3+3H2O3CaCO3+2Fe3+3H2O+(CH3COO)2Ca+CO2 ↑+2H2O 2CH3COO+Ca2+CO2 ↑+H2O -+2Fe(OH)3 +3CaCl2+3CO2 ↑ 2Fe(OH)3 +3CO2 ↑+3Ca2+4、碳酸钙高温条件下与二氧化硅反应:CaCO3+SiO25、高温分解碳酸钙:CaCO3CaO+CO2 ↑CaSiO3+CO2 ↑6、向碳酸钙的悬浊液通入二氧化碳气体:CaCO3+CO2+H2OCaCO3+CO2+H2O五、碳酸氢钙1、碳酸氢钙与盐酸反应:Ca(HCO3)2 +2HClHCO3+H-+Ca(HCO3)2 Ca2+2HCO3+-CaCl2+2CO2 ↑+2H2OCO2 ↑+H2O2、向碳酸氢钙溶液中加入少量氢氧化钠溶液: Ca(HCO3)2 +NaOHCa2+HCO3+OH+--CaCO3 ↓+NaHCO3+H2O CaCO3 ↓+H2O3、向碳酸氢钙溶液中加入足量氢氧化钠溶液: Ca(HCO3)2 +2NaOH Ca2+2HCO3+2OH+--CaCO3 ↓+Na2CO3+2H2O CaCO3 ↓+CO32+2H2O-4、向碳酸氢钙溶液中加入石灰水:Ca(HCO3)2 +Ca(OH)2 Ca2+HCO3+-2CaCO3 ↓+2H2OCaCO3 ↓+H2O5、加热碳酸氢钙:Ca(HCO3)2CaCO3 ↓+CO2 ↑+H2OCaCO3 ↓+2NaHCO36、碳酸氢钙溶液与碳酸钠溶液反应:Ca(HCO3)2 +Na2CO 3Ca2+CO32+-CaCO3 ↓硅及其化合物的化学方程式和离子方程式一、硅1、硅和氟气反应:Si+2F22、硅和氯气加热:Si+2Cl23、硅与氧气加热:Si+O2SiF4 SiCl4 SiO2Na2SiO3+2H2 ↑ SiO32+2H2 ↑-4、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Si+2OH+H2O5、硅和氢氟酸反应:Si+4HF二、二氧化硅1、工业上用二氧化硅制备粗硅:SiO2+2C2、工业上二氧化硅制备金刚砂:SiO2+3CSiF4+2H2 ↑-Si+2CO↑ SiC+2CO↑CaSiO3+CO2 ↑ Na2SiO3+CO2 ↑3、碳酸钙高温条件下与二氧化硅反应:CaCO3+SiO24、碳酸钠高温条件下与二氧化硅反应:Na2CO3+SiO25、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO22OH+SiO26、将二氧化硅溶于氢氟酸:SiO2+4HF7、二氧化硅高温与生石灰反应:CaO+SiO2三、硅酸1、硅酸溶于氢氧化钠溶液:H2SiO3+2NaOHH2SiO3+2OH2、加热硅酸:H2SiO3四、硅酸钠1、硅酸钠溶液加入氯化钙溶液:Na2SiO3+CaCl 2SiO32+Ca2-+--Na2SiO3+H2O SiO32+H2O-SiF4+2H2OCaSiO3Na2SiO3+2H2O SiO32+2H2O-SiO2+H2OCaSiO3 ↓+2NaCl CaSiO3 ↓2、硅酸钠溶液呈碱性:Na2SiO3+H2OSiO32+H2O-NaHSiO3+NaOH HSiO3+OH2NaCl+H2SiO3 ↓ H2SiO3 ↓H2S iO3 ↓+Na2CO3 CO32+H2SiO3 ↓--3、向硅酸钠溶液中加入盐酸:Na2SiO3+2HClSiO32+2H-+4、向硅酸钠通入中通入少量的二氧化碳:Na2SiO3+CO2+H2 OSiO32+CO2+H2O-5、向硅酸钠通入中通入过量的二氧化碳:Na2SiO3+2CO2+2H2 OSiO32+2CO2+2H2O-H2SiO3 ↓+2NaHCO3 2HCO3+H2SiO3 ↓-6、硅酸钠溶液与氯化铵溶液混合:Na2SiO3+2NH4SiO32+2NH4-+2NaCl+H2SiO3 ↓+2NH3 ↑ H2SiO3 ↓+2NH3 ↑。

高中化学碳和硅的知识点介绍在高中的化学学习中,学生过会学习到很多的知识点,下面店铺的小编将为大家带来化学中关于碳和硅的知识点的介绍,希望能够帮助到大家。
高中化学碳和硅的知识点(一)碳族元素1、组成和结构特点(1)碳族元素包括碳、硅、锗、锡、铅五种元素,位于元素周期表的IVA族。
(2)碳族元素原子最外层有4个电子,在化学反应中不易得到或失去电子,易形成共价键。
主要化合价有+2和+4价,其中碳和硅有负价。
碳族元素在化合物中多以+4价稳定,而铅在化合物中则以+2价稳定。
碳族元素中碳元素形成的单质(金刚石)硬度最大;碳元素形成的化合物种类最多;在所有非金属形成的气态氢化物中,CH4中氢元素的质量分数最大;12C是元素相对原子质量的标准原子;硅在地壳中的含量仅次于氧,其单质晶体是一种良好的半导体材料。
2、性质的递变规律随着原子序数的增大,碳族元素的原子半径依次增大,由非金属元素逐渐转变为金属元素,即金属性逐渐增强,非金属性逐渐减弱;最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强;气态氢化物的稳定性逐渐减弱,还原性逐渐增强。
(二)碳及其化合物1、碳单质(1)碳的同素异形体(2)碳的化学性质常温下碳的性质稳定,在加热、高温或点燃时常表现出还原性,做还原剂,温度越高,还原性越强,高温时的氧化产物一般为一氧化碳。
溶解性不同:一般情况下,所有的钾盐、钠盐和铵盐是可溶的,所有的酸式盐是可溶的,正盐的溶解度小于酸式盐的溶解度,但碳酸钠的溶解度大于碳酸氢钠的溶解度。
热稳定性不同:一般情况下,难溶的正盐和酸式盐受热易分解,可溶性碳酸盐稳定不易分解。
与酸反应的剧烈程度不同:两者都能与强酸(H+)反应产生CO2,但反应的剧烈程度不同,根据反应的剧烈程度可鉴别两者。
可溶性盐的水解程度不同:相同浓度的正盐溶液的pH值大于酸式盐溶液的pH值。
与碱反应不同:弱酸的酸式盐可与碱反应生成正盐。
与盐反应不同:碳酸钠可与氯化钙或氯化钡反应生成难溶性碳酸盐,但碳酸氢钠不反应。
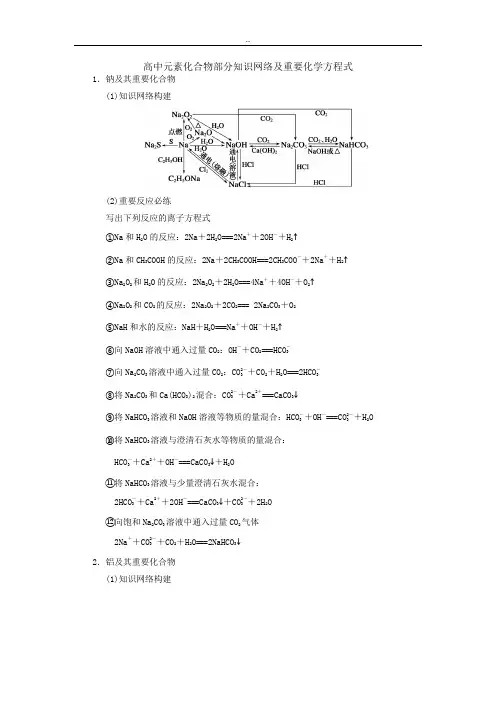
高中元素化合物部分知识网络及重要化学方程式1.钠及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的离子方程式①Na和H2O的反应:2Na+2H2O===2Na++2OH-+H2↑②Na和CH3COOH的反应:2Na+2CH3COOH===2CH3COO-+2Na++H2↑③Na2O2和H2O的反应:2Na2O2+2H2O===4Na++4OH-+O2↑④Na2O2和CO2的反应:2Na2O2+2CO2=== 2Na2CO3+O2⑤NaH和水的反应:NaH+H2O===Na++OH-+H2↑⑥向NaOH溶液中通入过量CO2:OH-+CO2===HCO-3⑦向Na2CO3溶液中通入过量CO2:CO2-3+CO2+H2O===2HCO-3⑧将Na2CO3和Ca(HCO3)2混合:CO2-3+Ca2+===CaCO3↓⑨将NaHCO3溶液和NaOH溶液等物质的量混合:HCO-3+OH-===CO2-3+H2O⑩将NaHCO3溶液与澄清石灰水等物质的量混合:HCO-3+Ca2++OH-===CaCO3↓+H2O⑪将NaHCO3溶液与少量澄清石灰水混合:2HCO-3+Ca2++2OH-===CaCO3↓+CO2-3+2H2O⑫向饱和Na2CO3溶液中通入过量CO2气体2Na++CO2-3+CO2+H2O===2NaHCO3↓2.铝及其重要化合物(1)知识网络构建(2)重要反应必练写出下列反应的离子方程式①Al和NaOH溶液的反应:2Al+2OH-+2H2O===2AlO-2+3H2↑②Al(OH)3和NaOH溶液的反应:Al(OH)3+OH-===AlO-2+2H2O③Al(OH)3和盐酸的反应:Al(OH)3+3H+===Al3++3H2O④Al2O3和NaOH的反应:Al2O3+2OH-===2AlO-2+H2O⑤Al2O3和盐酸的反应:Al2O3+6H+===2Al3++3H2O⑥NaAlO2和少量盐酸的反应:AlO-2+H++H2O === Al(OH)3↓⑦NaAlO2和过量盐酸的反应:AlO-2+4H+===Al3++2H2O⑧向NaAlO2溶液中通入过量CO2气体:AlO-2+CO2+2H2O===Al(OH)3↓+HCO-3⑨将NaAlO2与NaHCO3混合:AlO-2+HCO-3+H2O===Al(OH)3↓+CO2-3⑩将NaAlO2与AlCl3溶液混合:3AlO-2+Al3++6H2O===4Al(OH)3↓⑪向AlCl3溶液中加入过量NaOH溶液:Al3++4OH-===AlO-2+2H2O⑫向AlCl3溶液加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH+4⑬将AlCl3溶液与NaHCO3溶液混合:Al3++3HCO-3===Al(OH)3↓+3CO2↑3.铁及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式。

碳、硅及其重要化合物知识精讲1. 理清知识主线C -4H 4C 0 ―→C +2O ―→C +4O 2Si -4H 4Si 0―→Si +4O 2(H 2Si +4O 3) 2. 注意网络构建3. 必记重要反应(1)碳及其化合物C +CO 2=====△2COC +H 2O(g)=====高温CO +H 2 2C +SiO 2=====高温Si +2CO ↑ 提醒 由于C 过量,SiO 2与C 反应产物是CO 而不是CO 2,该反应用于工业上制备粗硅,必须在隔绝空气的条件下进行。
(2)硅及其化合物 Si +4HF===SiF 4↑+2H 2↑ Si +2NaOH +H 2O===Na 2SiO 3+2H 2↑ SiO 2+4HF===SiF 4↑+2H 2O SiO 2+2NaOH===Na 2SiO 3+H 2OSiO 2-3+2H +===H 2SiO 3↓Na 2SiO 3+CO 2+H 2O===H 2SiO 3↓+Na 2CO 3提醒 氢氟酸不能用玻璃容器盛放,NaOH 溶液能用玻璃试剂瓶,但不能用玻璃塞。
4. 扫除知识盲点(1)Si 的还原性大于C ,但C 却能在高温下从SiO 2中还原出Si :SiO 2+2C=====高温Si +2CO ↑。
(2)酸性氧化物一般能与水反应生成酸,但SiO 2不溶于水;酸性氧化物一般不与酸作用,但SiO 2能与HF 反应。
(3)硅酸盐大多难溶于水,常见可溶性硅酸盐硅酸钠,其水溶液称为泡花碱或水玻璃,但却是盐溶液。
(4)H 2CO 3的酸性大于H 2SiO 3,所以有Na 2SiO 3+CO 2+H 2O===H 2SiO 3↓+Na 2CO 3,但高温下Na 2CO 3+SiO 2=====高温Na 2SiO 3+CO 2↑也能发生,原因可以从两方面解释:①硅酸盐比碳酸盐稳定;②从化学平衡角度,由高沸点难挥发固体SiO 2制得低沸点易挥发的CO 2。

碳、硅、氮、硫、氯及其化合物方程式和离子方程式锦集一、碳及其化合物方程式和离子方程式1、C(1)与氧气反应(不足):2C+O22CO(2)与氧气反应(充足): C+O2CO2(3)与氧化铜反应: 2CuO+C2Cu+CO2↑(4)与二氧化硅反应: SiO2+2C Si+2CO↑(5)与水蒸气反应(高温): C+H2O CO+H2(6)与浓硝酸反应: C+4HNO3CO2↑+4NO2↑+2H2O C+4H++4NO3-CO2↑+4NO2↑+2H2O(7)与浓硫酸反应: C+2H2SO4(浓)CO2↑+2SO2↑+2H2O(8)与二氧化碳反应: C+CO22CO2、CO(1)与氧气反应: 2CO+O22CO2(2)与氧化铜反应:CuO+CO Cu+CO2(3)与氧化铁反应:Fe2O3+3CO2Fe+3CO2(4)与水蒸气反应: CO+H2O CO2+H23、CO2(1)与水反应:CO2+H2O H2CO3(2)与碳单质反应:C+CO22CO(3)与镁单质反应:2Mg+CO22MgO+C(4)与氧化钙反应: CaO+CO2CaCO3(5)与过氧化钠反应: 2Na2O2+2CO22Na2CO3+O2↑(6)与少量氢氧化钠溶液反应: NaOH+CO2NaHCO3OH-+CO2HCO3-(7)与过量量氢氧化钠溶液反应:2NaOH+CO2Na2CO3+H2O 2OH-+CO2CO32-+H2O(8)与少量氢氧化钙溶液反应:Ca(OH)2+2CO2Ca(HCO3)2OH-+CO2HCO3-(9)与过量氢氧化钙溶液反应:Ca(OH)2+CO2CaCO3↓+H2O Ca2++2OH-+CO2CaCO3↓+H2O(10)与次氯酸钙反应: Ca(ClO)2+CO2+H2O CaCO3↓+2HClO Ca2++2ClO-+CO2+H2O CaCO3↓+2HClO(11)与碳酸钙反应:CaCO3+CO2+H2O Ca(HCO3)2CaCO3+CO2+H2O Ca2++2HCO3-(12)与碳酸钠溶液反应:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-(13)与过量偏铝酸钠溶液反应:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-(14)与少量偏铝酸钠溶液反应:NaAlO2+CO2+2H2O Al(OH)3↓+NaHCO3AlO2-+CO2+2H2O Al(OH)3↓+HCO3-(15)与过量硅酸钠溶液反应:Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3 SiO32-+CO2+H2O CO32-+H2SiO3↓(16)与少量硅酸钠溶液反应:Na2SiO3+2CO2+2H2O H2SiO3↓+2NaHCO3SiO32-+2CO2+2H2O2HCO3-+H2SiO3↓(17)与苯酚钠溶液反应:C6H5ONa+CO2+H2O C6H5OH+NaHCO3C6H5O-+CO2+H2O C6H5OH+HCO3-(18)与过量氨水反应: CO2+2NH3·H2O(NH4) 2CO3 CO2+2NH3·H2O2NH4++CO32-(19)与少量氨水反应: CO2+NH3·H2O NH4HCO3 CO2+NH3·H2O NH4++HCO3-4.CaCO3(1)碳酸钙高温下分解: CaCO3+SiO2CaSiO3+CO2(2)溶于盐酸反应:CaCO 3+2HCl CaCl2+CO2↑+H2O CaCO3+2H+Ca2++CO2↑+H2O(3)碳酸钙高温下与二氧化硅反应:CaCO3+SiO2CaSiO3+CO2↑(4)碳酸钙与二氧化碳和水反应:CaCO 3+CO2+H2O Ca(HCO3)2CaCO3+CO2+H2O Ca2++2HCO3-5.Ca(HCO3)2(1)与盐酸反应:Ca(HCO 3)2+2HCl CaCl2+2CO2↑+2H2O HCO3-+H+CO2↑+H2O(2)与少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2O Ca2++HCO3-+OH-CaCO3↓+H2O(3)与过量氢氧化钠溶液:Ca(HCO 3)2+2NaOH CaCO3↓+Na2CO3+2H2O Ca2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O(4)与石灰水:Ca(HCO 3)2+Ca(OH)22CaCO3↓+2H2O Ca2++HCO3-CaCO3↓+H2O(5)加热碳酸氢钙:Ca(HCO3)2CaCO3↓+CO2↑+H2O(6)与碳酸钠溶液反应:Ca(HCO 3)2+Na2CO3CaCO3↓+2NaHCO3Ca2++CO32-CaCO3↓二、硅及其化合物方程式和离子方程式1、Si(1)与氧气反应:Si+O2SiO2(2)与氯气反应:Si+2Cl2SiCl4(3)与氟气反应:Si+2F 2SiF4(4)与氢氟酸反应:Si+4HF SiF4+2H2↑(5)与氢氧化钠溶液反应:Si+2NaOH+H 2O Na2SiO3+2H2↑ Si+2OH-+H2O SiO32-+2H2↑2、SiO2(1)与氧化钙反应:CaO+SiO2CaSiO3(2)与氢氧化钠溶液反应:2NaOH+SiO 2Na2SiO3+H2O 2OH-+SiO2SiO32-+H2O(3)与氢氟酸反应:SiO 2+4HF SiF4+2H2O(4)与碳酸钠反应:Na2CO3+SiO2Na2SiO3+CO2↑(5)与碳酸钙反应:CaCO3+SiO2CaSiO3+CO2(6)与碳单质反应:SiO2+3C SiC+2CO↑3、SiCl4(1)与氢气反应:SiCl4+2H2Si+4HCl(2)与氧气反应:SiCl4+O2Si O2+2Cl24、H2SiO3(1)与氢氧化钠溶液反应:H 2SiO3+2NaOH Na2SiO3+2H2O H2SiO3+2OH-SiO32-+2H2O(2)受热分解:H2SiO3SiO2+H2O5、Na2SiO3(1)与稀硫酸反应:Na 2SiO3+H2SO4Na2SO4+H2SiO3↓ SiO32-+2H+H2SiO3↓(2)与二氧化碳和水反应:Na 2SiO3+CO2+H2O H2SiO3↓+Na2CO3SiO32-+CO2+H2O CO32-+H2SiO3↓三、氮及其化合物方程式和离子方程式1.N2(1)与氢气反应:N2+3H2错误!未找到引用源。
硅、碳及其化合物——归纳总结(一)硅及其化合物①Si与NaOH溶液反应②工业制粗硅③NaOH溶液保存不能使用玻璃塞④氢氟酸不能用玻璃瓶保存⑤由SiO2间接制备H2SiO3⑥工业制玻璃⑦Al2O3与Na2CO3高温加热⑧Na2SiO3溶液中通入过量CO2⑨H2SiO3不稳定性⑩Na2SiO3与Ca(OH)2溶液⑾除杂NaAlO2(Na2SiO3)练习:1、下列关于硅及其化合物的说法正确的是。
①同二氧化碳一样,二氧化硅分子是由一个硅原子和两个氧原子构成的②我国著名的陶瓷含有的主要成分是硅酸盐③建筑所用的水泥、沙子、石英的主要成分都是硅酸盐④通信光缆、计算机芯片的主要成分是硅酸盐⑤制普通玻璃的基本原料是纯碱、石灰石和石英⑥电脑芯片的主要成分是二氧化硅⑦SiO2既能与NaOH溶液反应,又能与氢氟酸反应,故SiO2为两性氧化物⑧二氧化硅的熔点高,硬度大,可用来制造电子部件和光学器件2、将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后得到的固体物质是()A.Na2SiO3 B.Na2CO3、Na2SiO3 C.Na2CO3、SiO2 D.SiO23、现有一种硅、铝、铁合金样品,取等质量的两份该样品分别投入到足量的稀硫酸和足量的NaOH 溶液中,充分反应后,测得生成的气体在相同状况下的体积相等。
下列说法不正确的是( )A .合金样品中硅和铁的物质的量之比为1∶2B .铁与稀硫酸反应产生的H 2跟硅与NaOH 溶液反应产生的H 2的量相等C .合金样品中硅和铁的质量之比为4∶1D .上述过程中涉及的反应均为氧化还原反应(二)碳及其化合物①制水煤气 除杂CO 2 (CO)②Mg 在CO 2中燃烧 ③工业炼铁④泡沫灭火器反应原理 Al 3++3HCO 3- Al(OH)3↓+3CO 2↑⑤向澄清石灰水中通入少量CO 2⑥向澄清石灰水中通入过量CO 2⑦向NaClO 溶液中通入过量CO 2⑧向饱和Na 2CO 3溶液中通入CO 2(化学方程式)⑨NaHCO 3固体受热分解⑩向NaHCO 3溶液中加入少量Ca(OH)2⑾向Ca(OH)2溶液中加入少量NaHCO 3⑿漂白粉的漂白原理⒀向含有NaAlO 2、NaOH 、Ba(OH)2混合溶液中通入CO 2至过量(化学方程式)。
本章知识系统及重要化学方程式的再书写1.碳、硅及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的化学方程式,是离子反应的写离子方程式。
①Si 和NaOH 溶液的反应Si +2OH -+H 2O===SiO 2-3+2H 2↑; ②SiO 2和NaOH 溶液的反应SiO 2+2OH -===SiO 2-3+H 2O ; ③SiO 2和C 的反应SiO 2+2C=====高温Si +2CO ↑;④SiO 2和氢氟酸的反应SiO 2+4HF===SiF 4↑+2H 2O ;⑤向Na 2SiO 3溶液中通入过量CO 2气体SiO 2-3+2CO 2+2H 2O===H 2SiO 3↓+2HCO -3; ⑥Mg 在CO 2中燃烧2Mg +CO 2=====点燃2MgO +C ;⑦向澄清石灰水中通入少量CO 2气体Ca 2++2OH -+CO 2===CaCO 3↓+H 2O ; ⑧向澄清石灰水中通入过量CO 2气体OH -+CO 2===HCO -3;⑨除去CO 2中的COCO +CuO=====△CO 2+Cu ;⑩生产普通玻璃的原理Na 2CO 3+SiO 2=====高温Na 2SiO 3+CO 2↑、CaCO 3+SiO 2=====高温CaSiO 3+CO 2↑。
2.氯气及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的化学方程式,是离子反应的写离子方程式。
①Cl 2和H 2O 的反应Cl 2+H 2O H ++Cl -+HClO ;②Cl 2和NaOH 溶液的反应Cl 2+2OH -===Cl -+ClO -+H 2O ;③Cl 2和石灰乳的反应Cl 2+Ca(OH)2===Ca 2++Cl -+ClO -+H 2O ; ④把Cl 2通入到Na 2SO 3溶液中Cl 2+SO 2-3+H 2O===SO 2-4+2H ++2Cl -; ⑤将Cl 2和SO 2混合通入H 2O 中SO 2+Cl 2+2H 2O===4H ++2Cl -+SO 2-4; ⑥将Cl 2通入到氢硫酸溶液中Cl 2+H 2S===S ↓+2H ++2Cl -;⑦将浓盐酸和MnO 2混合加热MnO 2+4H ++2Cl -=====△Mn 2++Cl 2↑+2H 2O ; ⑧电解饱和食盐水2Cl -+2H 2O=====电解Cl 2↑+H 2↑+2OH -;⑨将浓盐酸与漂白液混合Cl -+ClO -+2H +===Cl 2↑+H 2O ;⑩将浓盐酸与KClO 3溶液混合6H ++5Cl -+ClO -3===3Cl 2↑+3H 2O ;⑪向KMnO 4固体滴加浓盐酸2MnO -4+16H ++10Cl -===2Mn 2++5Cl 2↑+8H 2O ; ⑫向漂白粉溶液中通入少量CO 2气体Ca 2++2ClO -+CO 2+H 2O===CaCO 3↓+2HClO 。
第四章 非金属及其化合物第一讲 碳、硅及无机非金属材料考点1 碳、硅单质及其重要化合物的性质一、碳、硅的单质1.存在:自然界中碳元素既有游离态,又有化合态,而硅元素因有亲氧性,所以仅有化合态。
碳单质主要有金刚石、石墨、C 60等同素异形体,硅单质主要有晶体硅和无定形硅两大类。
2.碳、硅单质的结构、物理性质与用途的比较碳、硅在参与化学反应时,一般表现还原性。
碳⎩⎪⎪⎨⎪⎪⎧与O 2反应⎩⎪⎨⎪⎧O 2(足量):C +O 2=====点燃CO 2O 2(不足):2C +O 2=====点燃2CO 与氧化物反应⎩⎪⎨⎪⎧CuO :2CuO +C=====△2Cu +CO 2↑(冶炼金属)SiO 2:SiO 2+2C=====高温Si +2CO ↑(制取粗硅)H 2O :C +H 2O (g )=====高温CO +H 2(制取水煤气)与强氧化性酸反应⎩⎪⎨⎪⎧浓H 2SO 4:C +2H 2SO 4(浓)=====△CO 2↑+2SO 2↑+2H 2O 浓HNO 3:C +4HNO 3(浓)=====△CO 2↑+4NO 2↑+2H 2O 二、碳、硅的氧化物 1.CO 的性质(1)物理性质:无色无味的气体,难溶于水。
能使人中毒的原因是其与人体中血红蛋白相结合,因缺氧而中毒。
(2)化学性质①可燃性:2CO +O 2=====点燃2CO 2。
②还原性:CO 还原Fe 2O 3的反应为Fe 2O 3+3CO=====高温2Fe +3CO 2。
2.二氧化碳与二氧化硅的比较 (1)物理性质①熔、沸点:CO 2的熔、沸点比SiO 2的熔、沸点低。
②溶解性:CO 2可溶于水,SiO 2不溶于水。
(2)化学性质CO 2+H 2OH 2CO 3CO 2:化工原料、灭火剂。
干冰用作制冷剂,人工降雨。
SiO 2:制光学仪器、石英玻璃。
水晶可制作饰品,常用来制造通讯材料光导纤维。
考点2 硅酸盐及无机非金属材料一、硅酸和硅酸钠 1.硅酸(H 2SiO 3)硅酸不溶于水,其酸性比碳酸弱,不能使紫色石蕊试液变红色。
知识清单12 碳、硅及无机非金属材料知识点01 碳及其化合物1.碳单质(1)存在形式:有金刚石、石墨、无定形碳、足球烯,它们互为同素异形体。
金刚石 石墨 足球烯①金刚石:正四面体空间网状结构。
物理性质:熔点高,硬度大,不导电。
②石墨:层状结构,每层为正六边形的平面网状结构。
物理性质:熔点高,硬度小,能导电,具有润滑性。
③足球烯(C 60):笼状分子,由正五边形和正六边形排列而成。
不导电。
(2)主要化学性质——还原性2.CO、CO2的性质对比CO2+H2O H2CO3CO2C,△①O2,②CuOCO3CO2-3①CO2+H2O,②H+OH-HCO-3(1)金刚石和石墨由相同的元素组成,因此它们具有相同的性质(×)错因:它们的化学性质相似,但物理性质不同。
(2)石墨转变为金刚石的反应属于氧化还原反应(×)错因:同素异形体之间的转化,化合价不变,不是氧化还原反应。
(3)向空气中排放二氧化碳会形成酸雨(×)错因:pH<5.6的雨水才是酸雨,CO 2不能形成酸雨。
(4)向CaCl 2溶液中通入CO 2气体,溶液变浑浊,继续通入CO 2至过量,浑浊消失(×) 错因:由于盐酸的酸性比碳酸强,CO 2与CaCl 2溶液不反应。
(5)氨化的饱和食盐水中通入足量的CO 2气体,会析出晶体(√)提示:氨化的饱和食盐水中通入足量的CO 2气体生成NaHCO 3的溶解度较小,在溶液中析出。
(6) 激光法蒸发石墨得到C 60 发生的物理变化(×) 错因:石墨转化为C 60,有新物质生成。
一、碳及其重要化合物的转化 碳的重要化合物转化关系如下:用化学方程式表示标有序号的各步变化。
①___________________________________; ②___________________________________; ③___________________________________; ④___________________________________; ⑤____________________________________; ⑥____________________________________。
无机非金属材料的主角——硅【知识要点】一、硅1.物理性质晶体硅是一种色具有光泽,硬而脆的固体,熔沸点较高,能导电,是良好的材料。
在自然界中只能以化合态存在。
主要以二氧化硅和硅酸盐的形式存在。
其元素含量在地壳中居第位。
2.化学性质化学性质〔和碳相似〕——形成共价化合物,化学性质不活泼。
①常温下,不能强酸、强氧化性酸反应,只能与氟气、氢氟酸〔HF〕和烧碱等物质反应:方程式、、②加热条件下,能跟一些非金属单质〔氧气、氢气〕起反应。
〔3〕工业制法:〔焦炭在电炉中复原二氧化硅得到粗硅〕粗硅提纯后,可以得到可用作半导体材料的高纯硅。
〔3〕用途:①作半导体材料晶体管、集成电路、硅整流器和太阳能电池等;②制合金:含硅4%的钢具有良好的导磁性——变压器铁芯;含硅15%左右的钢具有良好的耐酸性——耐酸设备等。
二、二氧化硅1.物理性质硬度大,熔沸点高,不导电,不溶于水。
等的主要成分都是二氧化硅,它一般可用于制造光导纤维。
2.化学性质CO2SiO2与碱性氧化物反应与碱液反应与盐反应2Na2CO3+SiO2 CaCO3+SiO2与碳反应与H2O作用与酸反应〔一〕硅酸1. 物理性质2. 制备方法3. 化学性质4. 用途〔二〕硅酸盐〔1〕性质特征:性质稳定,熔点较高,大都溶于水。
〔2〕主要原料:黏土〔Al2O3·2SiO2·2H2O〕、石英〔SiO2〕和长石〔钾长石K2O·Al2O3·6SiO2或钠长石Na2O·Al2O3·6SiO2〕。
〔3〕主要制品:玻璃、水泥、陶瓷、砖瓦、水玻璃〔Na2SiO3的水溶液〕等。
水泥玻璃〔普通〕原料石灰石、粘土纯碱、石灰石、石英设备水泥回转窑玻璃熔炉反应复杂的物理化学变化Na2CO3+SiO2 Na2SiO3+CO2↑CaCO3+SiO2 CaSiO3+CO2↑主要成分3CaO·SiO22CaO·SiO23CaO·Al2O3Na2O·CaO·6SiO2特性水硬性〔加石膏调节硬化速度〕玻璃态物质〔在一定温度范围内软化〕非晶体要点精讲一、二氧化硅和硅酸【典型例题】例1.以下物质中,不能通过化合反应制取的是〔〕A.H2SiO3B.Fe(OH)3C.Fe(NO3)2D.CaSiO3例2.以下各组物质中不起反应的是〔〕A.SiO2与纯碱共熔B.CO2通入Na2SiO3溶液C.SiO2与大理石共熔D.SiO2和浓H2SO4共热例3.碳化硅〔SiC〕的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。
本章知识系统及重要化学方程式的再书写
1.碳、硅及其化合物
(1)知识网络构建
(2)重要反应必练
写出下列反应的化学方程式,是离子反应的写离子方程式。
①Si 和NaOH 溶液的反应
Si +2OH -+H 2O===SiO 2-
3+2H 2↑; ②SiO 2和NaOH 溶液的反应
SiO 2+2OH -===SiO 2-
3+H 2O ; ③SiO 2和C 的反应
SiO 2+2C=====高温
Si +2CO ↑;
④SiO 2和氢氟酸的反应
SiO 2+4HF===SiF 4↑+2H 2O ;
⑤向Na 2SiO 3溶液中通入过量CO 2气体
SiO 2-3+2CO 2+2H 2O===H 2SiO 3↓+2HCO -3; ⑥Mg 在CO 2中燃烧
2Mg +CO 2=====点燃
2MgO +C ;
⑦向澄清石灰水中通入少量CO 2气体
Ca 2++2OH -+CO 2===CaCO 3↓+H 2O ; ⑧向澄清石灰水中通入过量CO 2气体
OH -+CO 2===HCO -
3;
⑨除去CO 2中的CO
CO +CuO=====△CO 2+Cu ;
⑩生产普通玻璃的原理
Na 2CO 3+SiO 2=====高温Na 2SiO 3+CO 2↑、
CaCO 3+SiO 2=====高温
CaSiO 3+CO 2↑。
2.氯气及其化合物
(1)知识网络构建
(2)重要反应必练
写出下列反应的化学方程式,是离子反应的写离子方程式。
①Cl 2和H 2O 的反应
Cl 2+H 2O H ++Cl -
+HClO ;
②Cl 2和NaOH 溶液的反应
Cl 2+2OH -===Cl -+ClO -+H 2O ;
③Cl 2和石灰乳的反应
Cl 2+Ca(OH)2===Ca 2++Cl -+ClO -+H 2O ; ④把Cl 2通入到Na 2SO 3溶液中
Cl 2+SO 2-3+H 2O===SO 2-4+2H ++2Cl -
; ⑤将Cl 2和SO 2混合通入H 2O 中
SO 2+Cl 2+2H 2O===4H ++2Cl -+SO 2-
4; ⑥将Cl 2通入到氢硫酸溶液中
Cl 2+H 2S===S ↓+2H ++2Cl -;
⑦将浓盐酸和MnO 2混合加热
MnO 2+4H ++2Cl -=====△
Mn 2++Cl 2↑+2H 2O ; ⑧电解饱和食盐水
2Cl -+2H 2O=====电解Cl 2↑+H 2↑+2OH -
;
⑨将浓盐酸与漂白液混合
Cl -+ClO -+2H +===Cl 2↑+H 2O ;
⑩将浓盐酸与KClO 3溶液混合
6H ++5Cl -+ClO -3===3Cl 2↑+3H 2O ;
⑪向KMnO 4固体滴加浓盐酸
2MnO -4+16H ++10Cl -===2Mn 2+
+5Cl 2↑+8H 2O ; ⑫向漂白粉溶液中通入少量CO 2气体
Ca 2++2ClO -
+CO 2+H 2O===CaCO 3↓+2HClO 。
3.硫及其化合物
(1)知识网络构建
(2)重要反应必练
写出下列反应的方程式,是离子反应的写离子方程式。
①S 溶于热的烧碱溶液生成两种钠盐
3S +6OH -=====△
2S 2-+SO 2-3+3H 2O ; ②把H 2S 气体通入CuSO 4溶液中
H 2S +Cu 2+===CuS ↓+2H +
; ③Na 2S 溶液在空气中放置变浑浊
2S 2-+O 2+2H 2O===2S ↓+4OH -
; ④铜丝在硫蒸气中燃烧
2Cu +S=====点燃
Cu 2S ;
⑤将SO 2气体通入到氢硫酸中
SO 2+2H 2S===3S ↓+2H 2O ;
⑥把H 2S 气体通入到FeCl 3溶液中
H 2S +2Fe 3+===S ↓+2Fe 2++2H +; ⑦SO 2通入足量的澄清石灰水中
SO 2+Ca 2++2OH -
===CaSO 3↓+H 2O ; ⑧SO 2通入溴水中,使溴水褪色
SO 2+Br 2+2H 2O===SO 2-4+2Br -+4H +
; ⑨用足量氨水吸收SO 2尾气
2NH 3·H 2O +SO 2===2NH +4+SO 2-
3+H 2O ; ○
10Cu 和浓硫酸的反应 Cu +2H 2SO 4(浓)=====△
CuSO 4+SO 2↑+2H 2O ;
⑪C 和浓硫酸的反应
C +2H 2SO 4(浓)=====△
CO 2↑+2SO 2↑+2H 2O ; ⑫把浓H 2SO 4滴到Na 2SO 3固体上
H 2SO 4(浓)+Na 2SO 3===Na 2SO 4+H 2O +SO 2↑。
4.氮及其化合物
(1)知识网络构建
(2)重要反应必练
写出下列反应的方程式,是离子反应的写离子方程式。
①N 2和H 2的反应
N 2+3H 2 高温、高压催化剂
2NH 3; ②把NH 3通入水中
NH 3+H 2O NH 3·H 2O NH +4+OH -;
③实验室利用NH 4Cl 固体、Ca(OH)2固体混合加热制备NH 3 2NH 4Cl +Ca(OH)2=====△2NH 3↑+2H 2O +CaCl 2; ④NH 3的催化氧化
4NH 3+5O 2=====催化剂
△
4NO +6H 2O ; ⑤NH 4HCO 3溶液中加入过量稀NaOH 溶液
NH +4+HCO -3+2OH -===NH 3·H 2O +CO 2-3+H 2O ; ⑥NO 2溶于水
3NO 2+H 2O===2H ++2NO -
3+NO ;
⑦NO 2被烧碱溶液吸收生成两种钠盐
2NO 2+2OH -===NO -3+NO -2+H 2O ;
⑧物质的量之比为1∶1的NO 和NO 2混合气体恰好被烧碱溶液吸收生成一种钠盐 NO +NO 2+2OH -===2NO -2+H 2O ;
⑨Cu 和稀HNO 3的反应
3Cu +8H ++2NO -3===3Cu 2++2NO ↑+4H 2O ; ⑩Cu 和浓HNO 3的反应
Cu +4H ++2NO -3===Cu 2+
+2NO 2↑+2H 2O ;
⑪Fe 和过量稀HNO 3的反应 Fe +4H ++NO -3===Fe 3++NO ↑+2H 2O ; ⑫C 和浓HNO 3的反应 C +4H ++4NO -3=====△CO 2↑+4NO 2↑+2H 2O ; ⑬浓硝酸见光分解(化学方程式) 4HNO 3(浓)=====光照4NO 2↑+O 2↑+2H 2O 。