均相反应动力学
- 格式:pdf
- 大小:2.61 MB
- 文档页数:25

§2 均相反应的动力学基础§2.1 基本概念和术语若参于反应的各物质均处同一个相内进行化学反应则称为均相反应。
均相反应动力学:研究各种因素如温度、催化剂、反应物组成和压力等对反应速率、反应产物分布的影响,并确定表达这些影响因素与反应速率之间定量关系的速率方程。
§2.1.1 化学计量方程化学计量方程:表示各反应物、生成物在反应过程中量的变化关系的方程。
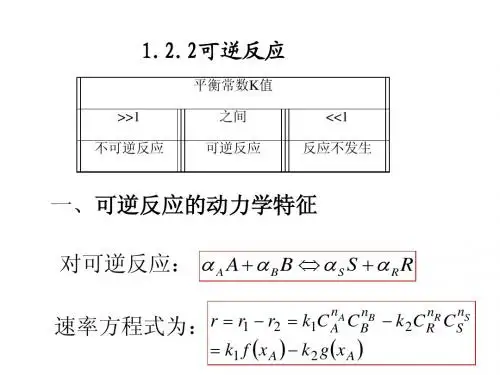
一个由S 个组分参予的反应体系,其计量方程可写成:∑==Si ii A10α式中:Ai 表示i 组分,i α为i 组分的计量系数。
通常反应物的计量系数为负数,反应产物的计量系数为正值。
注意:1.计量方程本身与反应的实际历程无关,仅表示由于反应引起的各个参予反应的物质之间量的变化关系。
2.规定在计量方程的计量系数之间不应含有除1以外的任何公因子。
这是为了消除计量系数在数值上的不确定性。
单一反应:只用一个计量方程即可唯一给出各反应组分之间量的变化关系的反应体系。
复杂反应:必须用两个或多个计量方程方能确定各反应组分之间量的变化关系的反应体系例如,合成氨反应的计量方程通常写成:32223NH H N ⇔+ 写成一般化的形式为:023322=+--NH H N 而错误的形式有:0462322=+--NH H N§2.1.2 反应程度和转化率反应程度是各组分在反应前后的摩尔数变化与其计量系数的比值,用符号ξ来表示,即:kk k ii i n n n n n n αααξ01101-=-==-=或写成:i i i i n n ξα=-01.不论哪一个组分,其反应程度均是一致的,且恒为正值。
2.如果在一个反应体系中同时进行数个反应,各个反应各自有自己的反应程度,则任一反应组分i 的反应量应等于各个反应所作贡献的代数和,即:∑==-Mj j ij i i n n 10ξα其中:M 为化学反应数,ij α为第j 个反应中组分I 的化学计量系数。

均相反应及其动力学研究内容
哎呀,我是个小学生,这“均相反应及其动力学研究内容”也太难懂啦!不过没关系,我就凭着我的小脑袋瓜来试着说一说。
啥是均相反应呢?就好像我们做游戏的时候,大家都在一个大操场上,没有任何的分界线,所有人都能自由地跑来跑去。
均相反应就是这样,参与反应的各种物质都均匀地混合在一起,不分你我。
那动力学又是什么呢?这就好比我们跑步比赛,要研究每个人跑的速度有多快,什么时候加速,什么时候减速。
均相反应的动力学就是研究这些反应进行的快慢呀,怎么变化的呀。
比如说,我们把盐放到水里,盐很快就溶解了,这就是一个均相反应。
那为什么盐溶解得那么快呢?这就得靠动力学来研究啦!是因为水的温度高?还是盐和水接触得充分?这就好像我们在找为什么有的同学跑步总是第一名,是因为他腿长,还是他练习得多?
再比如,酒精和水混合在一起,这也是均相反应。
那它们混合的速度又和什么有关系呢?是酒精和水的比例?还是搅拌的力度?这就像我们玩接力赛,交接棒顺不顺利,和两个人的配合、速度是不是协调都有关系呀!
老师给我们讲这些的时候,我就一直在想,这和我们的生活有什么关系呢?后来我发现,其实很多地方都能用到均相反应和动力学的知识。
比如制药厂生产药品,要知道药物在身体里怎么反应,反应的速度怎么样,才能保证药能治好我们的病,又不会对我们有坏处。
还有化工厂生产各种材料,也要搞清楚反应的情况,才能生产出又好又多的东西。
这不就跟我们考试一样嘛,只有知道自己哪里学得好,哪里学得不好,才能考出好成绩呀!
反正我觉得,均相反应及其动力学研究虽然有点难,但是很有用。
我们要是能多了解一些,就能做出更多更好的东西,让我们的生活变得更方便、更美好!。

齐齐哈尔大学化学反应工程教案第二章均相反应的动力学基础2.1 基本概念与术语均相反应:是指在均一的液相或气相中进行的反应。
均相反应动力学是研究各种因素如温度、催化剂、反应物组成和压力等对反应速率反应产物分布的影响,并确定表达这些因素与反应速率间定量关系的速率方程。
2.1- 1化学计量方程它是表示各反应物、生成物在反应过程的变化关系的方程。
如N2+3H2===2NH3一般形式为:2NH3- N2-3H2== 0有S个组分参与反应,计量方程::人g2A2亠亠:s A s =0SZ ctjAi =0或i生式中:A i表示i组分a i为i组分的计量系数反应物a i为负数,产物为正值。
注意:1.化学计量方程仅是表示由于反应而引起的各个参与反应的物质之间量的变化关系,计量方程本身与反应的实际历程无关。
2. 乘以一非零的系数入i后,可得一个计量系数不同的新的计量方程S ■- .p r- i A i =0i 13. 只用一个计量方程即可唯一的给出各反应组分之间的变化关系的反应体系——单一反应;必须用两个(或多个)计量方程方能确定各反应组分在反应时量的变化关系的反应,成为复合反应。
CO+2H2=CH3OH CO+ 3H2=CH4+ H2O2.1- 2化学反应速率的定义化学反应速率是以单位时间,单位反应容积内着眼(或称关键)组分K的物质量摩尔数变化来定义K组分的反应速率。
:A A :B B=、s S :R R_ dnA (由于反应而消耗的A的摩尔数)Vdt (单位体积)(单位时间)1 dn A 1 dn B 1 dn s 1 dn Rr B r s r R二V dt V dt V dt V dt齐齐哈尔大学化学反应工程教案4.n 0 yK 0KnK0 - n KnK0 K当V 恒定时,组分K 反应掉的摩尔数 n K0 - n K反应程度是用个组分在反应前后的摩尔数变化与计量系数的比值来定义的,用Z 表示。
n i - ng n K 卞。






均相反应是一种重要的化学反应类型,它在有机合成领域有着广泛的应用。
在这篇文章中,我们将简要介绍均相反应及其动力学的研究内容。
一、均相反应的定义均相反应是指反应物和生成物都在同一相中进行反应的化学反应。
这一类反应通常发生在气态或液态环境中,反应速率往往取决于反应物的浓度。
均相反应的研究对于理解化学反应动力学有着重要意义。
二、均相反应的特点1. 反应物和生成物在同一相中2. 反应速率与反应物浓度相关3. 反应条件易控制三、均相反应的动力学研究均相反应的动力学研究主要包括反应速率的测定、反应机理的探究以及反应条件对反应速率的影响。
1. 反应速率的测定通过实验测定不同反应条件下的反应速率,可以得到反应速率与反应物浓度的关系,从而确定反应的速率方程。
2. 反应机理的探究通过研究反应过程中的中间体和活化能,可以揭示反应的机理和物质转化的路径,为反应条件的优化提供理论依据。
3. 反应条件对反应速率的影响温度、压力、溶剂等反应条件对均相反应的速率有着重要影响,研究这些影响因素可以为反应条件的选择提供指导。
四、均相反应的应用均相反应在有机合成、催化反应等领域有着广泛的应用。
通过精确控制反应条件和催化剂的选择,可以实现高效、高选择性的有机合成反应。
结语均相反应及其动力学的研究对于揭示化学反应的规律,发展新的合成方法具有重要的意义。
希望通过今后更多的研究,能够深入理解均相反应的机理,为化学合成领域的发展做出更大的贡献。
五、均相反应与催化剂催化剂在均相反应中扮演着至关重要的角色。
催化剂能够降低反应活化能,促进化学反应的进行,提高反应速率,同时不参与反应本身,因此在化学反应中有着广泛的应用。
均相反应中,选择合适的催化剂对于反应的效率和选择性同样至关重要。
1. 催化剂的种类在均相反应中,常用的催化剂包括金属催化剂、有机催化剂和生物催化剂等。
金属催化剂如钯、铂和铑等常用于有机合成反应中,而有机催化剂如膦化合物和有机碱则在碳-碳键形成反应中发挥着重要作用。
