高二化学下学期甲烷
- 格式:pdf
- 大小:661.06 KB
- 文档页数:10

人教版2020年必修二化学配套练习之最简单的有机化合物——甲烷(解析版) 1.(2019·云南省麻栗坡民族中学高二期末)2008年10月24日发射的绕月探测工程“嫦娥一号”卫星获得了大量科学探测数据,科学家对数据进行了分析,发现月球形成时可能存在稀薄的原始大气层,主要由氖、氢、氦、氩等气体组成,不含甲烷等碳氢化合物。
下列关于碳氢化合物的叙述正确的是()A.碳氢化合物的通式为C n H2n+2B.燃烧产生为二氧化碳和水的化合物一定是碳氢化合物C.碳原子间以单键相连的烃是烷烃D.碳氢化合物分子的相对分子质量一定是偶数【答案】D【解析】【详解】A、只有烷烃的分子组成通式符合C n H2n+2,烯烃分子组成通式为C n H2n,炔烃分子组成通式为C n H2n-2,故A错误;B、燃烧产物为CO2和H2O的化合物不仅有碳氢化合物,还有烃的含氧衍生物,例如:糖类、酯等物质,故B错误;C、碳原子间以单键相连的烃不一定是烷烃,可能是环烷烃等,如立方烷、环丁烷等,故C错误;D、碳原子的相对原子质量(12)为偶数,烃分子中的氢原子数也一定为偶数,所以碳氢化合物分子的相对分子质量一定是偶数,故D正确;故选D。
【点睛】本题的易错点为C,要注意立方烷、环烷烃等不属于烷烃,难点是D的判断,可以借助于烷烃、烯烃、炔烃和苯及其同系物的通式分析归纳。
2.(2019·湖南省长沙县第九中学高一期末)已知正四面体型分子E和单质分子G反应,生成四面体型分子L和分子M(组成E分子的元素的原子序数均小于10,组成G分子的元素为第三周期的元素),反应过程如下图所示,则下列叙述中判断不正确...的是( )A.常温常压下,E、L均为气态有机物B.E是一种含有10个电子的分子C.上述反应的类型是取代反应D.物质M的形成过程可用电子式表示为:【解析】【详解】A. 常温常压下,甲烷、一氯甲烷是气体,故A正确;B. E是甲烷分子,甲烷是一种含有10个电子的分子,故B正确;C. 甲烷中的氢原子被氯原子取代生成一氯甲烷,属于取代反应,故C正确;D. HCl属于共价化合物,不含有阴阳离子,故D错误;故选:D。



高中化学优秀教案甲烷
一、教学目标:
1. 知识与技能:掌握甲烷的性质、制备方法和应用;了解甲烷的结构式及分子式;
2. 过程与方法:培养学生实验探究的能力;
3. 情感态度和价值观:培养学生对科学实验的兴趣和对实验中安全操作的重视。
二、教学重点:
1. 甲烷的性质和制备方法;
2. 实验室中安全操作。
三、教学难点:
1. 甲烷的制备方法的操作技巧;
2. 实验室中的实验安全。
四、教学内容:
1. 甲烷的性质:无色无臭、易燃、燃烧产生水和二氧化碳;
2. 甲烷的制备方法:碱金属与卤代烃反应、还原性杂环化合物与碱金属反应;
3. 实验室制备甲烷的方法。
五、教学过程:
1. 导入:通过提问导入,引出甲烷的性质和制备方法。
2. 学习:展示甲烷的结构式、分子式,并讲解甲烷的性质和制备方法。
3. 实验操作:实验室进行制备甲烷并观察其性质。
4. 总结:让学生总结甲烷的性质和制备方法,并将实验结果进行分析。
六、教学资料:
1. 实验室设备:烧瓶、燃烧瓶、管道、管夹等;
2. 实验试剂:碱金属、卤代烃等。
七、实验安全注意事项:
1. 实验中保持安静并注意操作规范;
2. 燃烧时保持距离,注意安全;
3. 确保实验室通风良好。
八、教学反思:
本节课以甲烷为例,通过实验的方式让学生更好地了解甲烷的性质和制备方法,并培养了学生的实验探究能力。
在实验过程中,要注意实验安全,保障学生的安全是首要任务。
通过本节课的教学,学生能更加深入地掌握甲烷这一化学知识点,提高学生的学习兴趣和实验操作技能。

.. .. 高二化学第一节甲烷【教学目标】1、理解有机物的概念和有机物的特点2、掌握烃的概念、甲烷的组成和分子结构3、掌握甲烷的物理性质和化学性质4、掌握取代反应的概念【知识讲解】一、有机物1、有机物的概念:含碳元素的化合物称有机化合物,简称有机物。
而一氧化碳、二氧化碳、碳酸、碳酸盐等少数含碳物质,虽然含有碳元素,但它们的组成和性质跟无机物相近,一般把它们作为无机物。
2、有机物的特点:(1)组成元素的特点:除碳元素外,通常还含有H、O、N、P、S,及卤素等非金属元素。
(2)结构特点:①碳原子间能以共价键形成碳链,这是有机物结构的基础。
②有机物分子间通过范德力结合成分子晶体。
(3)数量特点:有机物种类繁多,达上千万种。
原因是:①碳原子有4个价电子,能与其它原子形成4个共价键。
②碳链的长度可以不同,同时碳原子间的结合方式不同,可以以单键、双键、参键结合,也可以有长链或环状结合。
③普遍存在同分异构现象。
(4)性质特点:①溶解性:大多数有机物难溶于水,易溶于有机溶剂(如汽油、酒精、苯等)。
②可燃性:绝大多数有机物易燃烧。
③耐热性:多数有机物熔点沸点较低,受热易分解。
④导电性:多为非电解质,不易导电。
⑤化学反应:化学反应繁杂,一般反应速率较慢,多数需要催化剂,常伴有副反应发生。
二、甲烷的分子结构和物理性质:1、甲烷的物理性质:通常情况下,无色无气味的气体,密度比空气小,难溶于水。
甲烷存在于沼气、坑气、天然气。
2、甲烷的分子结构: H H分子式:CH4,电子式:H:C:H 结构式H-C-HH H正四面体结构键角109028'3、确定有机物分子式和结构式的基本方法(1)各元素的质量 (2)各元素的质量比 ⇒最简式 通式计算(3)各元素的质量分数 讨论(4)燃烧产物的物质的量或质量分子式 性质 结构式(1)M=22.4d(2)M=DMr(D 为相对密度, M ⇒ 相对分子 根据化学方程式r 为气体相对分子质量) 质量 计算、讨论(3)M=M 1a%+ M 2a 2%+……例1:在标准状况下,5.6L 某气态烃的质量为4g ,又知该烃中碳与氢的质量比为3:1。

高二化学烷烃试题答案及解析1.常温常压下,下列化合物以气态形式存在的是A.乙烷B.乙醇C.乙酸D.苯酚【答案】A【解析】A.乙烷在常温下是气体,正确;B.乙醇在常温下是液体,错误; C.乙酸在常温下是液体,错误;D.苯酚在常温下是固体,错误。
【考点】考查物质的存在状态的知识。
2.在光照条件下,将等物质的量的甲烷和氯气充分反应,所得产物中物质的量最多的是A.CH3Cl B.CH2Cl2C.CHCl3D.HCl【答案】D【解析】在光照条件下,将等物质的量的甲烷和氯气充分反应,会发生取代反应,由于取代反应是逐步进行的,每一步在产生氯代烃的同时,都会产生HCl,所以在所得产物中物质的量最多的是HCl。
【考点】考查甲烷的取代反应的特点的知识。
3. 1mol乙烯与氯气完全加成后再与氯气取代,整个过程最多需氯气为A.1mol B.4mol C.5mol D.6mol【答案】C【解析】C2H4+Cl2→CH2ClCH2Cl,所以1mol乙烯与氯气发生加成反应需要氯气1mol;CH2ClCH2Cl+4Cl2CCl3CCl3+4HCl,所以1molCH2ClCH2Cl与氯气发生取代反应,最多需要4mol氯气,这两部分之和为1mol+4mol=5mol,答案选C。
【考点】考查加成反应与取代反应的有关计算4.天然气的主要成分CH4是一种会产生温室效应的气体,等物质的量的CH4和CO2产生的温室效应前者大。
下列叙述:①天然气与煤、石油相比是较洁净的能源;②等质量的CH4和CO2产生的温室效应也是前者大;③燃烧天然气也是酸雨的成因之一;④甲烷可用于制造合成氨的原料气;⑤用甲烷可生成CCl4;⑥甲烷易完全燃烧,故燃烧甲烷时不必保持空气流畅。
其中正确的是()。
A.①②③B.③④⑤C.①②④⑤D.①②③④⑤【答案】C【解析】天然气燃烧主要产生CO2和H2O,对环境污染小,与煤、柴油相比是比较清洁的能源;等质量的CH4和CO2相比,前者的物质的量大,由题给信息知产生的温室效应前者大;燃烧天然气对形成酸雨没有影响;甲烷和氯气在光照条件下可以发生取代反应;甲烷在氧气中燃烧,混入空气可能会发生爆炸。

1.甲烷的定义及其化学性质是什么?实验室是怎样制取甲烷的?(1)甲烷分子是正四面体空间构型,分子式为CH4。
是最简单的有机化合物。
甲烷是没有颜色、没有气味的气体,沸点-161.4℃,比空气轻,它是极难溶于水的可燃性气体。
甲烷和空气成适当比例的混合物,遇火花会发生爆炸。
甲烷在自然界分布很广,是天然气、沼气、坑气及煤气的主要成分之一。
它可用作燃料及制造氢、一氧化碳、炭黑、乙炔、氢氰酸及甲醛等物质的原料。
化学性质相当稳定,跟强酸、强碱或强氧化剂(如KMnO4)等一般不起反应。
在适当条件下会发生氧化、取代及加热分解等反应。
(2)甲烷的实验室制法[原理]无水醋酸钠和NaOH混合共热时发生脱羧反应,即-COOH被H原子取代生成甲烷。
甲烷难溶于水且密度比空气小,可用排水法收集,也可用瓶口向下的排空气集气法收集。
[用品]无水醋酸钠、碱石灰、试管、酒精灯、水槽、铁架台。
[操作]a.把无水醋酸钠放在瓷蒸发皿里用酒精灯加热,同时用玻璃棒不断搅拌,除去其中的水分后,研细,装入干燥的试剂瓶中密封待用。
b.把碱石灰研细,也在蒸发皿中加热除去水分,放入试剂瓶中密封待用。
c.把无水醋酸钠与碱石灰按3∶2的质量比混合均匀,迅速放入试管中,装上带导管的胶塞,固定在铁架台上。
d.用酒精灯加热并用排水法收集。
若用排空气集气法收集时,只能根据产气速率和集气瓶容积的大小,凭经验估计是否集满。
[备注]a.醋酸钠的脱羧反应须在无水条件下才能顺利进行,故在临使用前对无水醋酸钠和碱石灰均应经过煅烧、烘干处理。
b.制取甲烷时,碱石灰中的生石灰并不参加反应,生石灰除起吸湿作用外,还可减少固体NaOH在高温时对玻璃的腐蚀作用。
c.加热时应由试管口向后逐渐移动。
如先加热试管底部,产生的甲烷气可能会把前面的细粉末冲散,引起导管口堵塞。
d.加热温度不可过高,以免发生副反应,而使产生的甲烷中混入丙酮等气体。
e.在导管口点燃甲烷前,应先检验纯度。
2.从哪些方面学习烷烃?(1)常见烷烃烷烃即饱和烃,是只有碳碳单键和碳氢键的链烃,是最简单的一类有机化合物。

化学 甲烷 名师点拨【本章学习目标】烃是一类重要的有机化合物,是一切有机物的母体。
本章主要介绍几类重要烃的代表物的分子结构、重要性质、制备方法和重要用途,同类烃的分子结构和性质的关系,还有同系物、同分异构体等重要的基本概念、烷烃的命名方法等。
为今后进一步学习烃的衍生物的知识奠定基础,同时也初步了解学习有机物的一些方法。
本章所涉及的主要有机物大约有十余种,其中甲烷、乙烯、乙炔、苯等,不仅是重要的化工产品,也是重要的化工原料,它们在工农业生产、日常生活、能源、医药等方面占有重要重要地位。
本章引言部分指出,有机物是含碳元素的化合物,在人类社会里起着重要的作用。
有机物的种类繁多(目前已超过两千万种,而无机物只有十几万种),其主要原因有两个:一是在有机物中,每个碳原子都形成四个共价键,碳碳原子间有单键、双键、三键、独特的键及碳链、碳环等多种结合方式;二是含有相同原子种类和数目的分子又可能具有不同的结构。
烃是仅含有碳氢两种元素的有机物,可用Y X H C 表示。
【本章重点内容】1.甲烷的分子结构和化学性质,取代反应的原理。
2.烷烃的性质,同分异构体的写法,烷烃的命名。
3.乙烯的分子组成和结构,乙烯的实验室制法,乙烯的化学性质和加成反应、加聚反应,烯烃、不饱和烃的概念和性质。
4.乙炔的结构和主要性质。
5.苯的主要化学性质以及与分子结构的关系。
苯的同系物的主要化学性质。
6.石油分馏和裂化的基本原理,煤的干馏原理和综合利用。
【本章难点内容】1.烷烃的命名,同分异构体。
2.苯的结构和主要化学性质。
【本章研究性课题】1.在农村推广使用沼气池的好处。
2.用数学方法研究同分异构体的数目。
3.城镇居民生活用煤和液化气情况的调查。
4.调查附近加油站汽油、柴油的品种、性能和价格。
【学习目标要求】1.掌握甲烷的组成和结构式,了解甲烷分子的正四面体结构。
2.掌握甲烷的化学性质(甲烷的取代反应、热分解反应和氧化反应一一燃烧)。
3.初步理解取代反应的概念内涵,理解甲烷与卤素间取代反应的相似性。

高中化学甲烷教案课题:甲烷教学内容:甲烷的性质和应用学科:化学年级:高中时长:1课时教学目标:1. 了解甲烷的结构和性质;2. 掌握甲烷的制取方法和应用;3. 能够分析甲烷的环境和生活意义。
教学重点和难点:重点:甲烷的结构和性质,制取方法和应用。
难点:甲烷的环境和生活意义。
教学准备:实验室设备:气体收集瓶、试管、气体洗瓶等。
实验药品:氢氧化钠、二氧化碳、碳酸氢钠等。
课件、教案、实验操作说明、知识点总结等。
教学过程:一、导入(5分钟)1. 介绍本节课的学习内容和目标;2. 回顾学生已经学过的相关知识,引出甲烷这一主题。
二、理论学习(20分钟)1. 环顾本课的内容,介绍甲烷的结构和性质;2. 讲解甲烷的制取方法和应用,包括天然气中的甲烷、工业中的甲烷制取等;3. 分析甲烷在生活中的应用和环境影响。
三、实验操作(30分钟)1. 实验操作:以制取甲烷的实验为例,让学生亲自动手操作实验过程,观察实验现象;2. 学生操作过程中,教师引导学生注意实验安全,讲解实验原理和实验步骤;3. 学生进行实验操作后,根据实验结果进行分析和讨论。
四、课堂讨论与总结(5分钟)1. 学生通过实验操作,对甲烷的制取方法和性质有了更深入的了解;2. 教师带领学生讨论甲烷的环境和生活意义,引导学生总结本节课的重点内容。
五、作业布置(5分钟)1. 布置相关作业,巩固学生对本节课内容的掌握;2. 鼓励学生主动查阅资料,进一步了解甲烷在生活中的应用和环境影响。
教学反思:通过本节课的教学活动,学生对甲烷的结构和性质、制取方法和应用有了更深入的了解。
实验操作使学生亲身体验了甲烷的制取过程,提高了学生的实践能力和动手能力。
在讨论和总结环节,学生展示了对甲烷在生活中的应用和环境影响的思考能力。
在今后的教学中,应继续引导学生深入探讨甲烷在环境保护和可持续发展中的作用,提高学生的综合素质和创新意识。

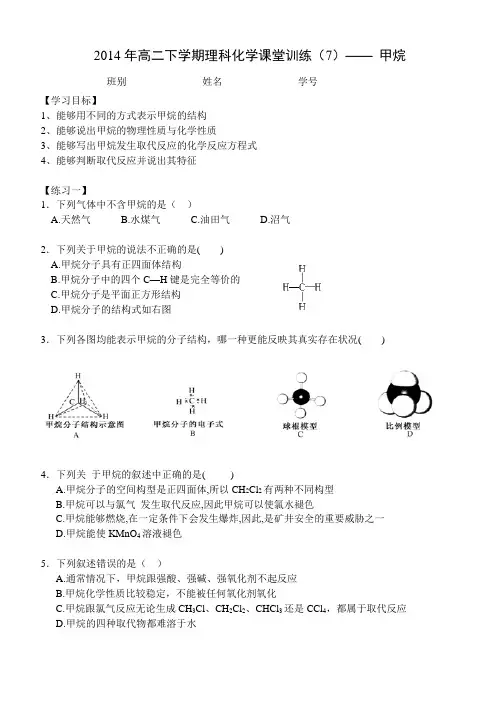
2014年高二下学期理科化学课堂训练(7)——甲烷班别_______________姓名_______________学号_______________【学习目标】1、能够用不同的方式表示甲烷的结构2、能够说出甲烷的物理性质与化学性质3、能够写出甲烷发生取代反应的化学反应方程式4、能够判断取代反应并说出其特征【练习一】1.下列气体中不含甲烷的是()A.天然气B.水煤气C.油田气D.沼气2.下列关于甲烷的说法不正确的是( )A.甲烷分子具有正四面体结构B.甲烷分子中的四个C—H键是完全等价的C.甲烷分子是平面正方形结构D.甲烷分子的结构式如右图3.下列各图均能表示甲烷的分子结构,哪一种更能反映其真实存在状况( )4.下列关于甲烷的叙述中正确的是()A.甲烷分子的空间构型是正四面体,所以CH2Cl2有两种不同构型B.甲烷可以与氯气发生取代反应,因此甲烷可以使氯水褪色C.甲烷能够燃烧,在一定条件下会发生爆炸,因此,是矿井安全的重要威胁之一D.甲烷能使KMnO4溶液褪色5.下列叙述错误的是()A.通常情况下,甲烷跟强酸、强碱、强氧化剂不起反应B.甲烷化学性质比较稳定,不能被任何氧化剂氧化C.甲烷跟氯气反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4,都属于取代反应D.甲烷的四种取代物都难溶于水【练习二】6.取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如下图),下列说法正确的是A .此反应属于加成反应B .此反应无光照也可发生C .试管内壁出现油状液滴D .此反应得到的产物是纯净物7.下列关于甲烷与氯气发生取代反应所得生成物的说法正确的是 ( )A 、都是有机物B 、都不溶于水C 、有一种气态物质,其余都是液体D 、有一种是无机物其余都是有机物8.在光照条件下,将等物质的量甲烷和氯气混合后,得到的产物最多的是( )A .CH 3ClB .CH 2Cl 2C .CCl 4D .HCl9.(双选)下列不属于取代反应的是A .CH 4+Cl 2CH 3Cl +HCl B .CH 3Cl +Cl 2CH 2Cl 2+HCl C .CH 4+2O 2CO 2+2H 2O D .CH 2=CH 2+H 2∆−−−→催化剂CH 3CH 3 10.1molCH 4与一定量的氯气在光照条件下发生取代反应,若产生的四种取代物的物质的量相等,则反应生成HCl 的物质的量为A .1.25molB .2molC .2.5molD .4mol11.乙烷在光照条件下与氯气发生取代反应,理论上得到的氯代物最多有几种( )A .5种B .6种C .8种D .9种【练习三】12.如图,某气体X 可能由H 2、CO 、CH 4中的一种或几种组成。
高二化学第二册第五章甲烷知识点甲烷在自然界的分布很广,甲烷是最简单的有机物,是天然气,沼气,坑气等的主要成分,俗称瓦斯。
以下是整理的第五章甲烷知识点,请大家认真学习。
甲烷是最简单的有机物,也是含碳量最小(含氢量最大)的烃,是沼气,天然气,坑道气和油田气的主要成分.甲烷物理性质甲烷是无色、无味、可燃和微毒的气体.甲烷对空气的重量比是0.54,比空气约轻一半.甲烷溶解很小, 在20℃、0.1千帕时,100单位体积的水,只能溶解3个单位体积的甲烷.同时甲烷燃烧产生明亮的蓝色火焰,然而有可能会偏绿,因为燃甲烷要用玻璃导管,玻璃在制的时候含有钠元素,所以呈现黄色的焰色,甲烷烧起来是蓝色,所以混合看来是绿色. 熔点:-182.5℃ 沸点:-161.5℃ 蒸汽压53.32kPa/-168.8℃ 饱和蒸气压(kPa):53.32(-168.8℃)相对密度(水=1)0.42(-164℃) 相对蒸气密度(空气=1):0.55 燃烧热:890.31KJ/mol 总发热量:55900kJ/kg(40020kJ/m3) 净热值:50200kJ/kg(35900kJ/m3) 临界温度(℃):-82.6 临界压力(MPa):4.59 爆炸上限%(V/V):15 爆炸下限%(V/V):5.3 闪点(℃):-188 引燃温度(℃):538 分子直径0.414nm 编辑本段甲烷化学性质化学品中文名称:甲烷别名:天然气,沼气,甲基氢化物英文名称:methane 技术说明书编码:51 马来文:metana CASNo.:74-82-8 分子式:CH4 分子量:16.04 国标编号:21007 分类:有机物 CH 键能:413kJ/mol HCH 键角:10928分子结构:正四面体形非极性分子,一个C以sp3杂化位于正四面体中心,4个H位于正四面体的4个顶点上晶体类型:分子晶体 (1)化学性质比较稳定把制得的甲烷气体通入盛有高锰酸钾溶液(加几滴稀硫酸)的试管里,没有变化.再把甲烷气体通入溴水,溴水不褪色.(2)取代反应把一个大试管分成五等分(或用一支有刻度的量气管),用排饱和食盐水法先收集1/5体积的甲烷,再收集4/5体积的氯气,把它固定在铁架台的铁夹上,并让管口浸没的食盐水里.然后让装置受漫射光照射.在阳光好的日子,约半小时后可以看到试管内氯气的黄绿色逐渐变淡,管壁上出现油状物,这是甲烷和氯气反应的所生成的一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和少量的乙烷的混和物.试管中液面上升,这是反应中生成的氯化氢溶于水的缘故.食盐水中白色晶体析出.因为氯气极易溶于水,溶于水后增加了水中氯离子的浓度,是氯化钠晶体析出.用大拇指按住试管管口,提出液面,管口向上,向试管中滴入紫色石蕊试液或锌粒,可验证它是稀盐酸.如果在阴暗的天气需1~2小时才能观察到反应的结果.(3)氧化反应点燃纯净的甲烷,在火焰的上方罩一个干燥的烧杯,很快就可以看到有水蒸气在烧杯壁上凝结.倒转烧杯,加入少量澄清石灰水,振荡,石灰水变浑浊.说明甲烷燃烧生成水和二氧化碳.把甲烷气体收集在高玻氧化反应璃筒内,直立在桌上,移去玻璃片,迅速把放有燃烧着的蜡烛的燃烧匙伸入筒内,烛火立即熄灭,但瓶口有甲烷在燃烧,发出淡蓝色的火焰.这说明甲烷可以在空气里安静地燃烧,但不助燃.用大试管以排水法先从氧气贮气瓶里输入氧气 2/3 体积,然后再通入1/3 体积的甲烷.用橡皮塞塞好,取出水面.将试管颠倒数次,使气体充分混和.用布把试管外面包好,使试管口稍微下倾,拔去塞子,迅速用燃着的小木条在试管口引火,即有尖锐的爆鸣声发生.这个实验虽然简单,但也容易失败.把玻璃导管口放出的甲烷点燃,把它放入贮满氯气的瓶中,甲烷将继续燃烧,发出红黄色的火焰,同时看到有黑烟和白雾.黑烟是炭黑,白雾是氯化氢气体和水蒸气形成的盐酸雾滴.(4)加热分解用125毫升集气瓶,收集一瓶纯净的甲烷.集气瓶口配有穿过两根粗铜电极(在瓶内约为瓶高的二分之一处)和直角玻管的橡皮塞,塞紧(如有孔隙,可涂上一薄层熔化的石蜡),并与盛有溴水的洗气瓶连接(由于反应过程中会有一定量乙炔气体生成).电极通过感应圈与电源相连.实验时,先放松导管上的夹子,接通6伏电源,铜电极间发生电火花放电,瓶壁上可以看到有炭黑产生,说明甲烷已经分解.稍等片刻,在导管的尖嘴处点火,并用于冷的烧杯罩在火焰上方,可以看到烧杯内壁变得模糊,并有水蒸气凝结,说明有氢气生成. 编辑本段用途燃料天然气的主要成分是甲烷,可直接用作气体燃料化工原料甲烷高温分解可得炭黑,用作颜料、油墨、油漆以及橡胶的添加剂等;氯仿和CCl4都是重要的溶剂. 沼气甲烷在自然界分布很广,是天然气、沼气、坑气及煤气的主要成分之一.它可用作燃料及制造氢、一氧化碳、炭黑、乙炔、氢氰酸及甲醛等物质的原料.第五章甲烷知识点的全部内容就是这些,更多精彩内容请持续关注。
高二化学烃的分类知识点烃是由碳和氢元素组成的有机化合物,是化学反应的基础。
在高二化学学习中,了解烃的分类是非常重要的。
本文将为您介绍高二化学烃的分类知识点。
一、根据碳原子数分类1. 饱和烃:饱和烃是只含有单键的烃,如甲烷(CH4)、乙烷(C2H6)等。
它们的碳原子数可以是1、2、3、4、5等。
2. 不饱和烃:不饱和烃含有多个双键或三键,如乙烯(C2H4)、丙烯(C3H6)等。
不饱和烃比饱和烃更加活泼,容易发生化学反应。
二、根据碳原子排列方式分类1. 直链烃:直链烃的碳原子按照直线排列,如丙烷(C3H8)、正戊烷(C5H12)等。
直链烃的分子结构比较简单。
2. 支链烃:支链烃的碳原子排列成分支形式,如异丙烷(C3H8)、异戊烷(C5H12)等。
支链烃的分子结构相对复杂。
三、根据分子结构分类1. 环烃:环烃是由碳原子排列成环状结构的烃,如环丙烷(C3H6)、环己烷(C6H12)等。
环烃的分子结构相对稳定。
2. 脂环烃:脂环烃是环烃上还有一个或多个直链烃的取代基,如甲基环己烷(C7H14)、乙基环已烷(C8H16)等。
四、根据烃的性质分类1. 脂肪烃:脂肪烃是指碳原子间只有单键的烃,如甲烷(CH4)、乙烷(C2H6)等。
脂肪烃大部分为饱和烃。
2. 芳香烃:芳香烃是由苯环结构和苯环取代基组成的烃,如苯(C6H6)、甲基苯(C7H8)等。
芳香烃具有特殊的香味。
五、根据分子量分类1. 小分子烃:小分子烃的分子量相对较小,如甲烷(CH4)、乙烷(C2H6)等。
小分子烃通常为气体或液体。
2. 大分子烃:大分子烃的分子量较大,如各类石油产品中的烃。
大分子烃通常为液体或固体。
综上所述,高二化学中对烃的分类主要包括根据碳原子数、根据碳原子排列方式、根据分子结构、根据烃的性质和根据分子量这五个方面。
通过掌握这些分类知识点,我们能更好地理解烃的性质及其在化学反应中的应用。
同时,对于不同分类的烃,我们还可以推测它们的化学性质和物理性质,从而深入了解和应用有机化学的知识。