高中化学 甲烷的结构与性质
- 格式:doc
- 大小:89.52 KB
- 文档页数:4

性质结构目标清华中学 文继明用途练习一、甲烷的分子结构甲烷分子是一个正四面体的非极性分子, 分子中四个C--H 键的键角均为'28109两种正四面体的比较'02810906044CH NH 与4P2)光照下与卤素反应2、化学性质:常况下甲烷的性质稳定不能使酸性高锰酸钾 溶液褪色1、物理性质::无色无味气体,比空气轻,难溶于水 二、甲烷的性质1)能燃烧 O H CO O CH 222422+−−→−+点燃甲烷与氯气在光照下的取代产物有:: Cl CH322Cl CH Cl CH CHCl CCl HCl同时还有取代反应:有机物分子中的原子或原子团被其 它的原子或原子团替换的反应。
卤代反应:有机物分子中的原子或原子团被卤素原子所取代的反应。
卤代反应属于取代反应 中的一种 。
22Cl CH 3CHCl 4CCl 空间结构Cl CH 3后退 请用鼠标点击2)光照下与卤素反应2、化学性质:常况下甲烷的性质稳定不能使酸性高锰酸钾 溶液褪色1、物理性质::无色无味气体,比空气轻,难溶于水 二、甲烷的性质1)能燃烧 O H CO O CH 222422+−−→−+点燃3) 高温下分解反应 242H C CH +−−→−高温三、甲烷的存在及用途1、存在:天然气、瓦斯气、沼气等的主要成分均是甲烷2、用途:颜料油漆实验用品医药橡胶工业甲烷燃料返回后退2CO 2H C 和取代反应:有机物分中的原子或原子团被其原子团替换的反应。
卤代反应:有机物分子中的原子或原子团被取代的反应。
卤代反应属于取代反应中的一种 。
22Cl CH 3CHCl ClCH 34CCl 小结4CH1、下列分子中,含有极性键且呈正四面体的是( )甲烷 白磷 氨气 二氯甲烷 2、将甲烷与氯气等体积混合后光照,其产物有( )种1 2 4 5 3、将甲烷与氯气等体积混合后光照,生成最多的是( ) 一氯甲烷 二氯甲烷 氯仿 氯化氢课堂练习A B C D A B C D A B C D3、下列气体中不含甲烷的是( )A 、水煤气B 、天然气C 、煤矿瓦斯D 、沼气4、光照下列混合物,几乎没有化学反应发生的是( )A 、溴蒸汽与天然气B 、氯水C 、氢气和氧气D 、碘化银 5、下列反应不是取代反应的是( ) A 、光照二氯甲烷与氯气的混合物生成氯仿 B 、用甲烷与氟气反应制备氟里昂C 、甲烷与溴蒸汽光照反应生成四溴化碳D 、甲烷的高温裂解课堂练习 答案3、下列气体中不含甲烷的是( )A 、水煤气B 、天然气C 、煤矿瓦斯D 、沼气4、光照下列混合物,几乎没有反应发生 的是( )A 、溴蒸汽与天然气B 、氯水C 、氢气和氧气D 、碘化银5、下列反应不是取代反应的是( )A 、光照氯仿与氯气的混合物B 、用甲烷与氟气反应制备氟里昂C 、甲烷与溴蒸汽光照反应生成四溴化碳D 、甲烷的高温裂解A 答案3、下列气体中不含甲烷的是( )A 、水煤气B 、天然气C 、煤矿瓦斯D 、沼气4、光照下列混合物,几乎没有反应发生 的是( )A 、溴蒸汽与天然气B 、氯水C 、氢气和氧气D 、碘化银5、下列反应不是取代反应的是( )A 、光照氯仿与氯气的混合物B 、用甲烷与氟气反应制备氟里昂C 、甲烷与溴蒸汽光照反应生成四溴化碳D 、甲烷的高温裂解A C 答案3、下列气体中不含甲烷的是( )A 、水煤气B 、天然气C 、煤矿瓦斯D 、沼气4、光照下列混合物,几乎没有反应发生 的是( )A 、溴蒸汽与天然气B 、氯水C 、氢气和氧气D 、碘化银5、下列反应不是取代反应的是( )A 、光照氯仿与氯气的混合物B 、用甲烷与氟气反应制备氟里昂C 、甲烷与溴蒸汽光照反应生成四溴化碳D 、甲烷的高温裂解A C D6、下列事实能说明甲烷分子呈正四面体的是()A、一氯甲烷只有一种结构答案B、二氯甲烷只有一种结构C、三氯甲烷只有一种结构D、四氯化碳只有一种结构7、能说明甲烷的稳定性好的事实是()A、甲烷不能使酸性高锰酸钾溶液褪色B、甲烷不容易液化C、甲烷分子的空间构型是正四面体D、由无水醋酸钠和碱石灰反应制甲烷时需要加热返回上页下页6、下列事实能说明甲烷分子呈正四面体 的是( )A 、一氯甲烷只有一种结构B 、二氯甲烷只有一种结构C 、三氯甲烷只有一种结构D 、四氯化碳只有一种结构7、能说明甲烷的稳定性好的事实是( )A 、甲烷不能使酸性高锰酸钾溶液褪色B 、甲烷不容易液化C 、甲烷分子的空间构型是正四面体D 、由无水醋酸钠和碱石灰反应制甲烷时需 要加热答案 B 下页上页 返回6、下列事实能说明甲烷分子呈正四面体 的是( )A 、一氯甲烷只有一种结构B 、二氯甲烷只有一种结构C 、三氯甲烷只有一种结构D 、四氯化碳只有一种结构7、能说明甲烷的稳定性好的事实是( )A 、甲烷不能使酸性高锰酸钾溶液褪色B 、甲烷不容易液化C 、甲烷分子的空间构型是正四面体D 、由无水醋酸钠和碱石灰反应制甲烷时需 要加热A B 下页上页 返回选做题已知答案已知请仿照上面的反应原理完成下列反应方程式选做题《甲烷》教学目标1、认识甲烷的分子组成及空间结构2、理解取代反应的概念3、掌握甲烷的重要性质4、了解甲烷的存在及重要用途。

甲烷知识点归纳总结一、甲烷的基本性质1. 分子结构:甲烷是由一个碳原子和四个氢原子组成的简单分子,分子结构呈正四面体形状。
2. 物理性质:甲烷是一种无色、无味、无臭的气体,在常温下密度小于空气,具有较低的沸点和凝固点。
3. 化学性质:甲烷是一种不容易发生化学反应的稳定分子,但它可以与氧气发生燃烧反应,生成二氧化碳和水。
二、甲烷的生产与提取1. 天然气中的甲烷:地球上存储着大量的天然气资源,其中主要成分就是甲烷。
甲烷可以通过地下钻探开采和提取来进行生产。
2. 人工合成甲烷:除了从天然气中提取甲烷外,还可以通过人工合成的方式来生产甲烷。
常见的方法包括催化剂催化合成、生物发酵法等。
三、甲烷的用途1. 燃料资源:甲烷是一种重要的燃料资源,被广泛应用于工业生产、建筑取暖、机动车燃料等领域。
2. 化工原料:甲烷还是许多有机化合物的重要起始物质,可通过氢化反应、氯化反应等转化为甲醇、乙烯、乙醇等化学品。
3. 温室气体:由于甲烷具有很强的温室效应,它也是造成全球变暖的重要气体之一。
四、甲烷的环境影响1. 温室效应:甲烷是一种主要的温室气体,对地球大气层的温室效应起着重要作用,加剧了全球变暖的问题。
2. 空气污染:甲烷是造成雾霾和光化学烟雾的重要成分,对空气质量产生了不利影响。
五、甲烷的利用与保护1. 提高利用率:在甲烷的开采和使用过程中,应该采用高效、清洁的技术,提高利用率,减少排放。
2. 温室气体减排:生活中可以采用节能减排、低碳生活方式,减少碳排放,进而减少甲烷等温室气体的释放。
3. 天然气替代:在能源利用方面,可以鼓励发展清洁能源,如太阳能、风能,减少对甲烷等化石燃料的依赖。
总结:甲烷作为一种重要的碳氢化合物,对人类的生产与生活具有重要的意义。
但随着现代工业发展,甲烷的大量释放已经成为了严重的环境问题。
因此,必须采取有效措施,提高甲烷的利用率,减少甲烷的排放,共同保护地球的环境。

最简单的有机化合物—甲烷知识点甲烷(Methane)是最简单的有机化合物,由一个碳原子和四个氢原子组成。
它的分子式为CH4,结构式为H- C- H ,其中一个碳原子的四个键都与氢原子形成共价键。
甲烷是一种无色、无味、无毒的气体,在标准大气压下和常温下是不溶于水的。
它是天然气的主要成分,也是地球上最常见的有机化合物之一甲烷在工业和能源领域具有重要的应用。
首先,作为一种燃料,甲烷广泛用于发电、供暖和燃料汽车等。
它燃烧产生的主要产物是二氧化碳和水,不会产生有害物质,对环境相对友好。
其次,甲烷也被用作一种原料,可以通过一系列的化学反应制备其他有机化合物,如乙烯和丙烷等。
甲烷的结构和性质是有机化学的基础,了解甲烷的性质对于理解其他有机化合物的性质也非常重要。
下面将介绍一些甲烷的重要知识点:1. 分子结构:甲烷的分子式为CH4,在它的分子中,碳原子形成四个单键,与四个氢原子形成共价键。
甲烷的碳原子是sp3杂化的,四个键的角度都是109.5度,形成一个平面四边形的结构。
2.化学性质:甲烷是一种稳定的化合物,不容易发生化学反应。
它具有较低的反应活性,不与大多数物质发生反应,但在高温和高压下可以与氧气发生反应,产生二氧化碳和水。
3.燃烧反应:甲烷是一种优秀的燃料,可以完全燃烧产生二氧化碳和水。
燃烧反应通常是一个放热反应,释放大量的能量。
这也是为什么甲烷被广泛用于发电和供暖的原因。
4.极性:甲烷是一种非极性分子,碳原子和氢原子从电负性上较为接近,所以甲烷的分子内部没有极性。
这也意味着甲烷与溶剂的相互作用较弱。
5.甲烷的氧化:甲烷可以被氧化为甲基自由基(CH3·)、反应类型被称为链反应。
甲基自由基是一种高度反应性的物质,可以引发许多有机反应,如氧化、取代、加成等。
6.甲烷在大气中的作用:甲烷是一种重要的温室气体,它可以吸收地球表面发出的红外辐射,从而造成地球的温室效应。
尽管甲烷相对于二氧化碳而言是一个较短寿命的气体,但它的温室效应是二氧化碳的20多倍。

高三有机物甲烷知识点甲烷,化学式为CH4,是最简单的烷烃,也是一种常见的有机物。
它由一个碳原子和四个氢原子组成,并且在自然界中广泛存在。
下面我们将介绍一些关于甲烷的知识点。
1. 分子结构甲烷的分子结构是一个碳原子与四个氢原子锁成的四面体。
碳原子通过共价键与四个氢原子相连,形成四个C-H化学键。
甲烷的键角为109.5度,由于氢原子都位于碳原子周围的四个顶点,因此分子没有极性。
2. 物理性质甲烷是一种无色、无味、无毒的气体。
其密度较低,比空气轻,因此可以升至空气中。
甲烷的熔点为-182.5°C,沸点为-161.5°C。
在常温下,甲烷较不溶于水,但能与许多有机溶剂混合。
3. 化学性质甲烷是一种相对稳定的化合物,在常温下不容易发生化学反应。
然而,在一定的条件下,甲烷可以发生燃烧反应。
当甲烷与氧气发生反应时,会产生二氧化碳和水,并且释放出大量的能量。
这也是甲烷被广泛用作燃料的原因之一。
4. 甲烷的应用甲烷在生活中有着广泛的应用。
它是石油和天然气中最简单的成分之一,常用作燃料。
甲烷可以作为燃气用于烹饪、供暖和发电。
此外,甲烷也被用作化工原料,可以用于制备其他有机化合物。
5. 甲烷的环境影响尽管甲烷在许多方面都有着重要的应用,但它也是一种温室气体。
甲烷的排放会对大气层的温度产生影响,加剧全球变暖的问题。
因此,减少甲烷的排放对于环境保护至关重要。
总结:甲烷是一种简单而重要的有机化合物,具有广泛的应用。
了解甲烷的分子结构、物理性质和化学性质有助于我们更好地理解这种有机物的特点。
同时,我们也要关注甲烷排放对环境造成的影响,积极采取措施减少其对气候变化的负面影响。

甲烷立体结构知识点总结
1. 分子结构:甲烷分子由一个碳原子和四个氢原子组成。
碳原子位于分子中心,四个氢原子均匀的分布在碳原子周围,形成一个对称的结构。
2. 键角:甲烷分子的碳原子和四个氢原子之间的共价键角是109.5°,这是由于碳原子和氢原子之间的电子云排斥力导致的最稳定结构。
3. 构象:甲烷分子是非极性分子,因为碳-氢键是非极性共价键。
甲烷分子没有偶极矩,因此在电场中不会受到偶极-偶极相互作用力的影响。
这使得甲烷分子在化学反应中的行为变得特殊,并且也广泛应用于实际生产中。
4. 空间构型:根据VSEPR理论(原子轨道占据的空间对称性理论),甲烷分子采取了一种最低能量构型,使得所有共价键角相等,并且分子几何构型呈四面体形状。
这种构型对于甲烷分子的性质影响很大,包括分子形状、极性和化学反应等。
5. 空间构型的影响:甲烷分子的四面体构型决定了分子的对称性,使得甲烷分子在化学反应中具有特殊的稳定性和反应性。
例如,在取代反应中,由于甲烷分子的四个氢原子均匀分布在四个方向上,使得取代反应的反应物易于平衡,有利于反应的进行。
总的来说,甲烷的立体结构是由于碳原子和四个氢原子之间的共价键构成的四面体结构和109.5°的键角所确定的。
这种立体结构决定了甲烷分子的性质和行为,使得甲烷在自然界和工业生产中都具有重要的应用价值。
对甲烷立体结构的深入了解,有助于人们更好地理解和应用甲烷这一有机化合物。

高中化学有机化合物之甲烷知识点汇总一、甲烷的存在、结构及物理性质1.存在甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分。
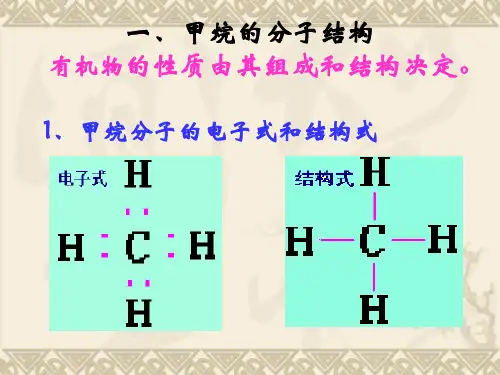
2.分子结构甲烷的分子式是CH4;电子式是;结构式是。
实验证明,甲烷分子具有正四面体结构,其中四个C—H键长度和强度相同,夹角相等。
3.物理性质颜色状态气味密度(与空气相比) 水溶性无色气体无味比空气小极难溶警示有机化合物必须含有碳元素,但含有碳元素的化合物不一定是有机化合物,如CO、CO2,碳酸及其盐等。
【讨论】1.(1)CH4是正四面体结构,CH3Cl、CH2Cl2、CHCl3、CCl4也都是正四面体结构吗?(2)如果甲烷是平面结构,则CH2Cl2有几种结构?实际上有几种结构?答案(1)CH4是正四面体结构,碳原子处于正四面体的中心,四个氢原子处于正四面体的四个顶点上。
根据甲烷是正四面体结构推理,有机物分子中碳原子以4个单键与其他原子或原子团相结合,如,若a、b、c、d相同,则构成正四面体结构,如CCl4;若a、b、c、d不相同,则构成四面体,但不是正四面体,如CH3Cl、CH2Cl2、CHCl3。
(2)如果甲烷是平面结构,则CH2Cl2有2种结构,分别是,实际为空间四面体结构,所以二氯甲烷只有一种结构。
二、甲烷的化学性质通常状况下,甲烷比较稳定,与高锰酸钾等强氧化剂不反应,与强酸、强碱也不反应。
但在特定的条件下,甲烷也会发生某些反应。
1.氧化反应(燃烧)(1)化学方程式:CH4+2O2点燃――→CO2+2H2O 。
(2)现象:甲烷在空气中安静地燃烧,火焰呈淡蓝色。
2.取代反应(1)取代反应有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应。
(2)甲烷与氯气的取代反应①实验探究②产物性质CH3Cl CH2Cl2 CHCl3 CCl4状态气体均为油状液体水溶性都不溶于水点拨无论CH4和Cl2的比例如何,发生取代反应的产物都是CH3Cl、CH2Cl2、CHCl3、CCl4和HCl的混合物。

甲烷的结构与性质1.基本性质1.1甲烷的存在有石油的地方一般有天然气的存在,天然气的主要成分是甲烷,石油炼制获得的石油气中也含有甲烷,甲烷还是沼池底部产生的沼气和煤矿坑道产生的气体(坑道气或瓦斯气)的主要成分,海底存在的“可燃冰”主要是天然气水合物(CH 4·nH 2O )。
1.2甲烷的物理性质甲烷为无色、无味、比空气轻、难溶于水的气体,沼气、天然气的主要成分是甲烷。
1.3分子结构正四面体的立体结构,而不是平面正方形结构,键角为109°28′,结构式为,结构简式为CH 4。
2.性质应用(1)稳定性:常温下与溴水、酸性高锰酸钾溶液等不反应。
(2)氧化性:在空气中点燃纯净的甲烷气体,可以安静地燃烧,产生淡蓝色的火焰,生成二氧化碳和水,放出大量的热。
反应的热化学方程式为:CH 4(g)+2O 2(g)−−−→点燃CO 2(g)+2H 2O(l);.3kJ/mol H=-890。
因此,以甲烷为主要成分的天然气是一种理想的清洁能源。
CH 4的分子结构稳定,通常不与强酸、强碱、强氧化剂(如KMnO 4)反应。
注意:①甲烷燃烧前后的物质的量相等,若生成的水为蒸气时,燃烧前后气体体积相等。
②如果点燃甲烷跟氧气或空气的混合气体,可能发生爆炸。
因此,点燃甲烷之前要先验纯。
(3)取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应。
例如: CH 4+Cl 2−−→光HCl+CH 3Cl(一氯甲烷,气态,局部麻醉剂) CH 3Cl+Cl 2−−→光HCl+CH 2Cl 2(二氯甲烷,油状液体,有机溶剂) CH 2Cl 2+Cl 2−−→光HCl+CHCl 3(三氯甲烷,俗称氯仿,油状液体,有机溶剂) CHCl 3+Cl 2−−→光HCl+CCl 4(四氯甲烷,俗称四氯化碳,油状液体,灭火剂) 说明:CH 4和Cl 2取代反应的每一步都不能进行到底,所以反应到一定程度后将是包括CH 4和Cl 2及所有生成物的混合物。

(人教必修2)3.1.1《甲烷的结构与性质》教学设计学式。
(提示:可以根据共价键理论和C、H原子比例判断甲烷分子式。
)【板书】1、甲烷的化学式(分子式):CH4【讲解】因为碳原子有四个价电子,欲形成八个电子的稳定结构,需要形成四对共用电子对才能达到八个电子的稳定结构;氢原子核外有一个电子,欲形成两个电子的稳定结构,需要形成一对共用电子对才能达到两个电子的稳定结构。
所以甲烷的化学式为:CH4【随堂练习】已知甲烷的分子式为CH4,①写出甲烷的电子式;②写出甲烷的结构式。
【板书】2、电子式:3、结构式(structural formula):结构简式:CH4【过渡】结构式仅用来表示分子中原子的连结顺序,不能表示分子中原子在空间的分布。
我们知道了甲烷的分子式和结构式,那么甲烷分子的结构是什么样的呢?【实践活动】按课本要求动手实验:【讲解】甲烷的电子式和结构式只能表示甲烷分子中碳、氢原子的结合方式,但不能表示甲烷分子中原子在空间的排布情况。
经过科学实验证明甲烷分子的结构是对称的正四面体结构,碳原子位于正四面体的中心,4个氢原子分别位于正四面体的4个顶点上,四个C—H键强度相同。
【讲解】但是CH4的结构式并不能代表其真实构型,我们称其为平面结构式,只是为了简便起见,一般只写有机物的平面结构式。
【展示】甲烷的比例模型和甲烷的球棍模型事物的联系性。
教师根据学生的回答,总结、归纳,进行板书。
【讲解】球棍模型及比例模型:借助球棍子模型讲解人们是如何确定甲烷是正四面体空间结构,而不是平面正方形结构。
【投影】拓展资料:甲烷分子结构的参数:1、键角都是109028′2、键长1.09×10--10m3、键能是413kJ/mol【讲解】结构式实际是分子球棍模型在平面上的投影,表示分子内各原子的成键情况。
球棍模型能表示分子内各原子在空间的相对位置和立体构型。
比例模型能表示分子内各成键原子的相对大小和在空间的相对位置。

化学高一甲烷知识点甲烷是一种最简单的烷烃,由一个碳原子和四个氢原子组成。
在化学中,甲烷是一种非常重要的化合物,它不仅在工业生产中有广泛的应用,也在日常生活中发挥着重要的作用。
下面将介绍化学高一甲烷的一些基本知识点。
1. 甲烷的结构和化学式甲烷的化学式为CH4。
它是一种无色无味的气体,具有高度的易燃性。
由于碳原子的电子云与四个氢原子的电子云以共价键的形式相互连接,甲烷的分子形成了一个形状类似于正四面体的结构。
2. 甲烷的制备方法甲烷可以通过多种方法进行制备。
其中一种常见的方法是通过甲烷发酵,即利用某些细菌在缺氧条件下将有机废料分解产生甲烷气体。
此外,甲烷还可以通过合成气(由一氧化碳和氢气组成)的加氢反应制备。
3. 甲烷的性质甲烷是一种非极性分子,由于其碳-氢键极性很小,因此甲烷在水等极性溶剂中几乎不溶。
甲烷是一种轻质气体,在室温下可以通过加压或降温转化为液体。
甲烷可以燃烧,反应产物为二氧化碳和水。
4. 甲烷的应用甲烷在工业生产中有广泛的应用。
它是一种重要的燃料,被用于炉燃料、发电和供暖等。
此外,甲烷还可以用作材料的合成和化学反应的起始物质。
在日常生活中,甲烷也被广泛应用于燃气灶和热水器等家用设备中。
5. 甲烷的环境影响甲烷是一种温室气体,对于地球的气候变化有重要的影响。
大量的甲烷排放会导致大气温室效应强化,进而加剧全球气候变暖的问题。
因此,控制甲烷排放对于减缓气候变化至关重要。
综上所述,化学高一的甲烷知识点包括甲烷的结构和化学式、制备方法、性质、应用以及环境影响等方面。
对于学习化学的学生来说,了解甲烷的知识将帮助他们更好地理解有机化学的基础概念,并认识到甲烷在工业和环境方面的重要性。

高一必修2化学甲烷知识点梳理
化学是自然科学的一种 ,在分子、原子层次上研究物质的组成、性质、结构与变化规律;创造新物质的科学。
小编准备了高一必修2化学甲烷知识点 ,希望你喜欢。
烃-碳氢化合物:仅有碳和氢两种元素组成(甲烷是分子组成最简单的烃)
1、物理性质:无色、无味的气体 ,极难溶于水 ,密度小于空气 ,俗名:沼气、坑气
2、分子结构:CH4:以碳原子为中心 , 四个氢原子为顶点的正四面体(键角:109度28分)
3、化学性质:①氧化反响: (产物气体如何检验?)
甲烷与KMnO4不发生反响 ,所以不能使紫色KMnO4溶液褪色②取代反响: (三氯甲烷又叫氯仿 ,四氯甲烷又叫四氯化碳 ,二氯甲烷只有一种结构 ,说明甲烷是正四面体结构) 4、同系物:结构相似 ,在分子组成上相差一个或假设干个CH2原子团的物质(所有的烷烃都是同系物)
5、同分异构体:化合物具有相同的分子式 ,但具有不同结构式(结构不同导致性质不同)
烷烃的溶沸点比拟:碳原子数不同时 ,碳原子数越多 ,溶沸点越高;碳原子数相同时 ,支链数越多熔沸点越低
同分异构体书写:会写丁烷和戊烷的同分异构体
高一必修2化学甲烷知识点就为大家介绍到这里 ,希望对
你有所帮助。
高三化学甲烷知识点甲烷(CH4)是一种简单的有机化合物,由一个碳原子和四个氢原子组成。
它是最简单的烷烃,也是天然气的主要成分之一。
在高三化学学习中,了解甲烷的结构、性质和应用是非常重要的。
本文将重点介绍甲烷的相关知识点。
一、甲烷的结构甲烷的结构可以通过路易斯结构图或简化的空间结构图表示。
在路易斯结构图中,一个碳原子位于中心,四个氢原子连接在四个方向上。
碳原子与四个氢原子之间通过共价键相连。
简化的空间结构图可以更清晰地展示甲烷分子的立体结构。
二、甲烷的性质1. 物理性质:甲烷是一种无色、无味的气体,在标准温度和压力下,它是可燃的。
甲烷的密度小于空气,因此它可以从一定高度逸出。
2. 化学性质:甲烷是一种稳定的物质,不与常见氧化剂反应。
然而,在充足氧气供应下,甲烷会燃烧产生二氧化碳和水。
它的燃烧反应是一个典型的燃烧反应,释放出大量的能量。
甲烷的燃烧也是天然气的燃烧过程。
三、甲烷的应用1. 燃料:甲烷是一种重要的燃料,广泛用于家庭、工业和交通领域。
它是一种清洁的燃料,燃烧后产生的污染物比其他燃料要少。
2. 化学反应的中间体:甲烷在化工生产中也有重要的应用。
它可以作为一种化学反应的中间体,用于合成其他有机化合物,如甲醇和乙烯等。
3. 质谱分析:甲烷还经常被用作质谱仪的标准气体。
质谱分析是一种常用的分析技术,可以用来确定化合物的结构和组成。
四、甲烷的环境意义1. 温室气体:甲烷是一种温室气体,它的排放对地球的气候变化具有重要影响。
在缺氧环境中,甲烷可以被微生物产生,例如它可以在沼泽地、牧场和陆地冰层中生成。
控制甲烷的排放对于减缓全球气候变暖非常重要。
2. 天然气资源:甲烷是天然气的主要组成部分,具有丰富的储藏量。
天然气作为一种清洁能源,受到越来越多人的关注和使用。
总结:通过了解甲烷的结构、性质和应用,我们可以更好地理解有机化合物的基本原理和实际应用。
在高三化学学习中,掌握甲烷相关的知识点,对于理解化学反应、燃烧原理和环境保护等方面都具有重要意义。
考点48 常见烃的结构与性质一、甲烷的结构和性质1.甲烷的存在和用途(1)甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分。
2.甲烷的分子结构(1)组成与结构分子式电子式结构式球棍模型比例模型CH4(2)空间结构空间结构示意图结构特点及空间构型4个C—H键的长度和强度相同,夹角相等,是正四面体结构;碳原子位于正四面体的中心,4个氢原子位于4个顶点3.甲烷的性质(1)物理性质颜色气味状态水溶性密度无色无味气态难溶比空气的小(2)化学性质在通常情况下,甲烷性质比较稳定,与酸性KMnO4等强氧化剂以及强酸、强碱都不反应。
但在特定条件下也会发生某些反应。
①甲烷的氧化反应——可燃性CH4+2O2CO2+2H2O现象:燃烧时放出大量的热,还伴有淡蓝色火焰。
②甲烷的取代反应a.甲烷与氯气的取代反应实验操作实验现象(A)装置a.色变浅:试管内气体的颜色逐渐变浅,最终变为无色;b.出油滴,生白雾:试管内壁有油状液滴出现,同时试管中有少量白雾;c.水上升:试管内液面逐渐上升。
(B)装置:无明显现象现象分析a.色变浅:说明氯气参与了反应,导致混合气体的黄绿色变浅;b.出油滴:说明反应后有难溶于水的有机物生成;c.生白雾:说明有HCl生成;d.水上升:说明反应后气体体积减小而使水位上升实验结论光照条件下,甲烷与Cl2发生反应:CH3Cl+Cl2CH2Cl2+HClCH2Cl2+Cl2CHCl3+HClCHCl3+Cl2CCl4+HClb.甲烷的四种氯代产物名称一氯甲烷二氯甲烷三氯甲烷四氯甲烷状态常温时呈气态常温时均呈液态俗称————氯仿四氯化碳结构式空间构型 均是四面体(不是正四面体)正四面体水溶性 均不溶于水密度 —— 均比水的大用途————有机溶剂有机溶剂、灭火剂4.注意事项(1)有机反应比较复杂,常伴随很多副反应发生,因此有机反应方程式常用“―→”。
(2)CH 4与Cl 2的反应逐步进行,应分步书写。
(3)当n (CH 4)∶n (Cl 2)=1∶1时,反应并不只发生CH 4+Cl 2−−−→光照CH 3Cl+HCl ,其他反应仍发生。
甲烷的结构概念甲烷是一种化学物质,是由一种碳原子和四个氢原子组成的有机化合物。
甲烷的结构是简单的,由于碳原子的特殊性质,甲烷的结构具有一些独特的特点。
甲烷的化学式为CH4,其中C代表碳原子,H代表氢原子。
在甲烷的分子中,碳原子位于中心,四个氢原子平均分布在碳原子的周围。
甲烷的结构可以表示为一个四面体的形状,其中碳原子位于该四面体的中心,四个氢原子分别连接在四个面上。
甲烷的结构是由碳原子的特殊性质决定的。
碳原子的电子排布为2,4,即在碳原子的外层电子数为四个。
碳原子与氢原子的键是最简单的共价键,每个氢原子与碳原子之间都会共用一个电子。
在甲烷的结构中,碳原子与四个氢原子都形成了共价键,每个氢原子与碳原子之间的键长和键强度是相等的。
甲烷的结构具有一些特殊性质。
首先,由于甲烷分子的对称性,它是无极性分子,即分子中没有正负电荷的分布差异。
这使得甲烷在非极性溶剂中溶解度较大,如有机溶剂。
其次,甲烷的碳-氢键是非常强的共价键,具有较高的键能和键长,具有很高的稳定性。
再次,在燃烧过程中,甲烷的结构会发生改变,碳原子与氧原子形成碳-氧键,同时释放出大量的能量。
甲烷是一种非常重要的化学物质,在生活和工业生产中都有广泛的用途。
它是天然气的主要组成部分,具有良好的可燃性和高效的能量释放。
甲烷还用于生产合成气、乙烯和其他有机化合物,是化学工业中的重要原料。
总之,甲烷的结构是由一个碳原子和四个氢原子组合而成的。
其结构是一个四面体,碳原子位于中心,四个氢原子连接在四个面上。
甲烷的结构具有无极性、高稳定性和高能量释放等特点。
甲烷在生活和工业生产中有广泛的应用,是一种非常重要的化学物质。
证明甲烷是正四面体结构的事实甲烷,即化学式为CH4的分子,是一种简单的有机化合物。
它由一个碳原子和四个氢原子组成,四个氢原子均连接在碳原子上,形成一个四面体结构。
下面将从分子结构、键角和化学性质等方面来证明甲烷是正四面体结构的事实。
我们来看甲烷的分子结构。
甲烷的分子中有一个碳原子和四个氢原子。
碳原子与每个氢原子之间通过共价键相连。
共价键的形成是由于碳原子的四个价电子和氢原子的一个价电子之间的共享。
由于碳原子形成四个共价键,每个氢原子都与碳原子相连,甲烷分子的结构呈正四面体。
我们来分析甲烷分子中的键角。
键角是指两个相邻原子和其中一个氢原子之间的夹角。
在甲烷分子中,碳原子与四个氢原子之间的键角均相等。
根据实验测定,甲烷分子中的C-H键角约为109.5度。
正四面体的内角为109.47度,非常接近甲烷分子中的键角。
这进一步证明了甲烷是正四面体结构的事实。
甲烷的化学性质也支持它是正四面体结构。
由于甲烷分子中的四个氢原子位置相对等,因此它具有旋转对称性。
这种旋转对称性使甲烷分子在化学反应中具有特殊的稳定性。
甲烷与氧气反应时,氧气会优先与甲烷分子中的碳原子发生反应,而不是与氢原子发生反应。
这是因为甲烷分子中的四个氢原子位置相对等,氧气无法选择性地与其中的一个氢原子发生反应。
这种化学性质与正四面体的对称性一致,进一步证明了甲烷是正四面体结构的事实。
甲烷是正四面体结构的事实可以通过分子结构、键角和化学性质等方面来证明。
甲烷分子中的四个氢原子均连接在碳原子上,形成一个四面体结构。
碳原子与氢原子之间的键角约为109.5度,非常接近正四面体的内角。
甲烷分子具有旋转对称性,使其在化学反应中具有特殊的稳定性。
这些事实明确地表明甲烷是正四面体结构的。
・甲烷:空间构型为正四面体。
(2) 物理性质:无色无味的气体,密度0.717g/L ,记忆溶于水。
(3) 化学性质:通常情况下甲烷t 匕较稳定,与高猛酸钾等强氧化剂不反应,与强酸 强碱不反应,可发生氧化反应、取代反应占馋① 氧化反应:CH 4+O 2 —CO 2+2H 2O② 取代反应:CH4+Cl2_CH3CI + HCI ,甲烷在光照条件下反应,现象:试管内气 体颜色逐渐变浅,试管壁上有油状液滴,试管中有少量白雾。
甲烷中四个氢原子都 可以与氯气发生取代,甲烷的4中氯代产物都不溶于水,常温下,一氯甲烷是气 体,其他都为液体,三氯甲烷俗称氯仿。
• 1•甲烷的存在与用途(1)甲烷的存在甲烷是天然气、沼气、油田气和煤矿坑道气的主 要成分。
我国的天然气主要分布在中西部地区及海底。
(2)甲烷的主要用途以甲烷 为主要成分的天然气和沼气都是理想的清洁能源。
甲烷还可用作化工原料。
归纳总 结:甲烷分子空间构型为正四面体形,碳原子位于中心,4个氢原子位于顶点,4 个C-H 键的思维启迪一个碳原子以4个单键与其他原子相结合时:①如果这4 个原子相同,则分别在四面体的顶点上,构成正四面体。
②如果这4个原子不相 同,则分别在四面体的顶点上,但不是正四面体。
③无论这4个原子是否相同,都 不可能在同一平面上,并且最多有3个原子共面。
甲烷⑴结构式:b 、球棍模型:、比例模型:・甲烷与氯气等卤素单质反应的注意事项:1 .反应条件为光照,在室溫或暗处不发生反应,但不能用强光直接照射,以免引起爆炸。
2 .甲烷与溟蒸气、碘蒸气等纯卤素也能发生类似反应,但不能与漠水、碘水发生反应。
3.甲烷与氯气的反应是一种连锁反应,不会停留在某一步,因此产物一般是五种物质的混合物。
4 . CH4与CI2在光照条件反应,生成物中HCI的物质的量最多。
5 . lmol有机物CxHy与CI2发生完全取代反应时,消耗CI2的物质的量为ymol o原子共面的判断方法:判断有机物分子中的原子是否共面,首先要熟悉常见的分子构型。
甲烷的结构与性质
高考频度:★★☆☆☆难易程度:★★☆☆☆
典例在线
下列有关甲烷的取代反应的叙述正确的是
A.甲烷与氯气的物质的量之比为1∶1,混合发生取代反应只生成CH3Cl
B.甲烷与氯气的取代反应,生成的产物中CH3Cl最多
C.甲烷与氯气的取代反应生成的产物为混合物
D.1 mol甲烷生成CCl4最多消耗2 mol氯气
【参考答案】C
【试题解析】甲烷与氯气一旦发生取代反应就不会停止在某一步,四种有机物都会产生,故得不到纯净的CH3Cl,A错误,C正确;甲烷与氯气的反应中每取代1 mol氢原子,消耗1 mol 氯气,生成1 mol HCl,故产物中HCl最多,B错误;1 mol甲烷生成CCl4最多消耗4 mol氯气,D错误。
解题必备
(1)点燃甲烷前,必须检验其纯度。
(2)甲烷与氯气发生取代反应的特点:①反应条件为光照,在室温或暗处,二者均不发生反应,也不能用阳光直射,否则会发生爆炸;②反应物必须用卤素单质,甲烷与卤素单质的水溶液不反应;③该反应是连锁反应,即第一步反应一旦开始,后续反应立即进行,因此产物是五种物质的混合物,其中HCl的量最多;④1 mol氢原子被取代,消耗1 mol Cl2,同时生成1 mol HCl,即参加反应的Cl有一半进入有机产物中,另一半进入HCl。
(3)存在和用途
①甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分。
②天然气是一种高效、低耗、污染小的清洁能源,还是一种重要的化工原料。
甲烷在光照条件下与氯气反应生成的4种取代产物的比较:
分子结构CCl4是正四面体,其他均为四面体但不是正四面体
俗名CHCl3:氯仿,CCl4:四氯化碳
状态常温下,CH3Cl是气体,其他均为液体
溶解性均不溶于水,CHCl3和CCl4是工业上重要的溶剂
密度CH3Cl比水轻,其他均比水重
学霸推荐
1.下列关于甲烷的叙述正确的是
A.甲烷分子的立体构型是正四面体,所以,CH2Cl2有两种不同构型
B.甲烷可以与氯气发生取代反应,因此,可以使氯水褪色
C.甲烷能够燃烧,在一定条件下会发生爆炸,因此,是矿井安全的重要威胁之一
D.甲烷能使酸性KMnO4溶液褪色
2.一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6 g,当其缓慢经过无水CaCl2时,CaCl2增重25.2 g,则原混合气体中CO2的质量为
A.12.5 g B.13.2 g C.19.7 g D.24.4 g
3.利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。
某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如图所示:
(1)A中制取Cl2的反应的化学方程式是。
(2)B装置的作用:①;②;③。
(3)D装置中的石棉上吸附着潮湿的KI,其作用
是。
(4)E装置的作用是 (填序号)。
A.收集气体B.吸收氯气C.吸
收氯化氢
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是。
(6)将1 mol CH4与Cl2发生取代反应,测得4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是。
答案
1.【答案】C
【解析】A项,由于甲烷是正四面体结构,四个顶点中任意两个氢原子都是相邻关系,故CH2Cl2只有一种构型。
B项,CH4只能跟氯气在光照下反应,与氯水不反应。
D项,CH4比较稳定,不能被酸性KMnO4溶液氧化。
2.【答案】B
【解析】CaCl2增重25.2 g为水的质量,n(H2O)==1.4 mol ,根据氢元素守恒得:n(CH4)=0.7 mol。
设CO2、CO的物质的量分别为x、y。
解得:
m(CO2) = 0.3 mol ×44 g·mol−1 =13.2 g
3.【答案】(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)控制气流速度使气体混合均匀干燥气体
(3)除去过量的Cl2(4)C (5)分液(6)2.5 mol
【解析】(1)MnO2能与HCl(浓)发生氧化还原反应生成MnCl2和Cl2。
(2)制备的氯气中含有水蒸气,可用浓硫酸除去,B装置的作用是干燥气体、使气体混合均匀、通过观察气泡来控制气流速度。
(3)氯气能将碘化钾氧化为碘单质,湿润的KI可除去过量的氯气。
(4)E装置用来吸收产生的HCl,并防止倒吸现象的发生。
(5)E装置中除了有盐酸生成外,还含有二氯甲烷、三氯甲烷和四氯化碳,二氯甲烷、三氯甲烷和四氯化碳不溶于水,能分层,可通过分液分开。
(6)1 mol CH4生成等物质的量的4种取代产物,即0.25 mol CH3Cl、0.25 mol CH2Cl2、0.25 mol CHCl3、0.25 mol CCl4,则所需n(Cl2)=0.25 mol×1+0.25 mol×2+0.25 mol×3+0.25 mol×4=2.5 mol。
炉火纯青
人们很早就知道从燃烧火焰的颜色来判断火焰的温度。
炉火温度在600 ℃左右时,火焰呈
暗红色;升到700 ℃时,火焰变为深红色;再上升到1 000 ℃左右时,火焰颜色变为橘红色,也就是俗称的“炉火通红”;1 200 ℃时,火焰发亮,变为金橘色;继续升温到接近1 500 ℃时,呈白热化;如果超过1 500 ℃,火焰颜色由白转蓝,这就是“炉火纯青”了。
如胶似漆
早在三千多年前的中国,人们就用动物皮、角、骨来熬制骨胶、牛皮胶等,用来黏合各种
物件,这就是最早的化学黏合剂。
相传举世闻名的万里长城也是用石灰、糯米糊等混合调配的黏合剂把无数的石块黏接起来而建成的,这种无机-有机混合胶强度高、防腐蚀、经久不坏。
随着高分子材料技术的日新月异,如今的黏合剂几乎可以黏合任何物质,从日常用品到航天飞
机,黏合剂都是必不可少的。