第8章 气体动理论
- 格式:ppt
- 大小:1.24 MB
- 文档页数:68


第十三章 气体动理论本章从理想气体的微观组成出发,假以统计性假设,推出理想气体的压强和温度公式,揭示了压强和温度的本质;提出了理想气体内能的概念,介绍了理想气体能量按自由度均分原理;阐述了理想气体的麦克斯韦速率分布率。
这称为气体动理论。
气体动理论的产生和发展凝聚了众多物理学家的智慧和心血。
早在1678年,胡克就提出了气体压强是由大量气体分子与器壁碰撞的结果的观点。
之后,在1738年,伯努利根据这一观点推导出压强公式,并且解释了玻意耳定律。
1744年,俄国的罗蒙诺索夫提出了热是分子运动表现的观点。
在19世纪中叶,气体动理论经克劳修斯、麦克斯韦和玻耳兹曼的努力而有了重大发展。
1858年,克劳修斯提出气体分子平均自由程的概念并导出相关公式。
1860年,麦克斯韦指出,气体分子的频繁碰撞并未使它们的速度趋于一致,而是达到稳定的分布,导出了平衡态气体分子的速率分布和速度分布。
之后,麦克斯韦又建立了输运过程的数学理论。
1868年,玻耳兹曼在麦克斯韦气体分子速率分布律中又引进重力场。
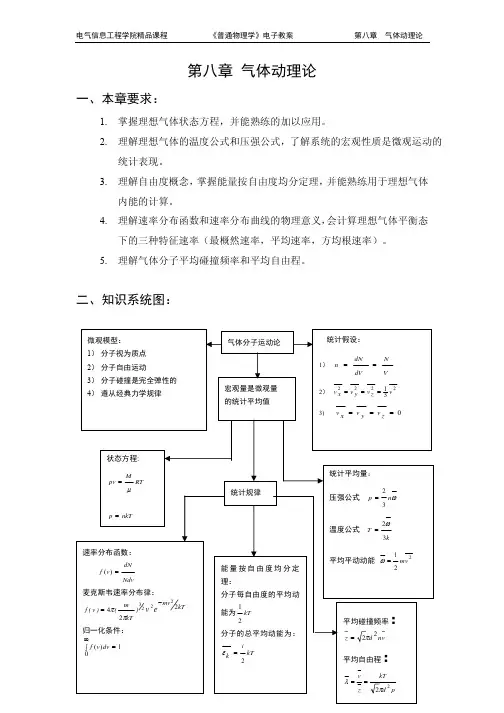
第一节理想气体状态方程一、状态参量1.状态参量概念如何描述系统的冷热变化规律,这就需要一些物理量。
假设气体的质量为 m ,其宏观状态一般可以用气体的压强p 、体积V 和温度T 三个物理量来描述。
如果在热力学过程中伴随着化学反应,还需要物质的量、摩尔质量 、物质各组分的质量等物理量来描述。
如果热力学系统处于磁场中,还需要电场强度E 、电极化矢量P 、磁场强度H 和磁化强度M 等物理量来描述。
选择几个描写系统状态的参量,称为状态参量。
2.状态参量分类按照不同的划分标准,状态参量可作如下划分:(1)按状态参量描写系统的性质划分可分为:V P E P H M几何参量:描述系统的空间广延性。
如体积 。
力学参量:描述系统的强度。
如压强 。
化学参量:描述系统的化学组分。
如各组分的质量,物质的量。
电磁参量:描述系统的电磁性质。
如电场强度 ,电极化强度 ,磁场强度 ,磁化强度 。

气体动理论(kinetic theory of gases)是19世纪中叶建立的以气体热现象为主要研究对象的经典微观统计理论。
气体由大量分子组成,分子作无规则的热运动,分子间存在作用力,分子的运动遵循经典的牛顿力学。
根据上述微观模型,采用统计平均的方法来考察大量分子的集体行为,为气体的宏观热学性质和规律,如压强、温度、状态方程、内能、比热以及输运过程(扩散、热传导、黏滞性)等提供定量的微观解释。
气体动理论揭示了气体宏观热学性质和过程的微观本质,推导出宏观规律,给出了宏观量与微观量平均值的关系。
它的成功印证了微观模型和统计方法的正确性,使人们对气体分子的集体运动和相互作用有了清晰的物理图像,标志着物理学的研究第一次达到了分子水平。

《大学物理》第8章气体动理论练习题及答案练习1一、选择题1. 在一密闭容器中,储有A、B、C三种理想气体,处于平衡状态。
A种气体的分子数密度为n1,它产生的压强为p1,B种气体的分子数密度为2n1,C种气体的分子数密度为3n1,则混合气体的压强p为( )A. 3p1;B. 4p1;C. 5p1;D. 6p1.2. 若理想气体的体积为V,压强为p,温度为T,一个分子的质量为m,k为玻尔兹曼常量,R为普适气体常量,则该理想气体的分子数为( )A. pVm⁄; B. pVkT⁄; C. pV RT⁄; D. pV mT⁄。
3. 一定量某理想气体按pV2=恒量的规律膨胀,则膨胀后理想气体的温度( )A. 将升高;B. 将降低;C. 不变;D. 升高还是降低,不能确定。
二、填空题1. 解释下列分子动理论与热力学名词:(1) 状态参量:;(2) 微观量:;(3) 宏观量:。
2. 在推导理想气体压强公式中,体现统计意义的两条假设是:(1) ;(2) 。
练习2一、选择题1. 一个容器内贮有1摩尔氢气和1摩尔氦气,若两种气体各自对器壁产生的压强分别为p 1和p 2,则两者的大小关系是 ( )A. p 1>p 2;B. p 1<p 2;C. p 1=p 2;D. 不能确定。
2. 两瓶不同种类的理想气体,它们的温度和压强都相同,但体积不同,则单位体积内的气体分子数为n ,单位体积内的气体分子的总平动动能为E k V ⁄,单位体积内的气体质量为ρ,分别有如下关系 ( )A. n 不同,E k V ⁄不同,ρ不同;B. n 不同,E k V ⁄不同,ρ相同;C. n 相同,E k V ⁄相同,ρ不同;D. n 相同,E k V ⁄相同,ρ相同。
3. 有容积不同的A 、B 两个容器,A 中装有刚体单原子分子理想气体,B 中装有刚体双原子分子理想气体,若两种气体的压强相同,那么,这两种气体的单位体积的内能E A 和E B 的关系( )A. E A <E B ;B. E A >E B ;C. E A =E B ;D.不能确定。

气体分子动理论气体是物质存在的其中一种形态,它的分子运动对于我们理解气体的性质至关重要。
气体分子动理论是一种描述气体性质的科学理论,它通过解释气体分子的运动行为和碰撞规律,为我们提供了对气体行为的深入认识。
1. 分子运动的基本规律气体分子的运动有其基本规律,其中最重要的是玻尔兹曼分布规律。
根据玻尔兹曼分布规律,气体分子的速度分布服从高斯分布,即呈现一个钟形曲线。
这意味着气体分子的速度有一定的平均值,同时也存在一定的速度分散。
这种分布规律的存在,决定了气体的宏观性质,如压强、温度等。
2. 碰撞与压强气体分子之间的碰撞是气体压强产生的主要原因。
当气体分子运动速度较慢,分子之间碰撞不频繁时,气体的压强较低。
相反,当气体分子运动速度较快,分子之间碰撞频繁时,气体的压强较高。
根据气体分子动理论,气体压强与温度呈正相关,其数学关系为压强和温度的乘积与分子间平均速度的平方成正比。
3. 温度与分子速度气体分子运动的速度与气体的温度有着密切的关系。
根据气体分子动理论,气体温度与分子平均动能成正比。
换句话说,温度越高,气体分子的平均动能越大,分子的平均速度也会增加。
这也解释了为什么在相同温度下,不同气体的分子速度可能不同的原因。
例如,氢气分子较轻,根据等温分子速度公式,它的速度较大;而氮气分子较重,其速度相对较低。
4. 分子扩散与扩散速率分子扩散是气体分子运动的另一个重要现象。
根据气体分子动理论,气体分子会自发地从高浓度区域向低浓度区域扩散。
扩散速率受到多种因素的影响,如温度、分子间相互作用力以及分子质量等。
高温下的气体分子动能较大,扩散速率较快;而分子间的相互作用力越大,扩散速率越慢。
5. 分子间相互作用力气体分子间存在一定的相互作用力,这种作用力对气体性质有着重要影响。
分子间相互作用力可以分为吸引力和斥力。
对于吸引力较大的气体分子,它们的运动速度相对较慢,而分子间距离较小。
这种相互作用力称为范德华力。
相反,当气体分子间的斥力较大时,其运动速度较快,分子间距离较大,这种相互作用力被称为排斥力。




大学物理2-1第八章(气体动理论)习题答案第8 章8-1 目前可获得的极限真空为1.33?10?11Pa,,求此真空度下1cm3体积内有多少个分子?(设温度为27℃)[解] 由理想气体状态方程P?nkT得P?故N?NVkT,N??11PVkT?300 ?61.33?10?1?101.38?10?23?3.21?10(个) 38-2 使一定质量的理想气体的状态按p?V图中的曲线沿箭头所示的方向发生变化,图线的BC段是以横轴和纵轴为渐近线的双曲线。
(1)已知气体在状态A时的温度是TA?300K,求气体在B、C、D时的温度。
(2)将上述状态变化过程在V?T图(T为横轴)中画出来,并标出状态变化的方向。
[解] (1)由理想气体状态方程PV/T=恒量,可得:由A→B这一等压过程中VATAVBVA?VBTB2010 则TB??TA??300?600 (K)因BC段为等轴双曲线,所以B→C为等温过程,则TC?TB?600 (K)C→D为等压过程,则VDTD?VCTCTD?VDVC?TC?2040?600?300 (K)(2)403020100)8-3 有容积为V的容器,中间用隔板分成体积相等的两部分,两部分分别装有质量为m的分子N1 和N2个, 它们的方均根速率都是?0,求:(1)两部分的分子数密度和压强各是多少?(2)取出隔板平衡后最终的分子数密度和压强是多少?[解] (1) 分子数密度n1?N1V1?2N1V8-1 n2?N2V2?2N2V由压强公式:P?13nmV2,132mN1V03VNV?2可得两部分气体的压强为P1?n1mV0?2P2?13n2mV0?22mN2V03V2(2) 取出隔板达到平衡后,气体分子数密度为n?N1?N2V混合后的气体,由于温度和摩尔质量不变,所以方均根速率不变,于是压强为:P?13nmV0?2(N1?N2)mV03V28-4 在容积为2.5?10?3m3的容器中,储有1?1015个氧分子,4?1015个氮分子,3.3?10?7g氢分子混合气体,试求混合气体在433K 时的压强。
第四章气体动理论一、基本要求1. 理解理想气体微观模型。
理解理想气体压强、温度的概念及其微观本质。
掌握理想气体压强、温度的公式并会做相应计算。
通过推导气体压强公式,了解气体动理论的基本研究思想和方法。
2. 理解能量均分定理,掌握理想气体内能的概念、公式及有关计算。
3. 了解麦克斯韦速率分布律、速率分布函数和速率分布曲线的物理意义,了解气体分子热运动三种统计速率。
4. 了解玻耳兹曼能量分布律。
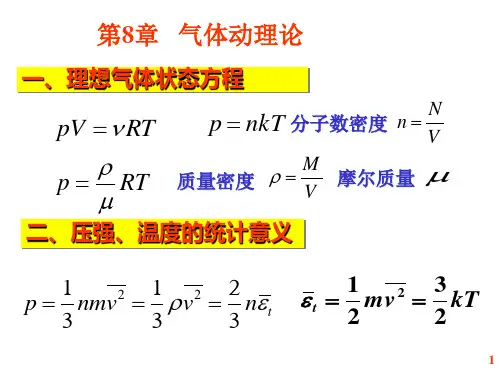
二、内容概要(一)统计概念1.理想气体压强(1)压强概念 垂直作用于器壁单位面积上的压力。
(2)压强公式 p=n 32ε=231_v nm 为分子平均平动动能。
(4-1) (3)适用条件 理想气体(大量分子组成),处于平衡态。
(4)微观本质①由大量气体分子对器壁的碰撞所产生,表示单位时间内气体分子作用于器壁单位面积上的平均冲量。
②一定温度的平衡态下,单位体积内的气体分子数(分子数密度n)越多,或分子平均平动动能(-ε)越大,压强就越高。
-n 、-ε为气体分子微观量的统计平均值。
2. 理想气体温度(1) 温度概念 表征系统处于热平衡态的物理量。
(2) 温度公式 -ε=kT 23 (3) 适用条件 理想气体(由大量分子组成)处于平衡态。
(4) 微观本质 反映了大量分子热运动的剧烈程度,是分子平均平动动能的量度。
(二)统计规律1. 能量均分定理(1) 内容要点物质分子每个自由度的平均动能kT 21 每个分子的平均动能 -k ε=kT i 2vmol 理想气体内能 E=v RT i 2 气体自由度 i=()()()⎪⎩⎪⎨⎧刚性多原子分子刚性双原子分子单原子分子653(2) 适用条件. 式 (4-2) (4-3)----任何物质分子,温度为 T 的平衡态。
式 (4-4)----理想气体,温度为 T (室温附近)的平衡态。
2. 麦克斯韦速率分布律(1) 气体速率分布函数f(v)=Ndv dN (4-6) 表示速率v 在附近单位速率区间内的分子分布概率(即分子数占总分子数的比率)。
气体动理论知识点总结气体动理论是研究气体的微观运动状态及宏观性质的一门物理学理论,是现代物理学中较为重要的分支之一。
气体动理论不仅对实际问题的探究有着重要的作用,它的理论体系及方法也为其他学科提供了有力的支持。
下面将围绕着气体运动状态、气体的性质以及气体的热力学定律三个方面,介绍气体动理论中的相关知识点。
一、气体运动状态气体动理论认为,气体分子的运动状态决定了气体的宏观控制状态。
因此,研究气体分子的运动状态对于了解气体的性质及可控性具有重要的意义。
1.分子移动气体分子无序地、自由地运动,并且分子的速度是高度非一致性的。
分子的速度与温度、分子的种类有关。
分子受温度影响,速度随温度的升高而增加。
2.分子运动轨迹气体分子在空间中做无规则运动,但可以将其平均运动速度视为直线运动。
分子的运动具有随机性,在时间、位置上无法精确定位。
3.分子碰撞气体分子之间存在碰撞,碰撞时能量和动量都会发生变化,同时碰撞前和碰撞后分子的速度方向也会发生改变。
二、气体的性质气体的性质不仅涉及气体的物理状态,还涉及气体的化学性质,气体与其他物质的相互作用,气体的电学性质等方面,其中,最为重要的性质包括以下几个方面:1.流动性:气体具有流动性,能够流动并具有一定的流动性质。
2.扩散性:气体分子具有无序运动状态,具有自由的运动方式。
在一定条件下,气体分子能够通过物质间的空隙扩散到其他区域。
3.压缩性:气体分子间的间隔较大,气体分子之间的相互作用力较弱,分子之间可以变形并发生相对位移,气体具有较好的压缩性。
4.热膨胀性:在一定温度下,气体分子具有较大的运动能,随着温度的升高,气体分子之间的反向作用力会减小,会引起体积的增加。
5.气体的状态方程:气体在不同温度下具有不同的压强、体积关系,可以利用理想气体状态方程(P V/ nRT)来描述气体的状态。
三、气体的热力学定律气体动理论依据物理实验,建立了气体的热力学学说体系,包括状态方程、热力学过程、热力学定律等。