化学反应速率与化学平衡——图像专题[新课]
- 格式:pptx
- 大小:1.24 MB
- 文档页数:52





![化学反应速率与化学平衡—图像专题[新课]](https://img.taocdn.com/s1/m/8b170d7a8e9951e79b892775.png)

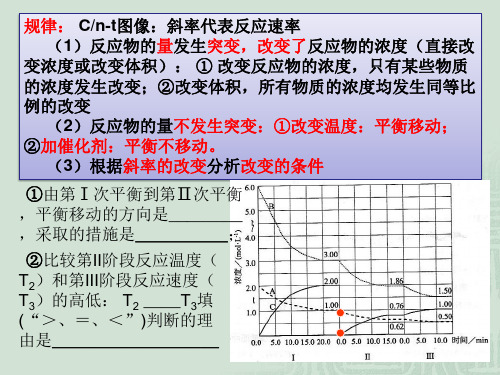
化学反应速率、化学平衡图像专题练习一、ν-t图像或c-t图像1. ν-t图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。
【练习1】对于反应2SO2(g)+O2(g) 2SO3(g) △H<0,填写改变的条件及平衡移动的方向。
t1时,,平衡向移动。
t2时,,平衡向移动。
t3时,,平衡向移动。
t4时,,平衡向移动。
小结:改变条件,图像一点保持连续;改变,两点突变,_____________使正逆反应速率同等程度的增大而平衡不移动。
【练习3】在密闭容器,一定条件下进行反应,mA(g)+nB(g) pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,变化过程均如右图所示,则对该反应叙述正确的是( )A.正反应是吸热反应B.逆反应是吸热反应C.m+n>p+q D.m+n<p+q2. c-t图像:分清反应物和生成物,浓度减小的为反应物,浓度增大的为生成物,分清消耗浓度和增加浓度,反应物的消耗浓度和生成物的增加浓度之比,等于化学方程式中各物质的化学计量数之比。
【练习5】今有X(g)+Y(g) 2Z(g) △H<0。
从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是( )A.增大X或Y的浓度B.增大压强C.增大Z的浓度D.升高温度【练习6】右图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间。
试回答:(1)该反应的反应物是______;(2)反应物的转化率是______;(3)该反应的化学方程式为___________________________。
二、平衡图像1.出现拐点的图像:分析依据“先拐先平”。
在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂)。
【练习7】已知某可逆反应在密闭容器中进行:A(g)+2B(g) 3C(g)+D(s) △H<0,图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )A.增大A的浓度B.缩小容器的容积C.加入催化剂D.升高温度【练习8】现有可逆反应A(g)+2B(g) nC(g) △H<0,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如右图,其中结论正确的是( )A.p1>p2,n>3 B.p1<p2,n>3C.p1<p2,n<3 D.p1>p2,n=3【练习10】可逆反应:aA(g)+ bB(g)cC(g)+ dD(g)根据图回答:①压强P1比P2(填大或小);②(a +b)比(c +d)(填大或小);③温度t1℃比t2℃(填高或低);④正反应热(填吸或放)。


化学反应速率和平衡图像一、回顾1.影响化学反应速率的外界因素2.影响化学平衡的外界因素二、内容1.速率—时间图解法识记:1.增加反应物浓度,v正跳上得更大;减小反应物浓度,v正跳下得更大2.增加生成物浓度,v逆跳上得更大;减小生成物浓度,v逆跳下得更大3.升高温度,吸热方向跳上得更大;降底温度,吸热方向跳下得更大4.增大压强,计量数减小方向跳上得更大;减小压强,计量数减小方向跳下得更大若v正在v逆的上方,即平衡向正反应方向移动;若v逆在v正的上方,即平衡向逆反应方向移动。
2.浓度(或物质的量)—时间图1.可逆反应a X(g)+b Y(g) c Z(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)—时间(t)图象如图,则下列说法中正确的是()A.若a+b=c,则t0时只能是增大了容器的压强B.若a+b=c,则t0时只能是加入了催化剂C.若a+b≠c,则t0时只能是增大了容器的压强D.若a+b≠c,则t0时只能是加入了催化剂【典例2】(2013·成都模拟)可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。
1)根据图1请写出合成氨的热化学方程式______________________________________(热量用E1、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的___________条件,该条件的改变与图2中哪一时刻条件的改变相同_________(用“t1…t6”表示)。
(3)图2中t3时刻改变的条件是_______________,t5时刻改变的条件是___________。
答案:(1)N2(g)+3H2(g) 2NH3(g)ΔH=-2(E3-E1)kJ·mol-1(2)催化剂t2…t3 (3)减小压强升高温度。

化学反应速率和平衡图像专题(2课时)导学案 学习目标:1、了解图像的一般解题方法 2、了解图像题的解题原则 3、会分析图像各部分的含义 重点:速率、平衡图像的解法 一、 化学反应速率图象1.c/n-t 图象看右图:写反应方程式0.51.51.02.0物质的量C A B时间2.V-t 图象改变了什么条件,使平衡发生发生了移动?平衡往哪方向移动了?V 正V 逆V'正V'逆VtV 正V 逆V'正V'逆tV看图:说出反应起始时是从正反应,还是从逆反应开始?然后是改变什么条件?化学平衡向什么方向移动?V 正V 逆看图:说出反应起始时是从正反应;还是从逆反应开始?化学平衡向什么方向移动?是吸热反应还是放热反应?VT (温度)转化率温度1.01⨯107Pa1.01⨯106Pa 1.01⨯105Pa二.化学平衡图象1.转化率——压强/温度曲线TmA(g)+nB(g) pC(g)+qD (g) ΔH=Q等温线【问题】该反应是放热反应还是吸热反应?是扩体反应还是缩体反应? 200︒C300︒C 100︒CP等压线压强0A%2.物质百分含量——压强/温度曲线mA(g)+nB(g) pC(g)+qD (g) ΔH=Q3.物质百分含量——时间曲线T 1︒CT 2︒C C%时间t 1t 2mA(g)+nB(g) pC(g)+qD (g) ΔH=Q 1、T1与T2的高低2、是放热反应还是吸热反应问题4.转化率——时间曲线1.01⨯107Pa1.01⨯106PaA 的转化率时间t 1t 2mA(g)+nB(g) pC(g)+qD (g) ΔH=Q问题:m+n<p+p 还是m+n>p+p4.转化率——时间曲线mA(g)+nB(g) pC(g)+qD(g)1.01⨯107Pa1.01⨯106PaA 转化率时间是等体反应还是非等体反应?如图所示,图中a 曲线表示X(g) +Y(g) 2Z(g)+ W(s) ΔH>0的反应过程,若使a 曲线变为b 曲线,可采取的措施是()Z%tabA. 加入催化剂B. 增大Y 的浓度C. 降低温度D. 增大体系压强【针对训练】1、下图是在其它条件一定时,反应2NO+O 22NO 2+ Q (Q>0)中NO 的最大转化率与温度的关系曲线。