各器官组织切片
- 格式:ppt
- 大小:13.49 MB
- 文档页数:48


【关键字】指导实验一局部血液循环障碍一、〔实验目的〕通过组织切片观察,认识﹑掌握器官组织发生充血、淤血、出血、梗死等病理变化的形态学变化特征,了解其发生原因、机制﹑结局和意义。
二、〔实验材料〕充血、淤血及出血的组织切片三、〔实验内容、方法和步骤〕大体标本充血1. 肺淤血:多见于左心机能不全。
静脉回流受阻,肺体积增大,被膜紧张,色紫红,质地较坚实,切面流出多量暗红色血液。
淤血较久时,则易发生肺水肿,此时肺切面流出多量带泡沫的血样液体。
肺间质增宽,富含水分。
肺组织块投入水中如载重舟。
2. 肝淤血:常见于右心衰竭。
淤血时体积增大,边缘钝圆,色暗紫红色,切面流出多量暗紫红色血液,淤血较久时,小叶中央部充血呈暗红色,小叶边缘则肿胀或脂变呈黄褐色,形成暗红色与黄褐色相间的斑纹,类似中药槟榔的断面故称“槟榔肝”。
3肠淤血:肠壁静脉扩大增粗,充满暗红色血液,形似树枝状。
出血1. 猪肾点状出血:肾表面及切面上有多数针尖至菜籽大小的出血小点。
此标本取至猪瘟病。
2. 心内膜斑状出血:心室内膜下出现黑红色斑点,称淤斑。
3. 马肝被膜下血肿:肝被膜下与实质之间有大的凝固血块,周围结缔组织增生形成包裹。
血肿周围实质受压贫血,呈淡黄褐色。
4. 血管破裂性出血:乳牛产后子宫中动脉破裂出血,患畜死于失血过多。
此标本示血管破裂处。
5. 线状出血:肠粘膜皱壁的顶端出血,呈暗红色的线条,称线状出血。
6. 出血性子宫炎:子宫内膜弥漫性出血,呈暗紫红色。
血栓形成1. 牛肺静脉红色血栓:肺内扩大的静脉内有一血块,其中心红色,边缘淡黄,(这是因形成时间较久,边缘血红蛋白崩解之故)因发生血栓软化,血管与血栓界线不清。
2. 猪心瓣膜上白色血栓:二尖瓣向血流面有一干燥灰白赘生物附着,表面粗糙不平,呈椰菜花样外观。
瓣膜变形、缺损。
此标本取自慢性猪丹毒患猪。
4. 动脉内白色血栓:马前肠系膜动脉根部管腔扩大,管壁肥厚,内膜粗糙不平,内膜上附着干燥灰白片状血栓物质。

组织病理切片的制作流程1.取材组织取材的方法是制作切片的一个重要程序,根据教学、科研及外检的具体要求取自人体(外科手术切除标本、活检标本、尸检标本)或动物,并确定取材的部位和方法。
取材者需要掌握解剖学、组织学、病理学的基本理论知识,还要掌握实际操作技术,每个组织器官的取材都有一定的部位和方法,不能任意切取组织作为制片材料,不然,无法达到教学、科研和临床诊断的目的,具体要求如下:(1)材料新鲜:取材组织愈新鲜愈好,人体组织一般在离体后,动物组织在处死后迅速固定,以保证原有的形态学结构。
(2)组织块的大小:所取组织块较理想的体积为2.0cm×2.0cm×0.3cm,以使固定液能迅速而均匀地渗入组织内部,但根据制片材料和目的不同,组织块的较理想体积也不同,如制作病理外检、科研切片,其组织块可以薄取0.1~0.2cm即可,这样可以缩短固定脱水透明的时间,若制作教学切片厚取0.3 ~0.5cm,这样可以同一蜡块制作出较多的教学切片。
(3)勿挤压组织块: 切取组织块用的刀剪要锋利,切割时不可来回锉动。
夹取组织时切勿过紧,以免因挤压而使组织、细胞变形。
(4)规范取材部位: 要准确地按解剖部位取材,病理标本取材按照各病变部位、性质的不同,根据要求规范化取材。
(5)选好组织块的切面:根据各器官的组织结构,决定其切面的走向。
纵切或横切往往是显示组织形态结构的关键,如长管状器官以横切为好。
(6)保持材料的清洁:组织块上如有血液、污物、粘液、食物、粪便等,可用水冲洗干净后再放入固定液中。
(7)保持组织的原有形态:新鲜组织固定后,或多或少会产生收缩现象,有时甚至完全变形。
为此可将组织展平,以尽可能维持原形。
2.固定(1)小块组织固定法:这是最常用的方法,从人体或动物体取下的小块组织,须立即置入液态固定剂中进行固定,通常,标本和固定液的比例为1:4~20,但组织块不宜过大过厚,否则固定液不能迅速渗透。
故取组织块的大小一般为2.0cm×2.0cm×0.3cm。

组织病理切片的制作流程1.取材组织取材的方法是制作切片的一个重要程序,根据教学、科研及外检的具体要求取自人体(外科手术切除标本、活检标本、尸检标本)或动物,并确定取材的部位和方法。
取材者需要掌握解剖学、组织学、病理学的基本理论知识,还要掌握实际操作技术,每个组织器官的取材都有一定的部位和方法,不能任意切取组织作为制片材料,不然,无法达到教学、科研和临床诊断的目的,具体要求如下:(1)材料新鲜:取材组织愈新鲜愈好,人体组织一般在离体后,动物组织在处死后迅速固定,以保证原有的形态学结构。
(2)组织块的大小:所取组织块较理想的体积为2.0cm×2.0cm×0.3cm,以使固定液能迅速而均匀地渗入组织内部,但根据制片材料和目的不同,组织块的较理想体积也不同,如制作病理外检、科研切片,其组织块可以薄取0.1~0.2cm即可,这样可以缩短固定脱水透明的时间,若制作教学切片厚取0.3 ~0.5cm,这样可以同一蜡块制作出较多的教学切片。
(3)勿挤压组织块: 切取组织块用的刀剪要锋利,切割时不可来回锉动。
夹取组织时切勿过紧,以免因挤压而使组织、细胞变形。
(4)规范取材部位: 要准确地按解剖部位取材,病理标本取材按照各病变部位、性质的不同,根据要求规范化取材。
(5)选好组织块的切面:根据各器官的组织结构,决定其切面的走向。
纵切或横切往往是显示组织形态结构的关键,如长管状器官以横切为好。
(6)保持材料的清洁:组织块上如有血液、污物、粘液、食物、粪便等,可用水冲洗干净后再放入固定液中。
(7)保持组织的原有形态:新鲜组织固定后,或多或少会产生收缩现象,有时甚至完全变形。
为此可将组织展平,以尽可能维持原形。
2.固定(1)小块组织固定法:这是最常用的方法,从人体或动物体取下的小块组织,须立即置入液态固定剂中进行固定,通常,标本与固定液的比例为1:4~20,但组织块不宜过大过厚,否则固定液不能迅速渗透。
故取组织块的大小一般为2.0cm×2.0cm×0.3cm。
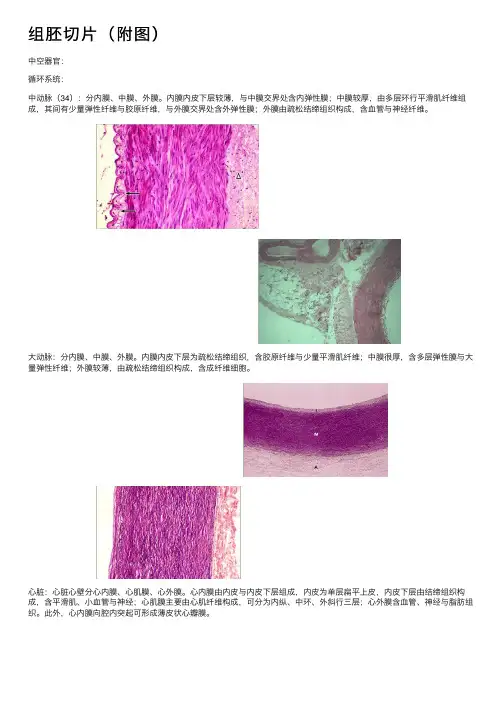
组胚切⽚(附图)中空器官:循环系统:中动脉(34):分内膜、中膜、外膜。
内膜内⽪下层较薄,与中膜交界处含内弹性膜;中膜较厚,由多层环⾏平滑肌纤维组成,其间有少量弹性纤维与胶原纤维,与外膜交界处含外弹性膜;外膜由疏松结缔组织构成,含⾎管与神经纤维。
⼤动脉:分内膜、中膜、外膜。
内膜内⽪下层为疏松结缔组织,含胶原纤维与少量平滑肌纤维;中膜很厚,含多层弹性膜与⼤量弹性纤维;外膜较薄,由疏松结缔组织构成,含成纤维细胞。
⼼脏:⼼脏⼼壁分⼼内膜、⼼肌膜、⼼外膜。
⼼内膜由内⽪与内⽪下层组成,内⽪为单层扁平上⽪,内⽪下层由结缔组织构成,含平滑肌、⼩⾎管与神经;⼼肌膜主要由⼼肌纤维构成,可分为内纵、中环、外斜⾏三层;⼼外膜含⾎管、神经与脂肪组织。
此外,⼼内膜向腔内突起可形成薄⽪状⼼瓣膜。
消化管:⾷管(47):⾷管分为粘膜层,粘膜下层,肌层和外膜。
粘膜层包括上⽪、固有层和粘膜肌层。
上⽪为较厚的未⾓化的复层扁平上⽪,在⾷管与胃贲门交界处,复层扁平上⽪突然变成单层柱状上⽪;固有层为致密结缔组织,内有⾷管腺导管;粘膜肌层由纵⾏肌组成。
粘膜下层为厚的疏松结缔组织构成,内含⾷管腺。
粘膜和粘膜下层形成皱襞。
肌层上1/3段为⾻骼肌,下1/3为平滑肌,中段为⾻骼肌和平滑肌混合组成。
其肌纤维的排列为内环形和外纵形两层。
外膜由疏松的纤维组织构成,含有较⼤的⾎管、淋巴管和神经。
胃(48):胃壁分为粘膜层,粘膜下层,肌层和外膜。
粘膜层包括上⽪、固有层和粘膜肌层。
上⽪是单层柱状上⽪,上⽪细胞是表⾯粘液细胞,细胞染⾊浅,呈空泡状。
固有层为细密的结缔组织,内含有⼤量的胃底腺。
胃底腺位于胃⼩凹和粘膜肌之间,是单管状腺,腺腔⼩,主要由壁细胞和主细胞组成。
粘膜肌层为平滑肌。
粘膜下层为疏松结缔组织,内含有⼩⾎管,⼩的神经束。
肌层为平滑肌,分内斜、中环、外纵三层。
外膜为浆膜,⼀层结缔组织,最外⾯有⼀层单层扁平上⽪覆盖(间⽪),内可有脂肪组织,神经束,⾎管等。

组织学与胚胎学标本考核名称:骨骼肌光镜下结构特点:纵切面:肌纤维呈带状/长圆柱状;细胞核多个,长椭圆形/杆状,紧贴在肌膜下方;肌纤维上有明暗相间的横纹。
横切面:肌纤维为不规则形或圆形,细胞核1~数个,呈点状,位于周边。
名称:心肌光镜下结构特点:(心脏的心肌纤维排列方向较复杂,在切片中同时看到各种切面。
)纵切面:心肌纤维呈短柱状,有分支相连成网。
细胞核卵圆形,位于中央。
心肌纤维有横纹,但不如骨骼肌明显。
在心肌纤维不定距离上/连接处有染色较深的线条,即为闰盘。
横切面:心肌纤维呈圆形或不规则形,大小不一,细胞核位于中央,有的未切到核。
名称:脊髓(神经元)光镜下结构特点:在前角内可见多极神经元胞体大、形态不规则,胞体发出的突起常被切断。
细胞核位于胞体中央,大而圆形,染色淡,核仁明显。
胞质紫红色,胞质内可见许多大小不等的紫蓝色小块,即尼氏体。
树突内有尼氏体,轴突及轴丘无。
名称:中动脉和中静脉光镜下结构特点:(一)中动脉以内、外弹性膜为界区分内膜、中膜和外膜三层1.内膜很薄,内皮细胞核突向管腔。
(内皮下层为极薄的结缔组织,不易分辨。
)内弹性膜清晰可见,染成亮红色。
内皮似乎紧贴在波浪起伏的内弹性膜之上。
2.中膜最厚,主要为环形平滑肌。
3.外膜较中膜薄些,主要为结缔组织,含有营养小血管及神经。
外弹性膜不如内弹性膜清楚。
(二)中静脉的结构中静脉:管壁三层结构的分界,不如中动脉清楚。
内、外弹性膜均不明显。
中膜薄,平滑肌肌纤维层数少。
外膜较中膜稍厚,无外弹性膜,可见纵行平滑肌束。
名称:皮肤光镜下结构特点:表皮部分由角化的复层扁平上皮组成,其基部与真皮交界处凹凸不平。
从游离面到基底面可分:1. 角质层:厚,深红色2. 透明层:有的不明显3..颗粒层:3-5层梭形细胞,胞质内含有强嗜碱性颗粒4. 棘层:多层多边形细胞组成的。
最深部内有,。
5.基底层:为一层低柱状排列的细胞表皮的深层为真皮,由致密结缔组织组成。
名称:胸腺光镜下结构特点:器官表面覆有结缔组织被膜,其伸入实质形成小叶间隔,把胸腺分成许多不完全的小叶。

介绍大鼠各组织器官石蜡切片制作法山西省中医院(030012)高宝红在科研工作中,实验标本多为动物模型,如大鼠、小鼠及兔等。
大小鼠及兔的组织脏器较人体组织脏器稚嫩柔软,水分含量多。
因此在制作组织切片的过程中,必须根据其组织结构特点,采用不同于人体组织的处理方法,注意各种动物组织在固定、脱水、透明浸蜡、包埋、切片的每个程序中选择最佳的时间方案,才能避免组织块变脆,切片易碎、有裂隙,染色时易脱片等常见不良后果的发生,保证高质量石蜡切片一次成功。
本研究就如何制作优质的大鼠各组织器官石蜡切片作了总结,现从固定、取材、脱水、透明、浸蜡、包埋到切片、烤片、脱蜡、染色的经验介绍如下。
1如何制作优质大鼠各器官石蜡切片1.1标本:大鼠各个脏器———心、肝、脾、肺、肾、大脑、脊髓、胃肠、垂体、胸腺、淋巴结、肾上腺、卵巢、睾丸、子宫、膀胱、附睾。
1.2固定液:中性甲醛溶液,固定时间为24h。
1.3取材:心脏:最大纵断面取1块,厚度为2mm;肝脏:右叶纵断面取1块,厚度为2mm;脾脏:纵断面取1块,厚度为2mm;肺脏:纵断面取1块,厚度为2mm;肾脏:最大面剖开取一半,包括皮质、髓质和肾盂;大脑:最大面剖开取一半;脊髓:横断面剖开取1块,厚度2~3mm;胃:沿大弯侧剪开,纵切一长条,长1cm,宽2mm;肠:横断面切取一段,约2mm;垂体:全包;胸腺:全包;淋巴结:全包;肾上腺:全包;卵巢:全包;子宫:横断面剖开取一段,厚度2mm;睾丸:最大面剖开,取半;附睾:纵断面剖开取半;膀胱:剖开取半。
1.4各个脏器的脱水透明浸蜡时间:见第1024页表1。
1.5包埋:胃肠、子宫、膀胱立埋,其余脏器平埋,蜡温为65~ 70℃。
1.6切片:厚度4μm,摊片水温56℃左右,选取无皱折的4片。
2动物组织石蜡切片苏木素-伊红(HE)染色切片置70℃的烤箱中30min入二甲苯脱蜡20min;入梯度乙醇100%→95%→85%→75%,自来水冲洗2min;入苏木精30min,取出自来水冲洗2min;入盐酸乙醇分化5s,自来水冲洗2min;入伊红5 s,自来水冲洗2min;入梯度乙醇75%→85%→95%Ⅰ→95%Ⅱ→100%→100%;入二甲苯Ⅰ→二甲苯Ⅱ;中性树胶封片。

组织病理切片的制作流程1.取材组织取材的方法是制作切片的一个重要程序,根据教学、科研及外检的具体要求取自人体(外科手术切除标本、活检标本、尸检标本)或动物,并确定取材的部位和方法。
取材者需要掌握解剖学、组织学、病理学的基本理论知识,还要掌握实际操作技术,每个组织器官的取材都有一定的部位和方法,不能任意切取组织作为制片材料,不然,无法达到教学、科研和临床诊断的目的,具体要求如下:(1)材料新鲜:取材组织愈新鲜愈好,人体组织一般在离体后,动物组织在处死后迅速固定,以保证原有的形态学结构。
(2)组织块的大小:所取组织块较理想的体积为2.0cm×2.0cm×0.3cm,以使固定液能迅速而均匀地渗入组织内部,但根据制片材料和目的不同,组织块的较理想体积也不同,如制作病理外检、科研切片,其组织块可以薄取0.1~0.2cm即可,这样可以缩短固定脱水透明的时间,若制作教学切片厚取0.3 ~0.5cm,这样可以同一蜡块制作出较多的教学切片。
(3)勿挤压组织块: 切取组织块用的刀剪要锋利,切割时不可来回锉动。
夹取组织时切勿过紧,以免因挤压而使组织、细胞变形。
(4)规范取材部位: 要准确地按解剖部位取材,病理标本取材按照各病变部位、性质的不同,根据要求规范化取材。
(5)选好组织块的切面:根据各器官的组织结构,决定其切面的走向。
纵切或横切往往是显示组织形态结构的关键,如长管状器官以横切为好。
(6)保持材料的清洁:组织块上如有血液、污物、粘液、食物、粪便等,可用水冲洗干净后再放入固定液中。
(7)保持组织的原有形态:新鲜组织固定后,或多或少会产生收缩现象,有时甚至完全变形。
为此可将组织展平,以尽可能维持原形。
2.固定(1)小块组织固定法:这是最常用的方法,从人体或动物体取下的小块组织,须立即置入液态固定剂中进行固定,通常,标本与固定液的比例为1:4~20,但组织块不宜过大过厚,否则固定液不能迅速渗透。
故取组织块的大小一般为2.0cm×2.0cm×0.3cm。

组织病理切片的制作过程1、取材取材的好坏,直接影响切片的质量。
首先要有一把锋利的取材刀,在切割组织时要避免取材刀来回拖拉,切取的组织块厚薄要均匀,一般厚度以0.2 ~0.3cm为适,较容易发脆的组织如甲状腺、肝脏、血块、淋巴结、大块癌组织等可适当厚一点,而脂肪组织、肺组织、纤维性肿瘤、平滑肌瘤等致密的或试剂不易渗入的组织应取薄一些;淋巴结应修掉两侧球冠,并尽量剔除周围的脂肪组织。
在取材中还应十分注意组织内是否有缝线或骨组织,如碰到不可避免的钙化组织,应与技术室讲明,在切取纤维组织、肌肉、组织、胃肠道时,应注意纤维及肌肉的走向,取材时尽可能按与纤维平行走向切取为佳。
具体要求如下:(1)材料新鲜:取材组织愈新鲜愈好,动物组织在处死后迅速固定,以保证原有的形态学结构。
(2)组织块的大小:所取组织块较理想的体积为2.0cm×2.0cm×0.3cm,以使固定液能迅速而均匀地渗入组织内部,但根据制片材料和目的不同,组织块的较理想体积也不同,如制作病理外检、科研切片,其组织块可以薄取0.1~0.2cm即可,这样可以缩短固定脱水透明的时间,若制作教学切片厚取0.3 ~0.5cm,这样可以同一蜡块制作出较多的教学切片。
(3)勿挤压组织块: 切取组织块用的刀剪要锋利,切割时不可来回锉动。
夹取组织时切勿过紧,以免因挤压而使组织、细胞变形。
(4)规范取材部位: 要准确地按解剖部位取材,病理标本取材按照各病变部位、性质的不同,根据要求规范化取材。
(5)选好组织块的切面:根据各器官的组织结构,决定其切面的走向。
纵切或横切往往是显示组织形态结构的关键,如长管状器官以横切为好。
(6)保持材料的清洁:组织块上如有血液、污物、粘液、食物、粪便等,可用水冲洗干净后再放入固定液中。
(7)保持组织的原有形态:新鲜组织固定后,或多或少会产生收缩现象,有时甚至完全变形。
为此可将组织展平,以尽可能维持原形。
2.固定(1)小块组织固定法:这是最常用的方法,从人体或动物体取下的小块组织,须立即置入液态固定剂中进行固定,通常,标本与固定液的比例为1:4~20,但组织块不宜过大过厚,否则固定液不能迅速渗透。

观察组织切片实验报告观察组织切片实验报告细胞是生命的基本单位,组织则是细胞的有机组织,它们共同构成了我们身体的基本结构。
要深入了解细胞和组织的结构与功能,观察组织切片是一种常用的实验方法。
本文将以观察组织切片实验为主题,探讨其意义、步骤和结果。
一、实验意义观察组织切片实验是生物学研究中常用的手段之一。
通过观察细胞和组织的形态、结构和功能,可以深入了解生物体的生理和病理过程,为疾病的诊断和治疗提供重要依据。
同时,观察组织切片还可以帮助我们理解细胞和组织的发育、分化和再生等基本生物学过程。
二、实验步骤1. 制备组织切片首先,我们需要选择合适的组织样本。
常见的组织样本包括动物和植物的器官、组织和细胞。
然后,将组织样本固定在适当的溶液中,如福尔马林。
固定后,将组织样本脱水、浸泡于透明剂中,最后嵌入在蜡块中。
制备好的蜡块可以长期保存,方便后续切片。
2. 切制组织切片在制备好的蜡块上,使用组织切片机将薄片切下。
切片的厚度一般为5-10微米。
切片时需要保持手法稳定,以确保切片的质量。
切好的组织切片可以放置在载玻片上。
3. 染色和封片为了更好地观察组织切片中的细胞和结构,我们需要对其进行染色。
常用的染色方法有苏木精-伊红染色、血液片染色等。
染色后,将载玻片上的组织切片用透明胶封住,以保护和固定切片。
三、实验结果观察组织切片的结果可以通过显微镜来观察。
根据实验目的的不同,我们可以观察到组织的整体结构、细胞的形态和排列方式、细胞器的分布等。
例如,在观察动物肌肉组织切片时,可以看到肌纤维的排列和细胞内肌纤维的结构。
在观察植物组织切片时,可以观察到细胞壁、叶绿体和细胞间隙等结构。
观察组织切片的结果可以通过绘制示意图或拍摄照片来记录。
通过对比和分析不同组织切片的差异,我们可以进一步研究细胞和组织的结构与功能之间的关系,揭示生物体内部的奥秘。
四、实验注意事项在进行观察组织切片实验时,需要注意以下几点:1. 实验操作要规范,遵循实验室安全操作规程,保护个人安全。
各器官组织切片结构特点一、引言人体由各种器官和组织构成,每个器官和组织都有其独特的结构和功能。
通过观察器官组织的切片,我们可以深入了解其微观结构特点,进一步理解其功能和作用机制。
本文将对心脏、肺、肝、肾、胃、肠和皮肤等器官组织的切片结构特点进行详细介绍。
二、心脏组织切片结构特点心脏是一个主要由肌肉纤维构成的器官,负责泵送血液到全身各个部位。
在心脏切片中,可以观察到心肌纤维呈束状排列,形成心肌纤维束。
这些纤维束具有一定的方向性,使得心脏能够有节律地收缩和舒张,推动血液流动。
此外,心肌细胞之间存在缝隙连接,有助于快速传递电信号,维持心脏的节律性收缩。
三、肺组织切片结构特点肺是一个由肺泡组成的器官,主要负责气体交换。
在肺切片中,可以观察到肺泡呈蜂窝状排列,肺泡壁由单层肺上皮细胞构成。
这些肺上皮细胞具有丰富的微绒毛结构,能够增加表面积,提高气体交换的效率。
此外,肺组织中还含有支气管、血管和淋巴管等结构,共同维持肺的正常功能。
四、肝组织切片结构特点肝是一个复杂的器官,具有代谢、解毒、造血和免疫等多种功能。
在肝切片中,可以观察到肝细胞呈多边形排列,形成肝小叶。
肝细胞内含有丰富的细胞器和膜结构,如线粒体、内质网和核膜等,有助于进行各种生化反应。
此外,肝组织中还含有胆管、血管和淋巴管等结构,共同参与肝的生理活动。
五、肾组织切片结构特点肾是一个重要的排泄器官,主要负责过滤血液和排除毒素。
在肾切片中,可以观察到肾小球和肾小管的结构。
肾小球由大量的毛细血管构成,能够过滤血液中的废物和多余水分;肾小管则是由单层肾小管上皮细胞构成,具有重吸收功能,能够回收有用的物质。
此外,肾组织中还含有血管、神经和结缔组织等结构,共同维持肾的正常功能。
六、胃组织切片结构特点胃是一个消化器官,主要负责储存食物和消化食物。
在胃切片中,可以观察到胃黏膜层、黏膜下层、肌肉层和浆膜层等结构。
胃黏膜层由大量的胃腺组成,能够分泌胃酸和消化酶;黏膜下层含有血管、神经和结缔组织;肌肉层由平滑肌纤维组成,能够蠕动食物;浆膜层则是由结缔组织形成的薄膜。
组织病理切片的制作流程1.取材组织取材的方法是制作切片的一个重要程序,根据教学、科研及外检的具体要求取自人体(外科手术切除标本、活检标本、尸检标本)或动物,并确定取材的部位和方法。
取材者需要掌握解剖学、组织学、病理学的基本理论知识,还要掌握实际操作技术,每个组织器官的取材都有一定的部位和方法,不能任意切取组织作为制片材料,不然,无法达到教学、科研和临床诊断的目的,具体要求如下:(1) 材料新鲜:取材组织愈新鲜愈好,人体组织一般在离体后,动物组织在处死后迅速固定,以保证原有的形态学结构。
⑵组织块的大小:所取组织块较理想的体积为2.0cm X 2.0cm X 0.3cm,以使固定液能迅速而均匀地渗入组织内部,但根据制片材料和目的不同,组织块的较理想体积也不同,如制作病理外检、科研切片,其组织块可以薄取0.1〜0.2cm即可,这样可以缩短固定脱水透明的时间,若制作教学切片厚取0.3〜0.5cm,这样可以同一蜡块制作出较多的教学切片。
(3) 勿挤压组织块: 切取组织块用的刀剪要锋利,切割时不可来回锉动。
夹取组织时切勿过紧,以免因挤压而使组织、细胞变形。
(4) 规范取材部位: 要准确地按解剖部位取材,病理标本取材按照各病变部位、性质的不同,根据要求规范化取材。
(5) 选好组织块的切面: 根据各器官的组织结构,决定其切面的走向。
纵切或横切往往是显示组织形态结构的关键,如长管状器官以横切为好。
(6) 保持材料的清洁: 组织块上如有血液、污物、粘液、食物、粪便等,可用水冲洗干净后再放入固定液中。
(7) 保持组织的原有形态: 新鲜组织固定后,或多或少会产生收缩现象,有时甚至完全变形。
为此可将组织展平,以尽可能维持原形。
2.固定(1) 小块组织固定法:这是最常用的方法,从人体或动物体取下的小块组织,须立即置入液态固定剂中进行固定,通常,标本与固定液的比例为1:4〜20,但组织块不宜过大过厚,否则固定液不能迅速渗透。
组织切片观察实验报告
实验报告:组织切片观察实验
摘要:
实验目的:
本实验主要目的是借助显微镜等工具,观察不同组织切片的结构和特点,进一步了解组织细胞的组成和功能。
实验材料:
组织切片(植物叶片切片、果实切片和动物肝脏切片)、显微镜、载玻片、盖玻片、草酸铁钾、苏丹红等试剂。
实验方法:
制备组织切片:用草酸铁钾脱色法将植物叶片和果实切片进行处理,再用苏丹红染色。
对动物肝脏切片先进行蜡采嵌切技术处
理,然后进行苏丹红染色。
最后,将制好的组织切片放置到载玻片上,加盖玻片并利用显微镜观察和拍照。
实验结果:
观察植物叶片切片,我们可以看到其细胞排列有序,每个细胞都有细胞壁、细胞质、细胞核和色素体等组成部分。
果实切片则主要由皮层、维管束、内果层等组成,显示出明显的环状结构和寄生粘液细胞。
肝脏切片则展示出肝细胞的形态和排列方式,丰富的细胞器和小颗粒显示出肝细胞合成蛋白质和代谢功能。
实验结论:
通过本次组织切片观察实验,我们对植物和动物组织的结构和特点有了更深入的了解,同时也加深了我们对细胞结构和功能的认识。
观察肺切片实验报告引言肺是呼吸系统中至关重要的器官之一,负责人体的氧气交换和二氧化碳排出。
肺切片实验通过对肺组织进行切片并观察其结构和细胞组成,可以帮助我们更好地了解肺的组织构成和功能。
本实验旨在通过观察肺切片,揭示肺组织的细胞类型、结构特点以及其相关疾病的变化。
实验方法材料与仪器- 肺组织样本- 切片刀- 显微镜- 光学显微镜镜片- 石蜡- 组织固定剂实验步骤1. 准备肺组织样本。
2. 将肺组织样本固定在适当的组织固定剂中。
3. 使用切片刀将固定后的肺组织切片,厚度约为5-10微米。
4. 将切片放在石蜡中浸泡,以增加其硬度和稳定性。
5. 将石蜡浸泡的切片用切片刀刮下,并放置在光学显微镜镜片上。
6. 使用显微镜观察切片下的肺组织结构,并记录所见内容。
7. 对观察到的细胞、组织等进行标注和描述,并拍摄照片(如有需要)。
实验结果肺组织结构经过显微镜观察,我们可以清晰地看到肺组织的结构特点。
肺由许多小囊泡组成,这些囊泡称为肺泡。
肺泡之间由细长的肺泡间隔隔开,构成了肺组织的基本单位。
肺泡是由一层薄膜包裹的,这层薄膜称为肺泡上皮。
在肺泡上皮下方,可以看到肺泡壁,它主要由结缔组织和平滑肌组成。
在肺泡壁内,存在着大量的毛细血管,这些血管负责将氧气从肺泡中吸收,并将二氧化碳排出。
细胞类型在肺切片中,我们还能观察到多种细胞类型。
其中最重要的细胞类型包括:1. 肺泡上皮细胞:它们是肺泡上皮的重要组成部分,负责分泌肺泡表面活性物质,起到保护肺组织的作用。
2. 平滑肌细胞:平滑肌细胞主要分布在肺泡壁中,它们的收缩和松弛调节着肺泡壁的张力,帮助呼吸运动的顺利进行。
3. 单核细胞:单核细胞在肺组织中起到免疫调节的作用,参与对抗病原微生物的防御。
4. 血管内皮细胞:血管内皮细胞是构成肺泡壁内血管的主要细胞类型,它们承担着气体交换的主要任务。
疾病变化通过观察肺切片,我们能够发现一些与肺相关的疾病变化。
比如,肺炎是一种常见的肺部感染性疾病,它会导致肺泡上皮的炎症反应,并引起肺泡间隔的增厚和破坏。