分子晶体和原子晶体
- 格式:ppt
- 大小:1.51 MB
- 文档页数:20

分子晶体和原子晶体
1、分子晶体和原子晶体区别:
(1)单体结构不同。
分子晶体一般是有物质分子构成,而原子晶体一般有单个原子构成;
(2)晶体内作用力不同。
分子晶体一般是通过分子间范德华力作用形成,而原子晶体一般通过原子共价键作用形成;
(3)物理性质不同。
分子晶体一般硬度、熔点较低,而原子晶体一般硬度、熔点很高。
比如白糖属于分子晶体,而钻石属于原子晶体,二者硬度、熔点差别很大;
(4)存在形式有差异。
分子晶体一般有固、液、气三种存在形式,而原子晶体一般只有固体存在形式。
分子晶体典型代表:
1、所有非金属氢化物;
2、大部分非金属单质(稀有气体形成的晶体也属于分子晶体),如:卤素(X2)、氧气、硫(S8)、氮(N2)、白磷(P4)、C60等(金刚石,和单晶硅等是原子晶体);
3、部分非金属氧化物,如:CO2、SO2、SO3、P4O6、P4O10等(如SiO2是原子晶体) ;
4、几乎所有的酸;
5、绝大多数有机化合物,如:苯、乙酸、乙醇、葡萄糖等 ;
6、所有常温下呈气态的物质、常温下呈液态的物质(除汞外)、
易挥发的固态物质。
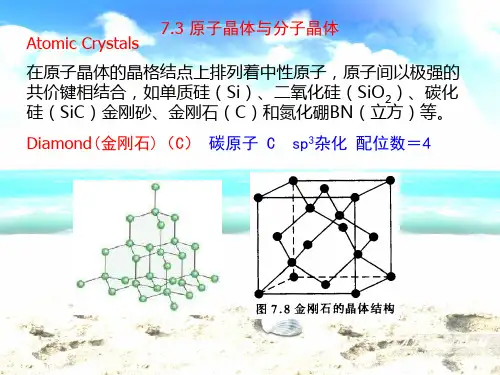
原子晶体类型:
1、某些金属单质:晶体锗(Ge)等;
2、某些非金属化合物:氮化硼(BN)晶体、碳化硅、二氧化硅等;
3、非金属单质:金刚石、晶体硅、晶体硼等。





HXC60P106, P1010都形成分子晶体,只有很少的一部分和______SiO2,碳化硅,第二节分子晶体和原子晶体一、分子晶体(一)、概念:分子间以______________________ (_____________ , ________________ )相结合的晶体叫分子晶体。
注意:(1)构成分子晶体的粒子是 ______________________ 。
(2 )在分子晶体中,分子内的原子间以结合,而相邻分子靠或相互吸引。
(3 )范德华力化学键的作用:(4 )分子晶体熔化破坏的是O(二)•分子晶体的物理特性:(1)___ 的熔点和沸点,(2) ______________ 的硬度,________ 挥发, _________ 升华(3)—般都是________ 体,固体和熔融状态都__________________ 导电。
(4)分子晶体的溶解性与溶质和溶剂的分子的___________________ 相关一一____________________思考:1、为什么分子晶体熔沸点低、易挥发、易升华、硬度小?原因:分子晶体发生这些变化时_只破坏 __________________________ , ________________ 很弱,克服它时需要的能量小。
所以分子晶体熔沸点低、易挥发、易升华、硬度小。
2、为什么分子晶体在晶体和熔融状态均不导电?它们在晶体和熔融状态均不存在_______________________ 。
部分分子晶体溶于水在水分子作用下发生_____________ 导电,如HCI, H2S04 ;有些溶于水与水反应生成_______________________________ 而导电,晶体硼等。
)(四)分子晶体结构特征1. ______________________________ __ 分子密堆积每个分子周围有______________ 个紧邻的分子,如:C60、干冰、12、02——不具有分子密堆积特征P1,CH4,2,冰中1个水分lmol冰周I韦]有mol氢键。

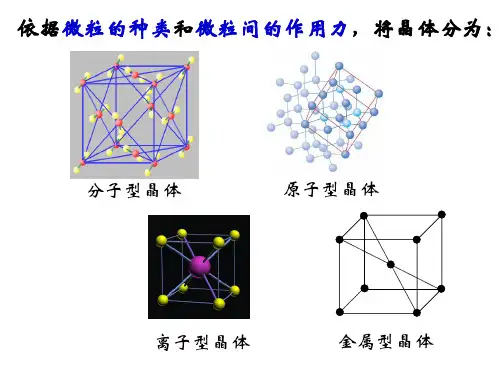
分子晶体原子晶体金属晶体在自然界中,晶体是一种固体物质,具有高度的有序性和规律性,并且形态各异。
晶体的种类很多,其中包含的主要种类是分子晶体、原子晶体和金属晶体。
不同类型的晶体都具有不同的结构和特性。
本文将逐步介绍这三种晶体的特点和在日常生活中的应用。
一、分子晶体分子晶体是由含有较大分子的化合物构成的,这些分子是由原子共价键结合在一起,并且在晶体中紧密地排列成一定顺序。
分子晶体的分子之间通过非共价键结合,如范德华力等内力来保持相对位置不变。
其结构稳定,通常具有良好的透明度和极强的吸收性能,适用于制造高亮度的有机发光二极管。
维生素C和冰的结构都属于分子晶体。
二、原子晶体原子晶体是由相同元素的原子构成的,它们按一定的晶格规律排列在一起。
在原子晶体中,原子之间的相互作用力强于分子晶体,包括离子键、共价键、金属键以及半共价键等化学键。
由于原子晶体中相同原子的排列方式是高度规则的,因此这种晶体也具有制备精度和细致度得到保证,如半导体中的硅和金刚石的结构。
三、金属晶体金属晶体是由金属原子构成的,其中原子之间的相互作用力是金属键。
金属晶体的特点包括良好的导电性、导热性和延展性,并且在日常生活中可以用于制造各种器具和机械零件。
酸洗掉色后,金属晶体表面的金属疏松散,表明金属晶体是含有蜂巢结构的,如纯铜、纯铁等金属结构。
总之,分子晶体、原子晶体和金属晶体是其特点不同,有着不同的用途,其中分子晶体适用于制备高亮度和高透明度材料,原子晶体适用于硅晶圆片和金刚石器材制备等领域,而金属晶体适用于机械制造和模具制作等工业应用,这些应用都可以通过晶体技术的不断研究和发展,得到普及和推广。

原子晶体分子晶体
摘要:
一、原子晶体和分子晶体的概念
二、原子晶体和分子晶体的区别
三、原子晶体和分子晶体的性质和应用
正文:
原子晶体和分子晶体是两种常见的晶体类型,它们在结构、性质和应用上都有所不同。
原子晶体是由原子通过共价键以空间网状结构形成的晶体。
例如,金刚石、晶体硅和二氧化硅等物质都是原子晶体。
在原子晶体中,原子之间通过共价键结合在一起,形成一个三维的、有序的结构。
这种结构具有较高的熔点、沸点和硬度,因此在工业上具有广泛的应用。
分子晶体是由分子通过分子间作用力结合而成的晶体。
例如,冰、干冰和氧气等物质都是分子晶体。
在分子晶体中,分子之间通过范德华力或氢键结合在一起,形成一个二维的、无序的结构。
这种结构具有较低的熔点、沸点和硬度,因此在制冷、保鲜和运输等领域具有广泛的应用。
原子晶体和分子晶体的区别在于它们的结构和结合方式。
原子晶体是由原子通过共价键结合而成的,具有较高的熔点、沸点和硬度;分子晶体是由分子通过分子间作用力结合而成的,具有较低的熔点、沸点和硬度。
原子晶体和分子晶体的性质和应用也不同。
原子晶体具有较高的熔点、沸点和硬度,因此在工业上广泛应用于制造高强度、高硬度的材料,如切削刀
具、钻头和模具等。
分子晶体具有较低的熔点、沸点和硬度,因此在制冷、保鲜和运输等领域具有广泛的应用。
综上所述,原子晶体和分子晶体在结构、性质和应用上都有所不同。
分子晶体(稀有气体的晶体除外)分子内都含有共价键,分子间存在分子间作用力(一定有范德华力,可能有氢键),共价键决定化学性质,分子间作用力决定部分物理性质,四大晶体类型中只有分子晶体的物理性质和化学性质取决于不同类型的作用力,其它三类晶体的物理性质和化学性质基本取决于同一种作用力(含共价键的离子晶体稍有特殊)。
分子间不存在氢键的分子晶体均采用分子密堆积,原因是范德华力没有方向性和饱和性,采用分子密堆积的分子晶体中每个分子周围紧邻12个分子。
采用分子密堆积的分子晶体晶胞(正方体和长方体均有可能,晶体中分子的方向也可能不一致,如碘晶体中分子有2种方向,干冰晶体中分子有4种方向,可参考课本上的图片)中8个顶点和6个面心各有一个分子,用均摊法计算平均每个晶胞中含有4个分子。
分子间存在氢键的分子晶体只需要掌握冰的结构,冰中每个水分子形成4个氢键,每个氢键由2个水分子共用,因此平均每个水分子形成2个氢键,1mol冰中含有2mol氢键。
原子晶体(新教材已改名为共价晶体,过渡阶段高考有可能会引入此名称,要有所了解,如果是填空题还是写原子晶体)原子间均以共价键结合,共价键的强度即决定部分物理性质又决定化学性质。
金刚石的晶胞结构(参考课件图片,不同颜色表示不同的位置)必须记住:顶点有8个原子,面心有6个原子,内部有4个原子,每个晶胞平均含有8个原子。
(全国卷和山东卷都曾经考过其晶体结构且不给任何信息)补充:金刚石的晶体中每个C被12个六C环共用(图中的原子键应该是共价键)金刚石是立体网状结构,每个碳原子形成4个共价键,任意抽出2个共价键,每两个单键归两个六元环所有,而不是只归一个六元环所有(如图所示,红色的两个碳碳单键,可以构成蓝色和紫红色的两个六元环)。
每个碳原子连出4个共价键,任意抽出2个共价键能决定两个6元环,4个共价键总共能抽出6组。
所以6组碳碳键实际上可以构成12个六元环,所以一个碳归十二个六元环共用。
6 ×1/12 = 1/2。
第三章第二节分子晶体与原子晶体第一课时分子晶体教学目标1、使学生了解分子晶体的组成粒子、结构模型和结构特点及其性质的一般特点。
2、使学生了解晶体类型与性质的关系。
3、使学生理解分子间作用力和氢键对物质物理性质的影响。
4、知道一些常见的属于分子晶体的物质类别。
5、使学生主动参与科学探究,体验研究过程,激发他们的学习兴趣。
教学重点、难点重点掌握分子晶体的结构特点和性质特点难点是氢键的方向性和氢键对物体物理性质的影响从三维空间结构认识晶胞的组成、结构教学方法建议:运用模型和类比方法诱导、分析、归纳教学过程:[引入]我们已经知道,固体有晶体和非晶体之分,绝大多数常见的固体是晶体。
现在给出下列晶体的熔点:甲烷(-182.5℃)氮(-210.1℃)金刚石(3900℃)氧化铝(2030℃),氯化钠(801℃)同为晶体,为什么它们的熔点及其性质有如此大的差异呢?物质结构决定物质性质,我们需要探讨晶体的内部结构来回答这个问题。
分类研究是科学研究的基本方法之一,根据晶体结构的不同,我们把年个吨毫2分为若干类型,其中,只含分子的晶体称为分子晶体。
一、分子晶体1、定义:含分子的晶体称为分子晶体也就是说:分子间以分子间作用力相结合的晶体叫做分子晶体分子,就属于分子晶体问:还有哪些属于分子晶看图,如:碘晶体中只含有I2体?2、较典型的分子晶体有非金属氢化物,部分非金属单质,部分非金属氧化物,几乎所有的酸,绝大多数有机物的晶体。
3、分子间作用力和氢键过度:首先让我们回忆一下分子间作用力的有关知识阅读必修2 科学视野教师诱导:分子间存在着一种把分子聚集在一起的作用力叫做分子间作用力,也叫范徳华力。
分子间作用力对物质的性质有怎么样的影响?学生回答:一般来说,对于组成和结构相似的物质,相对分子量量越大分子间作用力越大,物质的熔、沸点也越高。
教师诱导:但是有些氢化物的熔点和沸点的递变却与此不完全符合,如:NH3、H2 O和HF的沸点就出现反常。
原子晶体分子晶体
原子晶体和分子晶体都是固体的一种形式,它们之间的主要区别在于它们的基本构建单位。
1. 原子晶体:
•构建单位:在原子晶体中,基本的构建单位是原子。
这些原子通过离子键、共价键或金属键等方式相互结合,形成均匀的晶体结构。
•例子:金属晶体(如铁、铜)、离子晶体(如氯化钠NaCl)是原子晶体的例子。
在金属晶体中,金属原子通过金属键结合,形成具有电子云的电子海。
在离子晶体中,正负离子通过离子键相互吸引形成晶体结构。
2. 分子晶体:
•构建单位:在分子晶体中,基本的构建单位是分子。
分子通过分子间的力(如范德华力、氢键、共价键等)相互结合,形成晶体结构。
•例子:葡萄糖、水合铜硫酸是分子晶体的例子。
在葡萄糖中,分子是由碳、氢、氧原子组成的葡萄糖分子,它们通过共价键结合在一起。
在水合铜硫酸中,分子是由铜、氧、硫、氢和水分子组成,它们通过范德华力等相互结合。
总的来说,原子晶体和分子晶体的区别在于它们构建晶体结构的基本单位:是原子还是分子。
在实际应用中,这两种类型的晶体具有不同的性质和特征。