15 硝基化合物和胺4h
- 格式:ppt
- 大小:2.76 MB
- 文档页数:64

第十五章 硝基化合物及胺学习要求1.握硝基化合物及胺的分类、命名法和结构。
2.掌握胺的化学性质:碱性(结构和溶剂化效应),胺的鉴别,季铵盐的性质及霍夫曼规则。
3.掌握硝基化合物的性质。
4.理解三种分子重排反应的实例。
5. 了解腈和异腈的性质。
6.了解硝基化合物的性质、制法以及重要代表物。
7.了解硝基化合物及胺的制法。
8.了解相转移原理作为有机合成新方法的原因。
9. 了解表面活性剂。
计划课时数 4课时重点:胺的化学性质:碱性(结构和溶剂化效应),胺的鉴别,季铵盐的性质及霍夫曼规则。
难点:分子重排反应教学方法 采用多媒体课件、模型和板书相结合的课堂讲授方法。
引言:分子中含有C-N 键的有机化合物称为含氮有机化合物。
含氮有机化合物种类很多,本章简单讨论硝基化合物,重点讨论胺、重氮盐和分子重排反应。
硝基化合物硝基化合物一般写为R-NO 2 ,Ar-NO 2 ,不能写成R-ONO (R-ONO 表示硝酸酯)。
§15.1 硝基化合物分类、命名、结构1. 分类 (略)2. 命名 (与卤代烃相次似)硝基乙烷对硝基甲苯3. 硝基的结构 一般表示为(由一个N=O 和一个N →O 配位键组成)物理测试表明,两个N —O 键键长相等,这说明硝基为一P-π共轭体系(N 原子是以sp2杂化成键的,其结构表示如下:共振结构式:NR氮带一个正电荷,每个氧各带½负电荷,这与硝基化合物高的偶极矩相联系。
根据R的不同,偶极矩在3.5D和4.0D之间,由于硝基化合物的偶极特征,结果比相同分子量的酮沸点高(挥发慢)。
如硝基甲烷(MW61)沸点101℃,丙酮(MW58)沸点56℃。
意外地,在水中溶解度低,在水中硝基甲烷的饱和溶液,以重量计少于10%,而丙酮完全溶于水。
§15.2硝基化合物的制备1.烷烃的硝化:烷烃可与硝酸进行气相或液相硝化,生成硝基烷烃。
其中以气相硝化更具有工业生产价值.烷烃的硝化是以游离基历程进行的:烷烃的碳骼对硝化速度具有一定的影响,活性次序为:叔C-H > 仲C-H > 伯C-H 。


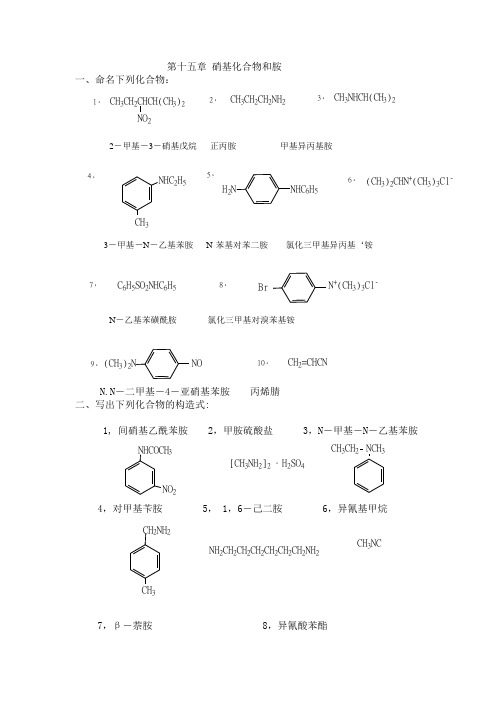
第十五章 硝基化合物和胺一、命名下列化合物:1.CH 3CH 2CHCH(CH 3)2NO 22.CH 3CH 2CH 2NH 23.CH 3NHCH(CH 3)24.NHC 2H 5CH 3H 2N NHC 6H 56.7.C 6H 5SO 2NHC 6H 58.BrN +(CH 3)3Cl -(CH 3)2CHN +(CH 3)3Cl -9.(CH 3)2NNO10.CH 2=CHCNN.N -二甲基-4-亚硝基苯胺 丙烯腈 二、写出下列化合物的构造式:1, 间硝基乙酰苯胺 2,甲胺硫酸盐 3,N -甲基-N -乙基苯胺NO 2NHCOCH 3[CH 3NH 2]2.H 2SO 4NCH 3CH 3CH 24,对甲基苄胺 5, 1,6-己二胺 6,异氰基甲烷CH 2NH 2CH 3NH 2CH 2CH 2CH 2CH 2CH 2CH 2NH 2CH 3NC7,β-萘胺 8,异氰酸苯酯NH 2NCO三、用化学方法区别下列各组化合物: 12、邻甲苯胺 N -甲基苯胺 N,N -二甲基苯胺解:分别与亚硝酸钠+盐酸在低温反应,邻甲苯胺 反应产物溶解, N -甲基苯胺生成黄色油状物,N,N -二甲基苯胺生成绿色固体。
3,乙胺和乙酰胺解:乙胺溶于盐酸,乙酰胺不溶。
4,环己烷与苯胺。
解:苯胺溶于盐酸,环己烷不溶。
四、试用化学方法分离下列化合物:1.CH 3(CH 2)3NO 2(CH 3)3CNO 2CH 3CH 2CH 2NH 2NaOHaq CH 3(CH 2)3NO 2(CH 3)3CNO 2CH 3CH 2CH 2HClCH 3CH 2CH 2NH 2.HClNaOHaqCH 3CH 2CH 2NH 22,苯酚,苯胺和对氨基苯甲酸解:用氢氧化钠水溶液处理,苯酚和对氨基苯甲酸溶于碱溶液,分出有机相。
有机相为含苯胺。
向水相通入二氧化碳,游离出苯酚,对氨基苯甲酸在水相中,酸化得到对氨基苯甲酸。
3,正己醇,2-己酮,三乙胺和正己胺解:加入亚硫酸氢钠饱和水溶液,2-己酮生成晶体分出,然后用稀酸处理这个晶体又得到2-己酮。

