产品质量检验记录表表格格式
- 格式:docx
- 大小:1.44 MB
- 文档页数:2
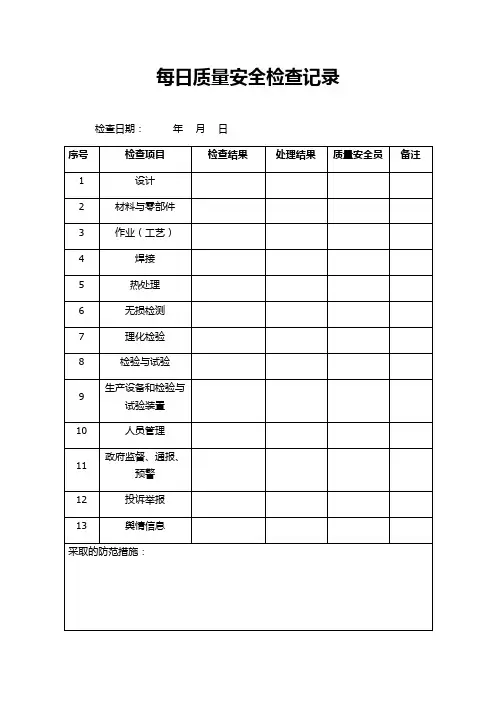
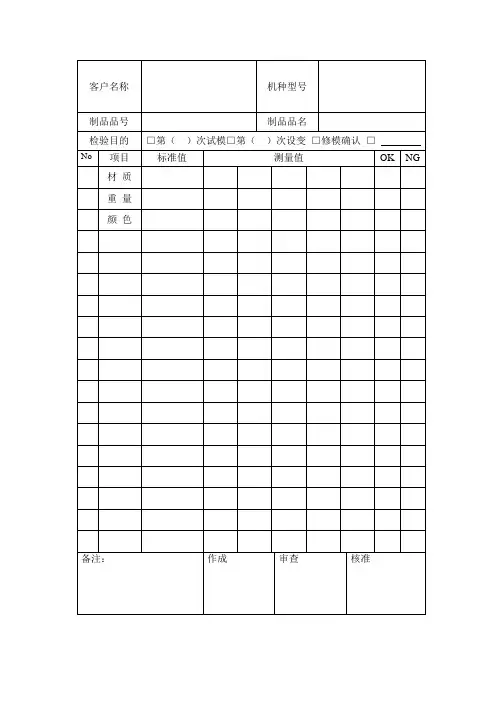

质量管理记录表格
以下是一些常见的质量管理记录表格:
1. 检验记录表格:记录每个样品或产品的检验结果、检验日期和检验员,以便对产品的质量进行追溯和追踪。
2. 抽样检验记录表格:记录每个样品或产品的实际抽样数量、检验结果以及检验员的姓名和日期,以便在批量检验中监控产品的批量质量。
3. 不合格品记录表格:记录每个不合格产品的原因、数量、处理方式和处理人员,以及采取的纠正措施和预防措施,以便及时纠正和避免同类问题的再次发生。
4. 过程控制记录表格:记录生产过程中的重点控制点、检查时间、监测结果和控制措施,以便对生产过程进行监控和纠正,保证产品符合质量要求。
5. 内部审核记录表格:记录内部审核人员对质量管理体系的审核结果、发现的问题和提出的建议,以便及时改进和完善质量管理体系。
6. 外部审核记录表格:记录外部审核人员对质量管理体系的审核结果、发现的问题和提出的建议,以便及时改进和完善质量管理体系,并与外部审计人员进行沟通和协调。
7. 培训记录表格:记录员工的培训计划、培训课程、培训时间
和培训效果,以便从长远角度提高员工能力和素质,为产品质量提供保障。

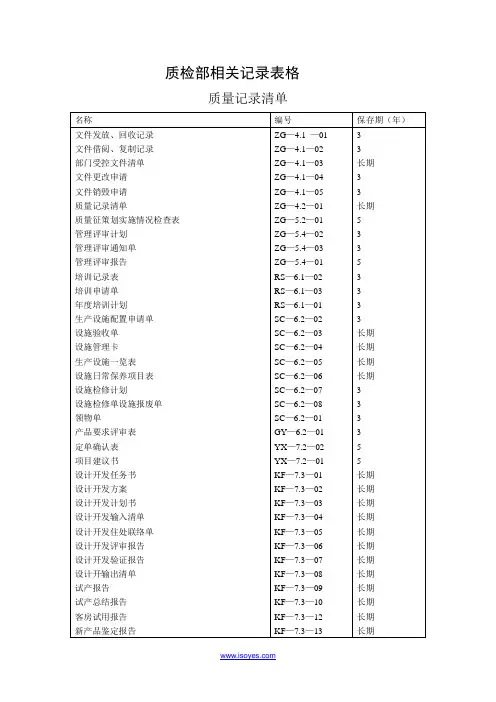
质检部相关记录表格
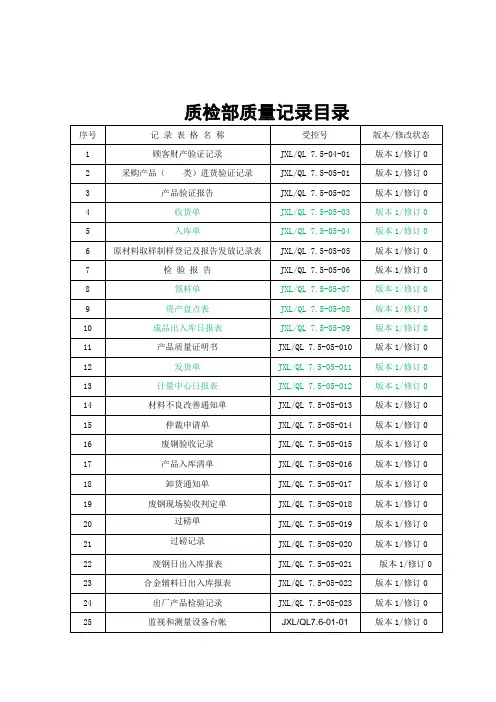
质量记录清单
文件更改申请
质量策划实施情况检查表
内校记录表
编号:ZG-7.6-04 序号:
编号::ZC-8.1.2-02 序号:
审核组组长:组员年月日第页共页
1审核目的:
2审核依据:GB/T19001-2000idtISO9001:2000
本公司质量手册第一版及质量管理体系其他文件
3审核覆盖产品:
审核时间:年月日至年月日
首次会议时间:月日时分
首次会议时间:月日时分
5现场审核期间请被审核方有关人员参加下列活动:
首、末次会议:最高管理者或其代表及与审核有关的管理要员参加。
审核活动:按审核日程安排,被审核方有关人员在本岗位。
6审核安排:
内审检查表
编号::ZC-8.1.2-03 共页第页
不符项报告
内部质量管理体系审核报告(可另附纸叙述)
进货验证记录表
半成品检验记录
成品检验记录
不合格品报告
客户投诉处理单
编号::ZC-8.3-01 序号:
纠正和预防措施处理单
编号::ZC-8.3-02 序号:
改进、纠正和预防措施实施情况一览表
编号::ZC-8.3-03 序号:
信息联络处理单
编号::ZC-8.3-01 序号:
关键控制点监控计划实施状况检查表
编号:SC-6.2-06 执行部门: 序号:
编制: 日期: 批准: 日期:
持续改进计划
合格供方评定表:
供方能力调查表
编号:GY-7.4-0.3 序号:。

Excel电子表格验证模板(RA、URS、DQ、IQ、OQ、PQ、SOP)Excel电子表格验证方案Excel电子表格检验记录风险控制1 目的将常规电子表格进行风险控制使其能成为符合预定用途、具有特殊功能的电子表格,满足实验室具体需求。
2 适用范围本文件适用实验室于Excel电子表格检验记录的风险控制。
3 概述我部门部分检验记录涉及比较复杂运算,普通手工计算占用分析人员较多的时间,且计算过程与结果需经较多复核才能保证准确无误,不利于工作高效开展。
计划将部分检验记录设计成电子表格。
优势:可以大量节约分析时间,缩短复核、审核过程提高工作效率。
劣势:常规的电子表格记录存在风险。
为保证电子表格从设计到应用的整个过程均准确、可靠、安全、有效,需要对电子表格检验记录风险加以控制,形成特殊功能的电子表格检验记录以符合实验室具体要求。
4 人员资质与职责4.1风险评估小组4.2设计人员5 内容风险管理按如下流程组织开展工作。
5.1风险识别通过对电子表格的常用情况调查分析.认定能够影响常规电子表格的安全性、有效性、准确性及完整性的因素可视为风险。
如下表所示:5.2风险分析采用适当的工具对风险的影响因素成因进行分析。
准确性采用因果图较为合适。
下图有助于准确性及逻辑判定的成因分析。
对分析出的影响因素的危害程度暂不进行风险评估,分别在设计与应用方面探寻有效的预防与控制措施。
5.3风险控制分别在应用与设计阶段采用有效的预防与控制措施对风险进行实际控制。
下表提供部分控制措施与方法。
更多的控制方式与接受方式以文件形式列出。
(需求说明、操作SOP、验证方案)5.4控制效果评价5.4.1设计效果评价分别对电子表格检验记录设计阶段的安全性、准确性、有效性及完整性进行评价,确认控制效果能够符合预期要求。
5.4.2应用效果评价评价应用文件的准确性、完整性。
评价表格的可操作性进行。
5.5剩余风险剩余风险是指运用了控制和风险管理技术以后而留下来的风险。
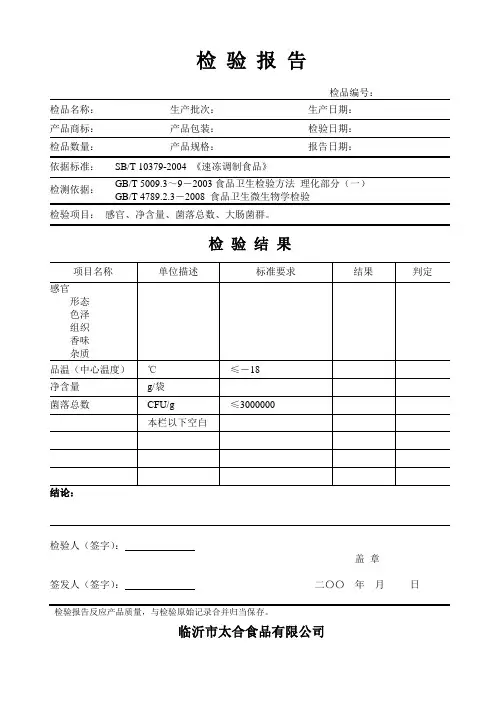
检验报告检品编号:检品名称:生产批次:生产日期:产品商标:产品包装:检验日期:检品数量:产品规格:报告日期:依据标准:SB/T 10379-2004 《速冻调制食品》检测依据:GB/T 5009.3~9-2003食品卫生检验方法理化部分(一)GB/T 4789.2.3-2008 食品卫生微生物学检验检验项目:感官、净含量、菌落总数、大肠菌群。
检验结果项目名称单位描述标准要求结果判定感官形态色泽组织香味杂质品温(中心温度)℃≤-18净含量g/袋菌落总数CFU/g ≤3000000本栏以下空白结论:检验人(签字):盖章签发人(签字):二〇〇年月日检验报告反应产品质量,与检验原始记录合并归当保存。
临沂市太合食品有限公司微生物检验原始记录样品编号第页/共页样品名称:检验前样品状态:□正常□异常仪器名称显微镜电热恒温培养箱仪器型号仪器编号检测依据:GB/T 4789.2-2008 食品卫生微生物学检验菌落总数测定GB/T 4789.3-2008 食品卫生微生物学检验大肠菌群计数检测程序:细菌菌落计数检测:取2~3个稀释度,做细菌菌落计数,36±1℃培养48h。
大肠菌群测定:取样品匀浆稀释液3个稀释度接种乳糖胆盐发酵管,做大肠菌群测定,初发酵36±1℃,24±2h,复发酵36±1℃,24±2h。
检测结果:1.细菌总数测定:取2~3个稀释度检验,36±1℃培养48h,做细菌菌落总数。
细菌总数稀释倍数10-110-210-310-4空白对照报告结果计数平皿1 细菌总数CFU/g 平皿22.大肠菌群计数:接种不同的样品稀释液于乳糖蛋白胨水培养基中,初发酵36±1℃经48±2h培养。
证实实验36±1℃经48±2h培养。
查检索表,报结果。
大肠菌群计数接种量(ml)接种管数初发酵结果分离染色结果复发酵结果报告结果+ —符合不符合+ —大肠菌群MPN/(100g)检验时间年月日时检毕时间年月日时检验人员:检验原始记录、检验报告合并装订归档。

产品质量检验记录表日期:产品名称:产品型号:批次号:生产日期:生产厂商:序号检验项目检验结果检验标准备注1 外观检查2 尺寸测量3 材料成分分析已检验 GB/T XXX4 功能性能测试合格 GB XXX5 耐久性测试不合格 GB XXX6 包装完好性检查总结与建议:说明:1. 此产品质量检验记录表适用于对生产产品的质量进行检验和记录,并在后续的质量控制中提供参考依据。
2. 检验项目根据产品性质和要求进行调整,确保检验全面、准确。
3. 检验结果栏填写“合格”、“不合格”或其他适合的描述。
4. 检验标准栏填写适用的国家标准或相关标准规范。
5. 备注栏用于记录对检验结果的补充说明或其他需要备注的情况。
6. 总结与建议栏用于对产品质量检验结果进行综合评估,并提出改进措施或建议。
以上为产品质量检验记录表的基本格式,根据具体产品的特点和要求,可以对检验项目进行调整和扩展。
在实际使用过程中,建议根据生产和质量管理的需要,制定相应的详细操作规程和记录表。
这样可以确保产品的质量得到有效控制和提升,以满足客户的需求和期望。
通过严格的产品质量检验,可以及早发现和处理产品质量问题,避免不合格品流入市场,确保产品的质量可靠性和稳定性。
各个环节的检验工作应由专业人员进行,确保检验结果的准确性和可靠性。
总之,产品质量检验是保障产品质量的重要环节。
制定和实施科学合理的检验制度,建立健全的检验标准和记录机制,是企业质量管理的基础。
只有通过严密的质量保障体系,才能为用户提供高品质的产品,确保客户的满意度和信任度。