二氧化碳的制取和性质
- 格式:ppt
- 大小:4.73 MB
- 文档页数:31

初三化学二氧化碳的性质及制取知识点总结九年级化学二氧化碳的性质及制取知识点总结二氧化碳的性质:1.二氧化碳的物理性质:可溶于水,密度比空气的大。
加压降温易变为固体〝干冰用途:灭火,温室里作肥料,干冰用于致冷和人工降雨,化工原料2.二氧化碳的化学性质①跟水反应:二氧化碳通入水中生成碳酸 CO2 + H2 O =H2 CO3二氧化碳通入紫色石蕊试液,石蕊试液变红色;加热又变为紫色②跟碱反应生成盐和水:(用澄清的石灰水鉴定CO2)二氧化碳通入澄清的石灰水 CO2 + Ca(OH)2 = CaCO3↓+H2 O现象:有白色沉淀生成(或:澄清的石灰水变浑浊)二氧化碳跟氢氧化钠反应:CO2 + 2NaOH= Na2 CO3 +H2 O(无明显现象)③通常情况下,CO2不支持燃烧,也不能燃烧。
二氧化碳的制取:CaCO3+2HCl=CaCl2+CO2+H2O(1)实验步骤:连:按要求把装置连接好。
检:检查装置的气密性。
装:把大理石或石灰石的小块装入广口瓶;注:向广口瓶内注入稀盐酸;集:收集二氧化碳。
注:A用块状大理石或石灰石跟稀盐酸反应较好。
因为粉末状大理石跟稀盐酸反应速度相当快,且形成大量泡沫,进入导管甚至集气瓶。
B制取二氧化碳,不用浓盐酸,因为浓盐酸挥发性强。
C制氢气,通常用不具有挥发性的稀硫酸,而制二氧化碳时,却不用稀硫酸。
因为硫酸与碳酸钙反应生成硫酸钙微溶于水,成为薄膜包住碳酸钙,使反应很难继续进行。
D二氧化碳气体中往往含有氯化氢气体和水蒸气,有时,在制得二氧化碳后,要除去氯化氢气体和水蒸气,(用饱和碳酸氢钠溶液除氯化氢)(2) 验满:用燃着的木条放在集气瓶口试验,如果火焰熄灭证明瓶内已充满二氧化碳。
(3)灭火原理:通常使用的灭火器有:泡沫灭火器;干粉灭火器;液态二氧化碳灭火器;干粉灭火器,除可用扑灭一般火灾外,还可用扑灭可燃性的油、气的火灾;液态二氧化碳可用来扑灭图书档案、贵重设备、精密仪器等火灾。


二氧化碳的实验室制取与性质
一、制取与收集二氧化碳
(1)药品:石灰石(或大理石)和稀盐酸。
(2)反应原理:CaCO32HCl==CaCl2CO2↑H2O。
(3)实验装置:类似于制氢气的装置,因为实验室制取CO2是常温下用固体和液体反应制得的。
(4)收集方法:因为CO2能溶于水,不能用排水法收集;CO2的密度比空气大,可用向上排空气法收集。
(5)检验方法:验证:把制得的气体通入澄清石灰水中,若澄清石灰水变浑浊,证明这种无色气体是CO2。
验满:把燃着的木条放在集气瓶口,若火焰熄灭,证明瓶内已充满CO2。
(6)注意:实验室制取CO2不能用碳酸钠代替大理石(或石灰石),原因是反应速率太快,不宜收集;不能用浓盐酸代替稀盐酸,原因是浓盐酸易挥发,使收集的CO2气体中混有较多氯化氢气体;也不能用稀硫酸代替稀盐酸,原因是生成的CaSO4微溶于水,覆盖在大理石(或石灰石)表面,阻止反应继续进行。
二、二氧化碳的性质
(1)二氧化碳的物理性质:通常状况下二氧化碳是无色、
无味的气体,密度比空气大,能溶于水。
(2)二氧化碳的化学性质:
①不能燃烧,也不能支持燃烧;不能供给呼吸;
②二氧化碳与水反应生成碳酸:3222CO H CO O H ===+,碳酸能
使紫色石蕊试液变红。
碳酸不稳定,受热易分解,
↑+===2232CO O H CO H
③二氧化碳和澄清石灰水反应:二氧化碳和澄清石灰水中的氢氧化钙反应,生成不溶于水的白色物质碳酸钙,使澄清的石灰水变浑浊,O H CaCO OH Ca CO 2322)(+↓===+,利用此反应可以鉴定CO 2的存在。
△。
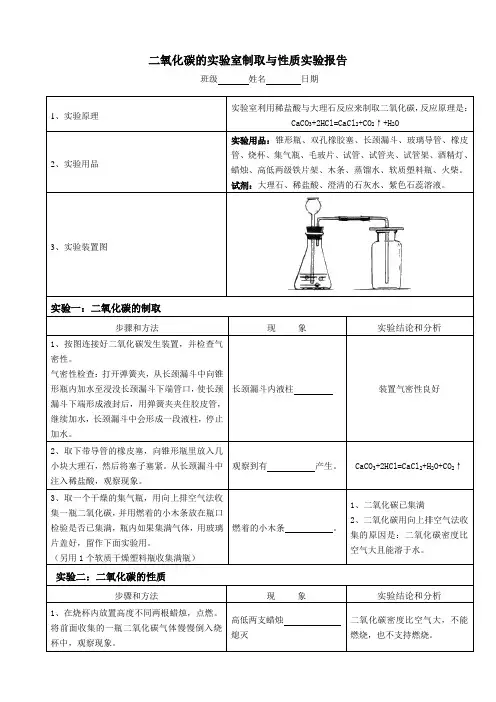
二氧化碳的实验室制取与性质实验报告班级姓名日期1、实验原理实验室利用稀盐酸与大理石反应来制取二氧化碳,反应原理是:CaCO3+2HCl=CaCl2+CO2↑+H2O2、实验用品实验用品:锥形瓶、双孔橡胶塞、长颈漏斗、玻璃导管、橡皮管、烧杯、集气瓶、毛玻片、试管、试管夹、试管架、酒精灯、蜡烛、高低两级铁片架、木条、蒸馏水、软质塑料瓶、火柴。
试剂:大理石、稀盐酸、澄清的石灰水、紫色石蕊溶液。
3、实验装置图实验一:二氧化碳的制取步骤和方法现象实验结论和分析1、按图连接好二氧化碳发生装置,并检查气密性。
气密性检查:打开弹簧夹,从长颈漏斗中向锥形瓶内加水至浸没长颈漏斗下端管口,使长颈漏斗下端形成液封后,用弹簧夹夹住胶皮管,继续加水,长颈漏斗中会形成一段液柱,停止加水。
长颈漏斗内液柱装置气密性良好2、取下带导管的橡皮塞,向锥形瓶里放入几小块大理石,然后将塞子塞紧。
从长颈漏斗中注入稀盐酸,观察现象。
观察到有产生。
CaCO3+2HCl=CaCl2+H2O+CO2↑3、取一个干燥的集气瓶,用向上排空气法收集一瓶二氧化碳,并用燃着的小木条放在瓶口检验是否已集满,瓶内如果集满气体,用玻璃片盖好,留作下面实验用。
(另用1个软质干燥塑料瓶收集满瓶)燃着的小木条。
1、二氧化碳已集满2、二氧化碳用向上排空气法收集的原因是:二氧化碳密度比空气大且能溶于水。
实验二:二氧化碳的性质步骤和方法现象实验结论和分析1、在烧杯内放置高度不同两根蜡烛,点燃。
将前面收集的一瓶二氧化碳气体慢慢倒入烧杯中,观察现象。
高低两支蜡烛熄灭二氧化碳密度比空气大,不能燃烧,也不支持燃烧。
2、向两支试管中分别加入2ml蒸馏水,各滴入3~5滴石蕊溶液,观察试管中溶液的颜色。
将其中一支试管静置,向另一支试管中通入二氧化碳,观察现象,并与静置的试管中溶液的颜色进行对比。
将通入二氧化碳的试管放在酒精灯火焰上加热,观察现象。
1、通入二氧化碳的试管中。
2、加热后,试管内溶液的颜色。

二氧化碳的性质和制取(讲义及解析)知识点睛二氧化碳的性质〔1〕物理性质无色、无味的气体,密度比空气大,能溶于水。
固态二氧化碳为白色雪花状固体,俗称,常用作制冷剂,也可用于人工降雨。
〔2〕化学性质①不燃烧,也不支持燃烧②与水反应化学方程式:生成的碳酸能使紫色石蕊溶液变红;碳酸不稳定,容易分解成二氧化碳和水。
化学方程式:③与澄清石灰水反应〔此反应用来检验二氧化碳〕化学方程式:与氢氧化钠溶液反应〔此反应用来吸收二氧化碳〕化学方程式:〔3〕用途灭火、光合作用、气体肥料、制冷剂、人工降雨等。
二氧化碳的制取〔1〕工业制取二氧化碳反应原理:【拓展】CaO 易与水发生反应,大量的热,可用作干燥剂,反应的化学方程式:。
〔2〕实验室制取二氧化碳①药品:和反应原理:A、不选用浓盐酸,因为浓盐酸易挥发产生,导致收集到的 CO2不纯。
B、不选用稀硫酸,因为反应生成的微溶于水,会附着在大理石的表面阻止反应继续进行。
C、不选用碳酸钠粉末,因为碳酸钠粉末与稀盐酸反应速率太,不方便收集。
〔Na2CO3+2HCl 2NaCl+H2O+CO2↑〕②实验装置实验室制取的 CO2 中常混有 HCl 和水蒸气,可利用如下装置进行净化。
饱和 NaHCO3 溶液可除去 HCl , 浓硫酸具有吸水性,可用作干燥剂,除去水蒸气。
【拓展】万能瓶的应用图 A :收集气体〔根据气体密度选择合适的进气口〕;图 B 〔短进长出〕:收集气体〔液体被挤入烧杯〕;图 C 〔长进短出〕:除去杂质〔气体充分接触液体〕;图 D 〔长进长出〕:既能除杂质,又能收集气体。
③二氧化碳的检验、验满 A 、检验:通入澄清石灰水。
B 、验满:燃着的木条放在集气瓶口。
精讲精练以下有关二氧化碳的实验只能证明其物理性质的是〔 〕A 、B 、C 、 D、检验久未开启的菜窖内CO2 浓度是否过大的正确方法是〔〕A、带入一杯水B、带入一个接通电源的手电筒C、带入一支盛满澄清石灰水的试管D、带入一盏点燃的油灯如下图,水槽内盛有澄清石灰水,点燃高低不同的两支蜡烛,用钟罩将其扣在水槽内。


二氧化碳制取的性质和制法【学习目标】1.掌握二氧化碳的性质。
2.掌握实验室制取二氧化碳的原理、装置和操作要点。
3.了解实验室中制取气体的思路和方法。
4.了解二氧化碳的用途并关注温室效应。
【要点梳理】要点一、二氧化碳的性质1.二氧化碳的物理性质:(1)通常状况下,二氧化碳是一种无色无味的气体。
(2)标准状况下,二氧化碳的密度为1.977g/L,比空气大。
(3)固态CO2又叫干冰。
二氧化碳的三态变化:2.二氧化碳的化学性质:(1)二氧化碳既不能燃烧,也不支持燃烧。
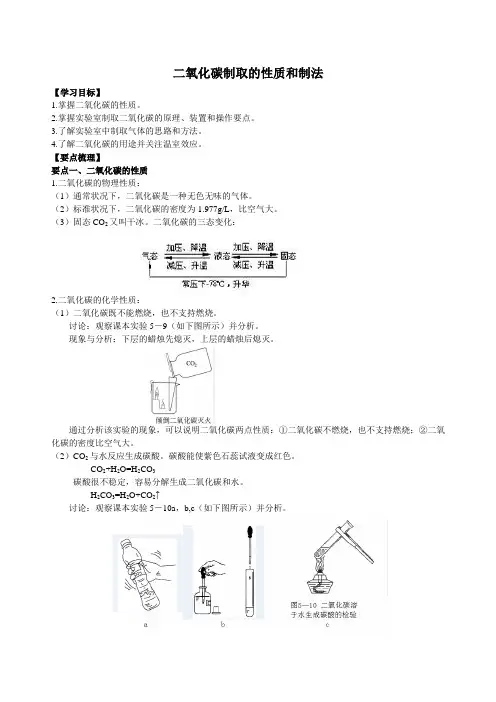
讨论:观察课本实验5-9(如下图所示)并分析。
现象与分析:下层的蜡烛先熄灭,上层的蜡烛后熄灭。
通过分析该实验的现象,可以说明二氧化碳两点性质:①二氧化碳不燃烧,也不支持燃烧;②二氧化碳的密度比空气大。
(2)CO2与水反应生成碳酸。
碳酸能使紫色石蕊试液变成红色。
CO2+H2O=H2CO3碳酸很不稳定,容易分解生成二氧化碳和水。
H2CO3=H2O+CO2↑讨论:观察课本实验5-10a,b,c(如下图所示)并分析。
现象与分析:a中塑料瓶变瘪说明二氧化碳能溶于水,1体积水中大约能溶解1体积的二氧化碳气体;b 中紫色石蕊溶液变红色,说明二氧化碳和水反应生成碳酸,碳酸具有酸性,能使紫色石蕊溶液变红;将上述试管加热后,又变成了原来的紫色,说明碳酸不稳定,又分解了。
(3)二氧化碳能与氢氧化钙反应生成白色的碳酸钙沉淀。
讨论:观察课本实验5-11(如下图所示)并分析。
现象与分析:往试管中的澄清石灰水里吹气,澄清石灰水变浑浊。
CO2与石灰水反应生成白色的碳酸钙沉淀。
常利用此性质,来检验二氧化碳气体。
Ca(OH)2+CO2=CaCO3↓+H2O(清变浊)【要点诠释】1.二氧化碳不能支持一般可燃物的燃烧,但不是所有物质,有些物质如金属镁能在二氧化碳中燃烧。
2.把CO2通入紫色石蕊试液时,会观察到紫色石蕊试液变成红色。
使紫色石蕊试液变红的不是二氧化碳,而是二氧化碳与水反应后生成的碳酸。

二氧化碳的性质及制取知识点2 二氧化碳的性质(重点)1.物理性质⑴通常状况下,二氧化碳是一种无色无味的气体。
⑵标准状况下,二氧化碳的密度为1.977g/L,比空气大。
⑶在通常情况下,二氧化碳能溶于水,1体积水中能溶解1体积的二氧化碳气体,增大气压会溶解得更多。
升高温度,二氧化碳会溶解得少一些。
①打开“可乐”等饮料瓶时看到许多气泡从饮料中逸出,就是因为压强减小了,饮料中能溶解的二氧化碳减小了;②喝“可乐”等饮料时会打嗝,就是因为喝下去的饮料温度升高,饮料中能溶解的二氧化碳减小了。
2.化学性质⑴一般情况下,二氧化碳不能燃烧,也不能支持一般可燃物的燃烧,也不能供给呼吸。
①二氧化碳不能燃烧也不支持燃烧,可用二氧化碳灭火。
②二氧化碳不供给人呼吸,所以要进入一些可能含有较高浓度的二氧化碳气体的地方,应谨防二氧化碳含量过高使人窒息,可先进行灯火实验,如灯火燃烧不旺或熄灭可知二氧化碳含量较多,人就不宜进入。
【领悟·整合】①二氧化碳不能支持一般可燃物的燃烧,但不是所有物质,有些物质如金属镁能在二氧化碳中燃烧;②二氧化碳不能供给呼吸,并不是说二氧化碳有毒。
⑵二氧化碳与水反应。
二氧化碳与水反应生成碳酸(H2CO3),H2CO3是一种弱酸,可使紫色的石蕊试液变红,且H2CO3不稳定,常温或加热条件下,易分解为H2O和CO2。
因此二氧化碳通入紫色的石蕊试液中时,由于石蕊遇到生成的碳酸而变红;加热时,由于碳酸的分解,红色试液又恢复紫色。
文字表达式如下:二氧化碳+ 水→ 碳酸碳酸−−→−加热二氧化碳+ 水CO2H2O H2CO3H2CO3CO2H2O【辨析·比较】:①这里使紫色石蕊试液变红的不是二氧化碳,而是二氧化碳与水反应后生成的碳酸,我们不能说成“二氧化碳使紫色石蕊试液变红”。
②二氧化碳能溶于水和与水发生化学反应两者在本质上是有差异的,前者是二氧化碳的物理性质,后者是二氧化碳的化学性质,当然两者又有着密切的联系。

实验室制二氧化碳【实验室常用大理石或石灰石(属混合物且主成分是CaCO3)和稀盐酸反应来制取二氧化碳】1,实验原理实验室制二氧化碳①,不用浓盐酸,因为浓盐酸具有挥发性会挥发出氯化氢气体从而使制的二氧化碳中含有HCl气体②,不用硫酸,因为硫酸与碳酸钙反应后的产物硫酸钙是微溶物,会覆盖在碳酸钙表面从而阻止反应进一步发生③,不用碳酸钠,因为碳酸钠与盐酸反应太快很难收集到气体2,反应装置3,收集装置4,某些装置气密性的检查及气密性好的现象:二氧化碳的工业制法:工业上通常采用煅烧石灰石来制取二氧化碳方程式:★检验氧气的方法; 将带火新的木条放入集气瓶中,带火星木条复燃则证明该气体是氧气☆检验二氧化碳的方法:将气体通入澄清石灰水中澄清石灰水变浑浊则证明该气体是二氧化碳(检验的化学方程式为▲检验氧气收集满的方法:将带火星的木条放到装有氧气的瓶口,带火星木条复燃则证明氧气收集满△检验二氧化碳收集满的方法:将燃着的木条放到装有二氧化碳的瓶口,燃着的木条熄灭燃则证明该气体收集满二氧化碳物理性质:无色无味,密度比空气大,易溶于水,固态二氧化碳叫干冰【干冰升华(物理变化)易吸热可用于人工降雨】二氧化碳的化学性质:1,二氧化碳与水的反应:CO2 + H2O == H2CO3(碳酸)2,与碱的反应:①CO2+2NaOH== Na2CO3 + H2O ②Ca(OH)2 + CO2 ==CaCO3 + H2O[石灰水露置于空气中表面的白膜是Ca(OH)2与CO2反应生成的CaCO3 可用酸除]鸡蛋壳和水垢里的成分也是CaCO3可与酸反应,即水垢可用酸(如食醋,盐酸除去)3,不支持燃烧也不助燃:★二氧化碳的用途:1,作气体肥料(用于光合作用) 2,人工降雨,制冷剂3,灭火4 制饮料探究二氧化碳性质的一些实验:几种物质的转化转化关系填写结论1.CO 转化CO22.CO2转化CO3.CO2转化H2CO34. CO2转化CaCO35. CaCO3转化CO2 1.2.3.4.5.。