物理化学考研知识点总结共40页文档
- 格式:ppt
- 大小:3.98 MB
- 文档页数:40

物理化学的知识点总结一、热力学1. 热力学基本概念热力学是研究能量转化和传递规律的科学。
热力学的基本概念包括系统、环境、热、功、内能、焓、熵等。
2. 热力学第一定律热力学第一定律描述了能量守恒的原理,即能量可以从一个系统转移到另一个系统,但总能量量不变。
3. 热力学第二定律热力学第二定律描述了能量转化的方向性,熵的增加是自然界中不可逆过程的一个重要特征。
4. 热力学第三定律热力学第三定律表明在绝对零度下熵接近零。
此定律是热力学的一个基本原理,也说明了热力学的某些现象在低温下会呈现出独特的特性。
5. 热力学函数热力学函数是描述系统状态和性质的函数,包括内能、焓、自由能、吉布斯自由能等。
二、化学热力学1. 热力学平衡和热力学过程热力学平衡是指系统各个部分之间没有宏观可观察的能量传输,热力学过程是系统状态发生变化的过程。
2. 能量转化和热力学函数能量转化是热力学过程中的一个重要概念,热力学函数则是描述系统各种状态和性质的函数。
3. 热力学理想气体理想气体是热力学研究中的一个重要模型,它通过状态方程和理想气体定律来描述气体的性质和行为。
4. 热力学方程热力学方程是描述系统热力学性质和行为的方程,包括焓-熵图、温度-熵图、压力-体积图等。
5. 反应焓和反应熵反应焓和反应熵是化学热力学研究中的重要参数,可以用来描述化学反应的热力学过程。
三、物质平衡和相平衡1. 物质平衡物质平衡是研究物质在化学反应和物理过程中的转化和分配规律的一个重要概念。
2. 相平衡相平衡是研究不同相之间的平衡状态和转化规律的一个重要概念,包括固相、液相、气相以及其之间的平衡状态。
3. 物质平衡和相平衡的研究方法物质平衡和相平衡的研究方法包括热力学分析、相平衡曲线的绘制和分析、相平衡图的绘制等。
四、电化学1. 电解质和电解电解质是能在水溶液中发生电离的化合物,电解是将电能转化为化学能或反之的过程。
2. 电化学反应和电势电化学反应是在电化学过程中发生的化学反应,电势是描述电化学系统状态的一个重要参数。


物理化学重要知识点总结及其考点说明
一、化学热力学
1、化学热力学的定义:化学热力学是研究化学反应中物质的热量及能量变化的学科。
2、热力学三定律:第一定律:能量守恒定律;第二定律:热力学第二定律确定有序
能可以被有度能转化;第三定律:热力学第三定律始终指出热力学反应的可能性和温度有关。
3、焓的概念:焓是衡量物质的热力学状态的量,它是物质的热力学特性连续变化的
测量,是物质拥有的热量能量,也可以视为物质拥有的有序能。
4、热力学平衡:热力学平衡是指在不变的温度、压力和其他条件下,恒定的化学反
应发生,直至反应物和生成物的物质形式和化学结构保持不变,热量吸积也变得稳定,这
种状态称为热力学平衡。
二、物理化学
1、物理化学的概念:物理化学是一门融合了物理学和化学的学科,通过应用物理方法,来研究化学性质的变化和分子间的作用及反应,其研究具有多学科的性质。
2、气体的特性:气体的物理性质有很多,如压强、体积、温度、熵、焓等。
质量和
体积的关系为:在一定温度下,气体的质量和体积都成正比。
3、溶质的溶解度:溶解度是衡量溶质溶解在溶剂中的性质,它是指在一定温度、压
力下,溶质在溶剂中的最高溶解量。
溶质的溶解度与温度,压强及溶剂特性有关。
4、化学均衡:化学均衡是指在特定温度和压强下,混合物中物质的各种浓度比例,
产物与原料之间的反应紊乱程度,变化状态的一种稳定平衡状态。

物理化学重点超强总结 doc物理化学一、物理性质1、中性:反应物在中性环境下,都呈中性,无味无色;2、不溶解:物质不被水溶解,或是被极性溶剂溶解;3、软硬:反应物可以为软物质,也可以是硬物质。
4、温和性:遇到微弱的酸碱度,反应物仍可稳定存在;5、耐热性:反应物耐温度较高,抗热性较强,热力学性质较好;6、抗寒性:反应物耐冷,能够长时间驻留在这种环境下,抗非温性的腐蚀活动。
二、化学性质1、反应物自身:反应物各自具有一定的化学性质,如碱金属、酸、碱、氧化剂等。
2、反应效应:在不同条件下考虑反应物之间的组成及活性强度,提高反应效率。
3、作用方式:主要是考虑物质凝固、溶解、混合及电离的化学反应和物质的各种性质等。
4、稳定性:考虑反应物的热力学、动力学活性,变成最稳定的化合物,增加反应的稳定性。
5、动力学:动力学说明了反应物之间相互转变时,反应速率随时间变化的规律,以及反应是否会达到较稳定的状态。
6、电化学:电化学研究反应物在电场中的表现,反应物如何受电场作用及其相互作用,表现出的特性。
三、实验方法1、量化:量化是测定反应物的实验方法,主要包括分析法,以量化的方式计算反应物的浓度;2、拉曼光谱:利用拉曼光谱的双光子散射,可以测定反应物的精细化学结构;3、红外光谱:利用红外光谱对反应物的结构和组成进行分析;4、核磁共振:核磁共振光谱是研究反应物基本结构和性质的常用实验方法;5、色谱:利用色谱法可以分析反应物的组成,和控制反应物各自的含量;6、吸收光谱:研究反应物和反应结果对它们吸收特定电子谱讯号之结果所产生的不同响应度。
总之,物理化学包括物理性质、化学性质及实验方法等,反应物的物理性质有:中性、不溶解、软硬、耐热性、抗寒性;反应物的化学性质主要有:反应物自身、反应效应、作用方式、稳定性、动力学和电化学;实验方法有量化、拉曼光谱、红外光谱、核磁共振、色谱和吸收光谱等。

物化考研知识点总结高中一、物化考研的意义物化考研是为了检验学生对物理和化学知识的掌握程度,同时也是考察学生解决问题的能力和逻辑思维能力的一种方式。
物化考研可以帮助考生更好地理解物理和化学知识,提高解决问题的能力和创新思维。
二、物化考研的基础知识点1. 物理知识点(1)力学(2)热学(3)电磁学(4)光学(5)原子物理(6)核物理2. 化学知识点(1)化学的基本概念(2)化学键与离子键(3)化学平衡(4)化学反应动力学(5)溶液化学(6)化学实验方法三、物化考研的解题技巧1. 熟练掌握基础知识物化考研的题目都是基于基础知识点的,因此要想在考试中取得好成绩,首先要对物理和化学的基础知识有很好的掌握。
要多做一些相关的练习题和模拟试题,加深对知识点的理解。
2. 理清解题思路在解题时,一定要理清思路,明确题目所涉及的知识点和解题步骤。
尤其是对于有一定难度的问题,要先分析问题的主要内容,切忌胡乱思维。
3. 注重练习通过大量的练习,可以弥补对知识点的理解不足,提升解题能力。
练习可以加深对知识点的理解,培养解题的灵活性和快速性。
四、物化考研的复习方法1. 制定合理的复习计划在复习物理和化学知识时,要制定合理的复习计划,安排好每个知识点的复习时间和重点内容。
可以根据自己的时间安排,将复习知识点合理地分配在每天的学习计划之中。
2. 多做模拟题和真题通过多做一些模拟试题和真题,可以更好地了解考试的难度和考点所在,也能提前感受一下考试的氛围,为考试做好充分的准备。
3. 多找资料学习除了课本外,还可以通过各种途径找到一些更通俗易懂的物理化学知识学习资料,加深对知识点的理解。
五、物化考研的备考心态1. 积极主动在备考的过程中,要积极主动,勇于迎接挑战。
要相信自己的能力,相信通过自己的努力,一定能够取得优异的成绩。
要坚信自己一定能够克服各种困难。
2. 冷静应对在备考过程中,难免会遇到一些挫折和困难,面对困难要冷静应对,要学会调整自己的心态,不要轻易放弃。
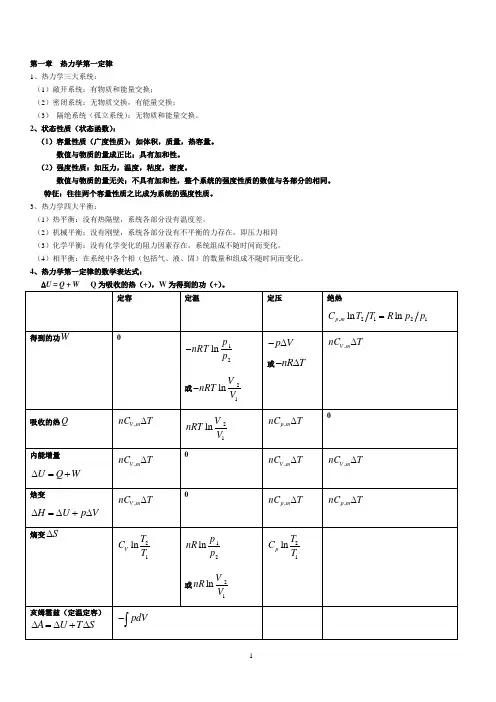
第一章热力学第一定律1、热力学三大系统:(1)敞开系统:有物质和能量交换;(2)密闭系统:无物质交换,有能量交换;(3)隔绝系统(孤立系统):无物质和能量交换。
2、状态性质(状态函数):(1)容量性质(广度性质):如体积,质量,热容量。
数值与物质的量成正比;具有加和性。
(2)强度性质:如压力,温度,粘度,密度。
数值与物质的量无关;不具有加和性,整个系统的强度性质的数值与各部分的相同。
特征:往往两个容量性质之比成为系统的强度性质。
3、热力学四大平衡:(1)热平衡:没有热隔壁,系统各部分没有温度差。
(2)机械平衡:没有刚壁,系统各部分没有不平衡的力存在,即压力相同(3)化学平衡:没有化学变化的阻力因素存在,系统组成不随时间而变化。
(4)相平衡:在系统中各个相(包括气、液、固)的数量和组成不随时间而变化。
4、热力学第一定律的数学表达式:∆U = Q + W Q为吸收的热(+),W为得到的功(+)。
12、在通常温度下,对理想气体来说,定容摩尔热容为:单原子分子系统,V m C =32R双原子分子(或线型分子)系统 ,V m C =52R多原子分子(非线型)系统 ,V m C 632R R ==定压摩尔热容:单原子分子系统 ,52p m C R =双原子分子(或线型分子)系统 ,,p m V m C C R -=,72p m C R =多原子分子(非线型)系统 ,4p m C R =可以看出:,,p m V m C C R -=13、,p m C 的两种经验公式:,2p m C a bT cT =++ (T 是热力学温度,a,b,c,c ’ 是经,2'p m c C a bT T=++ 验常数,与物质和温度范围有关)14、在发生一绝热过程时,由于0Qδ=,于是dU W δ=理想气体的绝热可逆过程,有:,V m nC dTpdV =- ⇒ 22,11lnln V m T V C R T V =- 21,12ln ,ln V m p V C Cp m p V ⇒= ,,p mV mC pV C γγ=常数 =>1. 15、-焦耳汤姆逊系数:J T T =()H pμ∂∂- J T μ->0 经节流膨胀后,气体温度降低;J T μ-<0 经节流膨胀后,气体温度升高; J T μ-=0 经节流膨胀后,气体温度不变。

物化考研知识点总结大全一、基本概念1. 物理物理学是研究自然界物质和能量以及它们之间相互作用的一门科学。
它包括经典力学、相对论、电磁学、热力学、声学、光学和量子力学等各个领域。
2. 化学化学是研究物质的组成、结构、性质、变化规律以及相关能量变化的科学。
它包括原子结构、化学键、化学反应、化学平衡、化学动力学、电化学和化学热力学等多个方面。
3. 物理化学物理化学是研究化学过程中涉及的物质物理性质、热力学、动力学等相关问题的学科。
二、基本知识1. 原子结构原子由质子、中子和电子组成。
质子质量大约为中子的两倍,电子质量远小于质子和中子。
原子的质子数等于核电荷数,电子数等于核电荷数。
原子核内的质子和中子是由高能的胶子和夸克相互作用形成的。
2. 元素周期表元素周期表是由化学家门捷列夫根据元素的性质和周期规律排列而成的。
元素周期表是由周期、族和区组成的。
周期是指在每个周期中,元素的电子层能级数增加一次;族是指原子核外电子数相同或相近的一组元素;区是指元素的主要属性相对一致的区域。
3. 化学键化学键是将两个或多个原子结合在一起形成化合物的化学力。
化学键包括离子键、共价键、金属键和氢键等。
离子键是通过离子之间的静电互相吸引力形成的;共价键是通过原子间电子的共享形成的;金属键是金属原子之间通过电子海形成的;氢键是通过氢原子与其他较电负原子的部分负电荷之间的吸引形成的。
4. 化学反应化学反应是指物质之间发生变化,原有物质消失,新物质生成的过程。
包括反应物、生成物、反应平衡、速率常数、反应速率、反应机理、反应热力学和动力学等概念。
5. 化学平衡化学平衡是指反应物和生成物的浓度、压力、温度等相对稳定的状态。
包括动态平衡、热力学平衡、化学平衡常数、平衡常数和平衡表达式等概念。
6. 化学动力学化学动力学是研究化学反应速率和反应机理的学科。
它包括反应速率常数、反应级数、速率方程、反应活化能和反应活化能图等概念。
7. 电化学电化学是研究电场和化学反应之间相互转化的学科。

物理化学每章总结 第1章 热力学第一定律及应用1.系统、环境及性质热力学中把研究的对象(物质和空间)称为系统,与系统密切相关的其余物质和空间称为环境。
根据系统与环境之间是否有能量交换和物质交换系统分为三类:孤立系统、封闭系统和敞开系统。
2.热力学平衡态系统的各种宏观性质不随时间而变化,则称该系统处于热力学平衡态。
必须同时包括四个平衡:力平衡、热平衡、相平衡、化学平衡。
3.热与功 (1) 热与功的定义热的定义:由于系统与环境间温度差的存在而引起的能量传递形式。
以Q 表示,Q>0 表示环境向系统传热。
功的定义:由于系统与环境之间压力差的存在或其它机、电的存在引起的能量传递形式。
以W 表示。
W>0 表示环境对系统做功。
(2) 体积功与非体积功功有多种形式,通常涉及到是体积功,是系统体积变化时的功,其定义为:V p Wd δe -=式中pe 表示环境的压力。
对于等外压过程 )(12e V V p W --=对于可逆过程,因ep p =,p 为系统的压力,则有Vp W V V d 21⎰-=体积功以外的其它功,如电功、表面功等叫非体积功,以W ′表示。
4.热力学能热力学能以符号U 表示,是系统的状态函数。
若系统由状态1变化到状态2,则过程的热力学增量为 12U U U -=∆对于一定量的系统,热力学能是任意两个独立变量的状态函数,即),(V T f U =则其全微分为VV U T T U U TV d d d ⎪⎭⎫ ⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂=对一定量的理想气体,则有 0=⎪⎭⎫⎝⎛∂∂TV U 或 U =f (T )即一定量纯态理想气体的热力学能只是温度的单值函数。
5.热力学第一定律及数学表达式 (1) 热力学第一定律的经典描述① 能量可以从一种形式转变为另一种形式,但在转化和传递过程中数量不变 ② “不供给能量而可连续不断做功的机器称为第一类永动机,第一类永动机是不可能存在的。
(2) 数学表达式对于封闭系统,热力学第一定律的数学表达式为W Q U δδd += 或 W Q U +=∆即封闭系统的热力学能的改变量等于过程中环境传给系统的热和功的总和。

物化考研知识点总结归纳物理化学作为考研的一门重要科目,涉及的知识点众多且复杂。
在备考过程中,对各个知识点的理解和掌握都非常关键。
本文将对物化考研中的一些重要知识点进行总结和归纳,以帮助考生更好地备考。
1. 基础概念和原理物理化学是研究物质基本性质和变化规律的学科,它涉及的基础概念和原理是理解和掌握物化知识的基础。
其中包括:- 物质的组成和结构:原子、元素、化合物等- 状态与性质:气态、液态、固态以及它们的性质对比- 化学反应:化学方程式、化学平衡等- 理想气体定律:理想气体状态方程、气体的行为模型等- 热力学:焓、熵、自由能等- 动力学:反应速率、速率方程等2. 共振结构和简并共振结构和简并是有机化学中的重要概念。
共振结构是指分子在电子转移过程中可能出现的多个等效结构,能解释某些化学现象。
简并是指分子中的能级重合,可导致一些特殊的化学性质。
考生需要对这两个概念进行深入理解和灵活应用。
3. 化学平衡和酸碱理论化学平衡是物理化学中的基本概念,涉及到化学反应过程中反应物与生成物浓度的关系。
掌握化学平衡的知识,对理解和解题非常重要。
与之相关的是酸碱理论,包括布朗斯特酸碱理论、劳里亚-布隆斯特酸碱理论等。
理解酸碱的性质和反应机制,对于理解酸碱中和过程以及溶液的酸碱性具有重要意义。
4. 电化学电化学是研究电和化学反应之间相互转化关系的学科。
在考研中,常见的电化学知识包括电解与电解质、电极、电动势、电解槽、电沉积等。
深入理解这些知识点,对于解答电化学方面的问题非常关键。
5. 光谱分析光谱分析是物理化学中一种重要的分析手段,主要基于物质吸收、散射、发射光线与物质性质之间的相互关系。
光谱分析包括紫外可见光谱、红外光谱、核磁共振光谱等。
在考研中,对光谱分析的原理和应用有一定的了解,是解答相关问题的基础。
6. 材料科学与表面化学材料科学和表面化学是物理化学的重要研究领域。
材料科学涉及材料的结构和性质,以及材料的合成和应用。

考研必备物理化学核心知识点关键信息姓名:____________________________考研年份:______________________1、热力学第一定律11 基本概念111 系统与环境112 热力学平衡态113 状态函数114 过程与途径12 热力学第一定律的表述121 内能的变化与热和功的关系122 热力学第一定律的数学表达式13 体积功的计算131 恒外压过程体积功132 可逆过程体积功14 热的计算141 定容热142 定压热143 绝热过程热的计算2、热力学第二定律21 热力学第二定律的表述211 克劳修斯表述212 开尔文表述22 熵的概念221 熵的定义222 熵的物理意义23 熵变的计算231 简单物理变化过程熵变的计算232 相变过程熵变的计算233 化学反应熵变的计算24 热力学第三定律241 热力学第三定律的表述242 规定熵和标准熵3、多组分系统热力学31 偏摩尔量311 偏摩尔量的定义312 偏摩尔量的集合公式32 化学势321 化学势的定义322 化学势的判据33 理想气体混合物331 道尔顿分压定律332 阿马格分体积定律34 稀溶液的两个经验定律341 拉乌尔定律342 亨利定律35 理想稀溶液351 溶剂的化学势352 溶质的化学势36 非理想溶液361 活度和活度系数362 超额函数4、化学平衡41 化学反应的等温方程411 标准摩尔反应吉布斯函数412 化学反应的等温方程的推导42 平衡常数的表达式421 气相反应平衡常数422 液相反应平衡常数43 平衡常数的测定和计算431 平衡组成的测定432 平衡常数的计算方法44 温度对平衡常数的影响441 范特霍夫方程442 平衡常数与温度的关系图45 其他因素对化学平衡的影响451 压力的影响452 惰性气体的影响453 反应物配比的影响5、相平衡51 相律511 相律的表达式512 相律的应用52 单组分系统相图521 水的相图522 二氧化碳的相图53 二组分系统相图531 气液平衡相图532 液固平衡相图533 生成稳定化合物的相图534 生成不稳定化合物的相图54 三组分系统相图541 等边三角形坐标表示法542 部分互溶三组分系统的相图6、电化学61 电解质溶液611 法拉第定律612 离子的电迁移613 电导、电导率和摩尔电导率614 离子独立运动定律和离子的摩尔电导率615 电导的测定及其应用62 可逆电池621 可逆电池的条件622 可逆电池的热力学623 常见的可逆电池63 不可逆电池631 不可逆电池的热力学632 电极极化633 电解时的电极反应7、表面现象71 表面张力和表面能711 表面张力的定义和单位712 表面能的概念72 弯曲液面的附加压力721 附加压力的产生原因722 拉普拉斯方程73 毛细现象731 毛细现象的原理732 毛细现象的应用74 吸附741 物理吸附和化学吸附742 吸附等温线743 朗缪尔吸附理论8、化学动力学81 化学反应速率的表示方法811 反应进度812 反应速率的定义82 浓度对反应速率的影响821 速率方程822 反应级数823 一级反应824 二级反应825 零级反应83 温度对反应速率的影响831 阿仑尼乌斯方程832 活化能84 催化剂对反应速率的影响841 催化剂的特点842 催化作用的原理9、胶体化学91 胶体的制备和净化911 分散法912 凝聚法913 胶体的净化方法92 胶体的性质921 丁达尔效应922 布朗运动923 电泳和电渗93 胶体的稳定性和聚沉931 胶体稳定性的原因932 胶体的聚沉方法933 电解质对胶体聚沉的影响以上内容涵盖了考研物理化学的核心知识点,您应根据自身实际情况有针对性地进行学习和掌握。

考研《物理化学》考研重点考点归纳第1章气体的pVT关系1.1考点归纳一、理想气体理想气体是指在任何温度、压力下符合理想气体模型,或服从理想气体状态方程的气体。
1.理想气体模型的微观特征(1)分子间无作用力;(2)分子本身不占有体积。
2.理想气体状态方程或式中,p、V、T、n的单位分别为Pa,m3,K和mol;称为气体的摩尔体积,单位为m3·mol-1;R称为摩尔气体常数,适用于所有气体,其值为8.314472J·mol-1·K-1。
该方程适用于理想气体,近似地适用于低压的真实气体。
二、实际气体1.实际气体的行为在压力较高或温度较低时,实际气体与理想气体的偏差较大。
用压缩因子(Z)衡量偏差的大小。
理想气体的,Z=1。
对实际气体,若Z>1,则,表示同温、同压下,实际气体的体积大于按理想气体方程计算的结果。
即实际气体的可压缩性比理想气体小。
当Z<1时,情况则相反。
2.Boyle温度若在温度T时,有,则称此温度T为Boyle温度TB。
3.van der waals方程式式中,的单位为Pa·m6·mol-2;b的单位为m3·mol-1。
和b都是只与气体的种类有关,而与温度无关的常数,称为范德华常数。
4.维利方程式中,A、B、C、D称为第一、第二、第三Virial(维利)系数。
三、理想气体混合物1.混合物的组成表示(1)物质B的摩尔分数x或y定义为:式中,表示混合气体总的物质的量。
一般用yB表示气体混合物的摩尔分数,用xB表示液体混合物的摩尔分数。
(2)物质B的体积分数定义为:式中,表示在一定T、p下纯气体B的摩尔体积;为在一定T、p下混合之前各纯组分体积的总和。
(3)物质B的质量分数定义为:式中,示混合气体的总质量;mB表示组分B的质量。
(4)混合物的平均摩尔质量为:式中,表示混合气体的总质量;表示混合气体总的物质的量。
上述各式适用于任意的气体混合物。
物化必备知识点总结下面就来总结一下物化必备知识点,主要包括物理化学的基本概念、物质的结构与性质、化学反应和化学平衡、物态变化、溶液和溶解度、化学动力学和电化学等方面。
一、物理化学的基本概念1. 物理化学的基本概念物理化学是研究物质结构、性质、变化规律及能量变化的科学。
它是物理和化学的交叉学科,涉及热力学、动力学、统计力学等理论。
2. 物理化学的基本单位物理化学的基本单位有摄氏度(C)、千克(kg)、焦耳(J)、摩尔(mol)、千帕(kPa)等。
3. 物理化学的基本量物理化学的基本量有温度、质量、焓,摩尔等。
温度是物质分子热运动的强弱度量,质量是物质的固有属性,焓是系统吸放热量的性质,摩尔是物质的量单位。
二、物质的结构与性质1. 物质结构物质的结构指的是物质内部原子或分子的排列方式和相互作用方式。
包括晶体、分子、离子和原子共价结构等。
2. 物质的性质物质的性质包括物理性质和化学性质。
物理性质是物质固有的性质,如密度、颜色、相态等;化学性质是物质在化学反应中的性质,如反应活性、化学稳定性等。
三、化学反应和化学平衡1. 化学反应化学反应是指物质发生化学变化的过程。
化学反应包括氧化还原反应、酸碱中和反应、置换反应、加和反应等。
2. 化学平衡化学平衡是指化学反应的速率达到一定的平衡状态。
化学平衡的特征包括不可逆性、浓度不变、速率相等等。
四、物态变化1. 固液气三态物质在一定的温度和压力下可以存在三种不同的状态,即固态、液态和气态。
液体向气体的转化称为汽化,气体向液体的转化称为凝结,固体向液体的转化称为熔化。
2. 混合和分离混合是指将两种或两种以上的相互接触的物质整合在一起,分离是指将一个混合物的成分分开。
常见的分离方法有过滤、蒸馏、结晶、离心、萃取等。
五、溶液和溶解度1. 溶液溶液是指溶质和溶剂混合在一起形成的物质。
溶质是指被溶解的物质,溶剂是指溶解溶质的物质。
2. 溶解度溶解度是指在一定温度和压力下,溶质在溶剂中的溶解量。
物理化学重点总结物理化学是研究物质的物理性质和化学变化过程的科学学科。
它涉及了物质结构、性质、能量转化和反应机理等方面的研究。
以下是物理化学的一些重点内容的总结:一、热力学:热力学研究了物质的能量转化和系统的宏观性质。
其中,热力学第一定律(能量守恒定律)表明能量既不可破坏,也不可创造,只能从一种形式转化为另一种形式。
热力学第二定律则讨论了能量转化的方向性,即自然界中过程的趋势向着增加熵(系统的无序度)的方向进行。
二、量子力学:量子力学是描述微观粒子行为的学科。
它引入了量子概念,即离散的能量级和不确定性原理。
量子力学的基本方程是薛定谔方程,描述了粒子的波函数演化。
根据波函数,我们可以计算出粒子的能量及其它性质,例如其位置和动量。
三、分子动力学:分子动力学模拟了分子在时间上的演化。
它通过牛顿运动定律和分子间相互作用力来描述分子的运动轨迹。
分子动力学模拟常用于研究化学反应的速率、粘度、热传导率等。
四、化学平衡和动力学:化学平衡是指在封闭系统中,反应物转化为产物的速率与产物转化为反应物的速率相等的状态。
化学平衡通常通过平衡常数来描述,并可由热力学第二定律得到。
化学动力学研究了反应速率及其与反应物浓度、温度和催化剂等之间的关系。
化学动力学中的活化能和反应级数等概念对于理解反应过程的速率决定因素非常重要。
五、电化学:电化学研究了电荷在溶液中传输的现象和与化学反应之间的关系。
它涉及了电化学电池、电解过程、电化学反应速率、电流等方面的研究。
电化学对于电池、腐蚀、电解制氢等应用具有重要意义。
六、光谱学:光谱学研究了电磁辐射与物质之间的相互作用。
它通过测量物质在吸收、发射或散射光束时对光的能量或波长的依赖关系,获得关于物质的信息。
常见的光谱学方法包括紫外可见吸收光谱、红外光谱和核磁共振光谱等。
物理化学的研究在许多领域都发挥着重要作用。
例如,在材料科学中,物理化学可以帮助我们设计新材料和改进材料性能。
在生物化学中,物理化学可以解释生物分子的结构和功能。
化学考研物理化学重点知识总结一、量子力学量子力学是研究微观粒子的物理学理论,它在研究原子、分子和固体等微观粒子时起着重要的作用。
以下是化学考研物理化学中的一些重点知识:1. 波粒二象性:微观粒子既可以表现出粒子的性质,如质量、位置,又可以表现出波动的性质,如波长、频率。
例如,电子、光子等都具有波粒二象性。
2. 波函数和概率密度:波函数描述了微观粒子的量子态,它的平方即为该态的概率密度。
概率密度表示了在空间中找到微观粒子的可能性大小。
3. 薛定谔方程:薛定谔方程是量子力学的基本方程,描述了微观粒子的时间演化。
求解薛定谔方程可以得到微观粒子的波函数以及相应的能量。
4. 能级和态的简并:在量子力学中,微观粒子的能量被量子化,即以能级的形式存在。
同时,某些能级可能对应多个不同的波函数,称为态的简并。
5. 角动量:角动量是微观粒子的一种重要属性,具有轨道角动量和自旋角动量两种形式。
轨道角动量与微观粒子在轨道上的运动有关,自旋角动量则与微观粒子的自旋有关。
二、化学键与分子结构化学键是原子之间的连接,它决定了分子的几何形状和性质。
以下是一些重点知识:1. 共价键:共价键是通过原子间电子的共享形成的化学键。
共价键的强度取决于电子对的共享程度,可分为单键、双键、三键等。
2. 极性键:当两个原子间的电负性差异较大时,形成的共价键就有极性。
极性键会造成分子整体的极性,影响其物理性质和化学反应。
3. 离子键:离子键是由正负电荷吸引力形成的化学键。
通常情况下,金属元素和非金属元素之间形成离子键,形成离子晶体的结构。
4. 杂化轨道理论:杂化轨道理论是描述共价键形成的重要理论。
通过对不同原子的成键轨道和空轨道进行杂化得到新的杂化轨道,以适应分子的几何构型。
5. 共价键理论:共价键理论主要分为价键理论和分子轨道理论。
价键理论强调共享电子对,而分子轨道理论则将电子视为在整个分子空间运动的。
三、化学平衡与反应动力学化学平衡和反应动力学研究了化学反应的速率和平衡状态。
物理化学考点总结.doc
物理化学考点总结
1. 热力学:热力学是物理化学的基础,包括热力学基本定律、热力学过程、热力学平衡等内容。
2. 动力学:动力学是研究反应速率和反应机理的学科,包括
反应速率、平衡常数、反应机理等内容。
3. 量子力学:量子力学是研究微观粒子行为的理论,包括波
粒二象性、波函数、量子力学方程等内容。
4. 分子结构和化学键:分子结构和化学键是研究分子构成和
化学键强度的学科,包括分子轨道理论、共价键、离子键、金属键等内容。
5. 化学平衡:化学平衡是研究反应进行到达一定平衡的状态
的学科,包括化学平衡常数、平衡条件、平衡移动等内容。
6. 电化学:电化学是研究化学与电学之间的关系的学科,包
括电解池、电化学反应、电池等内容。
7. 物态与相变:物态与相变是研究物质在不同物态下的变化
和相互转化的学科,包括气体状态方程、相变规律、溶解度等内容。
8. 表面化学:表面化学是研究物质在表面上的化学行为的学
科,包括表面吸附、表面能、催化作用等内容。
9. 光谱学:光谱学是研究光与物质相互作用的学科,包括吸收光谱、发射光谱、拉曼光谱等内容。
10. 晶体学:晶体学是研究晶体结构和性质的学科,包括晶体结构、晶体生长、晶体缺陷等内容。
第二章 热力学第一定律内容摘要热力学第一定律表述热力学第一定律在简单变化中的应用 热力学第一定律在相变化中的应用 热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式 过 程WQΔUΔH理想气体自由膨胀0 0 理想气体等温可逆-nRTln (V 2/V 1);-nRTln (p 1/p 2) nRTln (V 2/V 1);nRTln (p 1/p 2)等 容任意物质0 ∫ ∫ ΔU+V Δp 理想气体 0 △T △T △T 等 压任意物质-P ΔV ∫ ΔH -p ΔV Qp 理想气体-nR ΔT △T △T △T 理 想 气 体 绝 热过 程 (T 2-T 1);或△T△T可逆 (1/V 2γ-1-1/ V 1γ-1)p 0V 0γ/(γ-1)2、基础公式热容 =a+bT+cT 2 (附录八) 液固系统=理想气体 单原子: =5R/2 双原子: =7R/2 / =γ 理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V =• 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T =• 绝热可逆: 1122 p V p V γγ=111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程1、 可逆相变化 Q p =n Δ相变H m W = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νdT 解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。
千里之行,始于足下。
物理化学知识点总结物理化学是研究物质的性质和变化的化学分支学科,它主要关注物质的能量变化和动力学过程。
以下是对物理化学的一些重要知识点的总结:1. 原子结构:物理化学研究了原子和分子的结构和性质。
原子由原子核和绕核电子组成,原子核由质子和中子组成,而电子以不同能级分布在原子核周围。
2. 分子结构:分子由原子通过共用电子键连接而成。
物理化学研究了分子之间的化学键和键的性质,包括共价键、离子键和金属键等。
3. 热力学:热力学研究了能量的转化和传递。
其中包括能量的热力学函数,如内能、焓和自由能,以及热力学定律,如热力学第一定律和第二定律。
4. 热力学平衡:物理化学研究了热力学系统在不同条件下达到平衡的过程。
热力学平衡可以通过熵增准则来判断。
5. 化学动力学:化学动力学研究了化学反应的速率和反应机理。
它考虑了反应速率受到物质浓度、温度和催化剂等因素的影响。
6. 反应平衡:物理化学研究了化学反应达到平衡的过程。
平衡常数可以通过化学反应的热力学数据来计算。
7. 电化学:电化学研究了物质的化学反应与电荷转移之间的关系。
它包括电解质溶液的电导性、电解过程和电化学电池等。
第1页/共2页锲而不舍,金石可镂。
8. 量子化学:量子化学研究了原子和分子的量子力学行为。
它使用数学方法来描述和预测原子和分子的结构和性质。
9. 分子光谱学:分子光谱学研究了分子与电磁辐射的相互作用。
它包括红外光谱、紫外光谱和核磁共振谱等。
10. 表面化学:表面化学研究了物质与表面的相互作用。
它涉及表面吸附、催化反应和表面电化学等。
这些是物理化学中的一些重要知识点,掌握这些知识可以帮助我们理解和解释化学现象和过程。