高中化学 精准导学案 盖斯定律
- 格式:pdf
- 大小:189.08 KB
- 文档页数:3

盖斯定律(一课时)
班级:姓名:小组:。
【学习目标】
1.学生结合课本P11-12勾画盖斯定律的意义并熟记盖斯定律的内容;
2.学生结合P11盖斯定律内容,能从质量守恒和能量守恒角度进行论证;
3.学生通过对始态和终态的认识,能分析图示并求解△H,说出虚拟途径法的适用对象;
4.学生通过对P13例三的分析,找出目标方程与已知方程式的关系,利用加合法求解目标反应的热化学反应方程式。
【重点难点】
重点:熟记盖斯定律内容、利用盖斯定律书写热化学反应方程式。
难点:利用图示法及加合法求解△H。
【导学流程】
一、基础感知
1.结合课本P11第一段以及P12第二段,勾画盖斯定律的意义。
2.结合课本P11-12盖斯定律的内容,回答下列问题:
1)①记忆盖斯定律内容
②从盖斯定律得知反应热与态和态有关,与无关,与反应条件(比如加热、点燃)有关吗?与T、P有关吗?
2)根据盖斯定律的内容分析,用△H1、△H2、△H3表示
①乙→甲:△H1= . ②△H1、△H2、△H3的关系为?③∣△H1∣与∣△H3∣的关系为?
3.结合P13例三,分析解题思路,完成下列问题:1)
①写出气态乙醇生成液态水的热化学方程式;②写出液态乙醇生成液态水的热化学方程式。
③23g液态乙醇生成液态水时的反应热为?
2)已知:①P4(白磷,s)+5O2(g)===P4O10(s)ΔH1=-2 990.5 kJ·mol-1
②P(红磷,s)+
5
4O2(g)==
1
4P4O10(s) ΔH2=-738.5 kJ·mol-1求:P4(白磷,s)→P(红磷,s)的热化学方程式。

第一章化学反应与能量第三节化学反应热的计算——盖斯定律及其应用课时:2 编号:03【学习目标】1、通过阅读课本和练习掌握运用盖斯定律进行化学反应热的计算。
2、提高对热化学方程式内涵的认识,理解热量与物质的量的紧密联系。
3、通过设置恰当的问题和台阶,引导学生主动探究运用盖斯定律解决实际问题的技巧。
【学习重点】盖斯定律,应用盖斯定律进行反应热的计算。
【学习难点】盖斯定律的应用。
任务一自主学习一、盖斯定律的理解1、定义:。
ΔH、ΔH1、ΔH2的关系为。
2、意义:。
3、应用解析:例:已知① 2H2(g)+O2(g)==2H2O(g) △H1=-483.6kJ/mol② H2O(g)==H2O(l) △H2=-44kJ/mol(1)求③2H2(g)+O2(g)==2H2O(l)的△H3解析:要求反应③的热效应,分析各热化学式的关系,可知将②乘以2并与①式相加即可。
2×②2H2O(g)==2H2O(l) 2×△H2= -44×2kJ/mol+①2H2(g)+O2(g)==2H2O(g) △H1= -483.6kJ/mol③2H2(g)+O2(g)==2H2O(l) △H3= -571.6kJ/mol(2)H2的燃烧热是多少?解析:通过燃烧热的注意点可知燃烧热指的是1mol可燃物,故H2的燃烧热为285.8 kJ/mol。
【自主检测】已知下列热化学方程式:2Zn(s)+O2(g)=2ZnO(s) △H1= -702.2kJ/mol2Hg(l)+O2(g)=2HgO (s) △H2=-181.4 kJ/mol计算Zn(s)+ HgO (s)= ZnO(s)+ Hg(l)的△H值。
(模仿例题解析写出详细的计算过程)任务二拓展延伸1、已知在298K时:C(s) + 1/2 O2(g) ====CO(g) ΔH1= -110.35 kJ/molCO(g) + 1/2 O2(g) ====CO2(g) ΔH2= -282.57 kJ/mol则C(s) + O2(g) ==== CO2(g)的ΔH为多少?2、已知:(方法:根据方程式中各物质计量数.....对已知方程式进行处理,调整计量数或调整反...和位置的需要应方向。

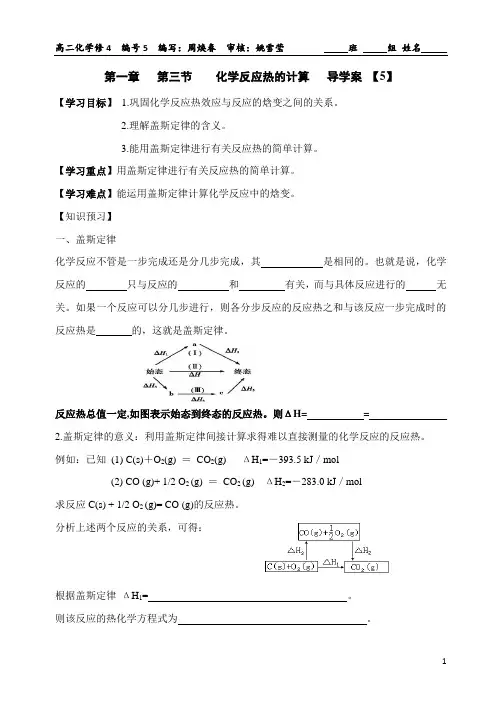
第一章第三节化学反应热的计算导学案【5】【学习目标】1.巩固化学反应热效应与反应的焓变之间的关系。
2.理解盖斯定律的含义。
3.能用盖斯定律进行有关反应热的简单计算。
【学习重点】用盖斯定律进行有关反应热的简单计算。
【学习难点】能运用盖斯定律计算化学反应中的焓变。
【知识预习】一、盖斯定律化学反应不管是一步完成还是分几步完成,其是相同的。
也就是说,化学反应的只与反应的和有关,而与具体反应进行的无关。
如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是的,这就是盖斯定律。
反应热总值一定,如图表示始态到终态的反应热。
则ΔH= =2.盖斯定律的意义:利用盖斯定律间接计算求得难以直接测量的化学反应的反应热。
例如:已知(1) C(s)+O2(g) =CO2(g)ΔH1=-393.5 kJ/mol(2) CO (g)+ 1/2 O2 (g) =CO2 (g)ΔH2=-283.0 kJ/mol求反应C(s) + 1/2 O2 (g)= CO (g)的反应热。
分析上述两个反应的关系,可得:根据盖斯定律ΔH1= 。
则该反应的热化学方程式为。
【课堂探究】例题1实验中不能直接测出由石墨和氢气生成甲烷反应的ΔH ,已知下列数据:(1)CH 4(g)+2O 2(g)=CO 2(g)+2H 2O(l) ΔH 1=-890.3kJ •mol -1 (2)C(石墨,s)+O 2(g)=CO 2(g) ΔH 2=-393.5kJ •mol -1 (3)H 2(g)+1/2O 2(g)=H 2O(l) ΔH 3=-285.8kJ •mol -1例题2计算石墨和氢气反应生成甲烷的反应热,并写出该反应的热化学方程式。
工业上制氢气的一个重要反应是:CO(g)+H 2O(g)=CO 2(g)+H 2(g),已知:(1)C(石 墨,s)+1/2O 2(g)=CO(g) ΔH 1=-111kJ •mol -1 (2)H 2(g)+1/2O 2(g)=H 2O(g) ΔH 2=-242kJ •mol -1 (3)C(石墨,s)+O 2(g)=CO 2(g) ΔH 3=-394kJ •mol -1 计算一氧化碳与水蒸气作用转化为氢气和二氧化碳反应的反应热应用盖斯定律方法小结-----1.关键:目标方程式的“加减运算式”的导出。

第1节二、盖斯定律与反应焓变的计算(第3课时)[学习要求]1.知道盖斯定律的内容,能用盖斯定律进行有关焓变的简单计算。
2.学会有关焓变计算的方法技巧,进一步提高化学计算的能力。
盖斯生平事迹:盖斯(英语:Hess's law):俄国化学家,1802年生于瑞士,1825年取得医学博士学位。
1826年弃医专攻化学。
盖斯早年从事分析化学的研究,1830年专门从事化学热效应测定方法的改进,曾改进拉瓦锡和拉普拉斯的冰量热计,从而较准确地测定了化学反应中的热量。
1836年经过许多次实验,他总结出一条规律:在任何化学反应过程中的热量,不论该反应是一步完成的还是分步进行的,其总热量变化是相同的,1840年以热的加和性守恒定律形式发表。
这就是举世闻名的盖斯定律。
盖斯定律是断定能量守恒的先驱,也是化学热力学的基础。
当一个不能直接发生的反应要求反应热时,便可以用分步法测定反应热并加和起来而间接求得。
故而我们常称盖斯是热化学的奠基人。
一盖斯定律1.盖斯定律的内容:不管化学反应是一步完成或分几步完成,其反应焓变是相同的。
或者说,化学反应的反应焓变只与反应体系的始态和终态有关,而与反应的途径无关。
2.盖斯定律的意义:有些反应的反应热通过实验测定有困难(有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯、有副反应发生),可以用盖斯定律间接计算出来。
3.盖斯定律的应用利用盖斯定律可以计算出无法或较难测定的化学反应的焓变,其方法有:(1)“虚拟路径”法:若反应物A变为生成物D,可以有两个途径:①由A直接变成D,反应焓变为ΔH;②由A经过B变成C,再由C变成D,每步的反应焓变分别为ΔH1、ΔH2、ΔH3。
如图所示:则有ΔH=ΔH1+ΔH2+ΔH3。
(2)加合法运用所给热化学方程式通过加减乘除的方法得到所求的热化学方程式。
例题1:例题:观察下面的热化学方程式(1)C(s) +O2(g)=CO2(g)ΔH1=-393.5kJ/mol(2)CO(g) +1/2O2(g)=CO2(g)ΔH3=-283.0kJ/mol思考:C(s)+1/2O2(g)==CO(g)ΔH2=?法1(“虚拟路径”法):根据盖斯定律.可以很容易求算出C(s)+O2(g)=CO(g)的ΔH。

第1课时盖斯定律学习目标1.知道盖斯定律的内容,了解其在科学研究中的意义。
2.能应用盖斯定律进行有关反应热的简单计算。
学习过程一、盖斯定律1.内容:不管化学反应是一步完成或分几步完成,其反应热是的。
或者说,化学反应的反应热只与反应体系的有关,而与反应的无关。
2.盖斯定律的重要意义:有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难。
如果应用,可以间接地把它们的计算出来。
3.盖斯定律的应用:(1)虚拟路径法若反应物A变为生成物E,可以有三个途径:①由A直接变为生成物E,反应热为ΔH。
②由A经过B变成E,反应热分别为ΔH1、ΔH2。
③由A经过C变成D,再由D变成E,反应热分别为ΔH3、ΔH4、ΔH5,如图所示:则有ΔH= = 。
(2)加合法即运用所给的热化学方程式通过加减的方法得到所求热化学方程式。
【例1】已知:①C(s)+O2(g)CO2(g) ΔH1=-393.5kJ·mol-1②CO(g)+O2(g)CO2(g) ΔH2=- 83.0kJ·mol-1求:③C(s)+O2(g)CO(g)的反应热ΔH3【例2】实验中不能直接测出由石墨和氢气生成甲烷反应的ΔH,但可测出CH4燃烧反应的ΔH1,根据盖斯定律求ΔH4。
CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH1=-890.3kJ·mol-1(1)C(石墨)+O2(g)CO2(g) ΔH2=-393·5kJ·mol-1 (2)H2(g)+O2(g)H2O(l) ΔH3=- 85.8kJ·mol-1(3)C(石墨)+2H2(g)CH4(g) ΔH4=? (4)【归纳】应用盖斯定律计算反应热时的注意事项:1.关键:设计合理的反应过程,适当加减已知方程式及ΔH。
2.突破口:看好待求方程式的化学计量数,当热化学方程式同乘或同除一个数时,ΔH也必须同乘或同除这个数。

『学习目标』通过盖斯定律求算反应焓变,【我预习-我能行】(一)盖斯定律:1、内容:2、理解要点: (1)反应焓变(反应热效应)只与 、 有关,与 无关。
(2)焓变(反应热)总值一定。
3、如何进行反应热的计算?由盖斯定律可知:反应热的大小与反应的 无关,无论是一步完成还是分几步完成,其反应热是 的。
我们可以将两个或多个热化学方程式包括其△H 相 或相 ,得到一个新的热化学方程式。
即热化学方程式可以进行加、减、乘、除四则运算。
4、做题技巧:(1)可以把方程式倒过来,注意ΔH 的符号正负变化(2)可以把方程式扩大或缩小相应倍数(3)可以把化学式对应相加减,同时ΔH 也带符号对应相加减 5、焓变的计算方法:利用已知焓变求未知焓变——热化学方程式相加减△H = △H 1 + △H 2 = △H 3 + △H 4 + △H 5【趁热打铁】自己分析书中12页例题,熟悉利用盖斯定律计算反应热 【我思考-我突破】 〖1〗(2005广东22·4) 由金红石(TiO 2)制取单质Ti ,涉及到的步骤为:TiO 2TiCl 4−−−−→−ArC /800/0镁Ti 已知:① C (s )+O 2(g )=CO 2(g ) ∆H 1 =-393.5 kJ·mol -1 ② 2CO (g )+O 2(g )=2CO 2(g ) ∆H 2 =-566 kJ·mol -1 ③ TiO 2(s )+2Cl 2(g )=TiCl 4(s )+O 2(g ) ∆H 3 =+141 kJ·mol -1 则TiO 2(s )+2Cl 2(g )+2C (s )=TiCl 4(s )+2CO (g )的∆H = 。
〖2〗发射卫星时可用肼(N 2H 4)为燃料和NO 2作氧化剂,这两者反应生成N 2和水蒸气.又已知: ①N 2(气)+2O 2(气)=2NO 2(气) △H =+67.7kJ/mol②N 2H 4(气)+O 2(气)=N 2(气)+2H 2O(气) △H =-534kJ/mol试写出肼与NO 2反应的热化学方程式 〖3〗已知下列热化学方程式:(1)Fe 2O 3(s)+3CO(g)=2Fe(s)+3CO 2(g) ΔH =-25 kJ·mol -1(2)3Fe 2O 3(s)+CO(g)=2Fe 3O 4(s)+CO 2(g) ΔH =-47 kJ·mol -1(3)Fe 3O 4(s)+CO(g)=3FeO(s)+CO 2(g) ΔH =+19 kJ·mol -1写出FeO(s)被CO 还原成Fe 和CO 2的热化学方程式 〖4〗已知下列反应的反应热为: (1)CH 3COOH (l )+2O 2(g )=2CO 2(g)+2H 2O(l) △H 1 =-870.3kJ/mol (2)C(s)+O 2(g)=CO 2(g) △H 2 =-393.5kJ/mol(3) H 2(g)+21O 2(g)=H 2O(l) △H 3 =-285.8kJ/mol试计算下列反应的反应热: 2C(s) + 2H 2(g) + O 2(g) = CH 3COOH(l) △H = 〖5〗(2010广东理综卷)在298K 、100kPa 时,已知:2H 2O(g)==O 2(g)+2H 2(g) △H 1 Cl 2(g)+H 2(g)==2HCl(g) △H 2 2Cl 2(g)+2H 2O(g)==4HCl(g)+O 2(g) △H 3 则△H 3与△H 1和△H 2间的关系正确的是( ) A .△H 3=△H 1+2△H 2 B .△H 3=△H 1+△H 2 C .△H 3=△H 1-2△H 2 D .△H 3=△H 1-△H 2 【我发现-我解决】 1.依据事实,写出下列反应的热化学方程式。


盖斯定律【学习目标】1.通过阅读课本,能复述盖斯定律的内容,解释“与途径无关”的含义。
2.阅读阅读课本,能运用盖斯定律进行简单计算。
3.通过教师讲评,能运用物质间的关系,简化方程式的加和。
4.通过阅读课本,能运用盖斯定律书写相关的热化学方程式。
【重点难点】重点:盖斯定律的内容及理解、反应热的计算难点:运用盖斯定律计算反应热【导学流程】一、基础感知(一)、盖斯定律的内容(请同学们结合课本11页,完成下列思考)(1)化学反应的反应热只与___________和___________有关,与反应的___________无关。
(2)“与途径无关”的理解:如右上图所示的过程,ΔH与ΔH1、ΔH2、ΔH3的关系?ΔH与ΔH4、ΔH5、ΔH6的关系?ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=_______(二)、盖斯定律的运用(请同学们结合盖斯定律的内容,完成下列思考)(1)运用盖斯定律求ΔH 铺路搭桥:①找出目标方程式;②找出目标方程式中各物质在已知方程式中的位置;③调整系数;④同侧相加,异侧相减已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l) ΔH1=−2220 kJ⋅mol-1②H2O(g)═H2O(l) ΔH2=−-44 kJ⋅mol-1③C3H8(g)+5O2(g)═3CO2(g)+4H2O(g) ΔH3 方程式③与①②的关系?ΔH3 为?(2)已知燃烧热求ΔH已知:CH4(g) 、H2(g)、CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8 kJ/mol、-285.0 kJ/mol,根据已知数据计算反应CH4(g)+CO2(g)===2CO(g)+ 2H2(g) △H= ;(3)运用盖斯定律书写热化学方程式近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。
过程如下:已知反应Ⅰ2H2SO4(l)═2SO2(g)+2H2O(l)+O2(g) ΔH1=+551kJ⋅mol-1反应ⅢS(s)+O2(g)═S O2(g) ΔH3=−297 kJ⋅mol-1则反应Ⅱ的热化学方程式:石家庄精英中学学生课堂导学提纲(语文2)编号:YWTG—一轮复习使用时间:2015-2-3 编制人:杨丽强高三语文第 3页 (共3页)。

盖斯定律班级姓名小组【学习目标】1.通过阅读选修4课本P11,能够准确复述盖斯定律的内容;2.通过分析课本11页图,理解盖斯定律的含义,并说出图中ΔH1、ΔH2的关系;3.通过小组讨论,总结消去化学反应中中间产物的方法和注意事项;4.通过教师讲评,总结利用盖斯定律书写目标热化学方程式的方法及注意事项。
【重点难点】重点:盖斯定律的内容及应用,图像分析,热化学方程式的书写;难点:图像分析,书写目标热化学方程式;【导学流程】一、基础感知(一)盖斯定律1.定义:不管化学反应是一步完成或分几步完成,其反应热是。
换句话说,化学反应的反应热只与反应体系的和有关,而与反应的途径。
<思考>(1)已知同温同压时,点燃条件下:H2(g)+Cl2(g)=2HCl(g) △H1 ;光照条件下H2(g)+Cl2(g)=2HCl(g) △H2,则△H1_____△H2(填“>、<或=”)(2)如图,结合课本中始终态的转化关系分析:①△H1+△H2+△H3+△H4=__________;②△H=__________________=________________________。
(二)应用1.已知①Zn(s)+1/2O2(g)=ZnO(s)△H=-348.3kJ/mol②2Ag(s)+1/2O2(g)=Ag2O(s)△H=-31.0kJ/mol则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H=_______________2.已知:H2O(g)=H2O(l)△H1 C2H5OH(g)=C2H5OH(l)△H2C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3 ,写出液态乙醇燃烧热的热化学方程式。
3.已知金刚石和石墨的燃烧热分别是-395.41kJ/mol、-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为:____________________________________,由热化学方程式可知_______(填“金刚石”或“石墨”)更稳定。

《盖斯定律》导学案一、学习目标1、理解盖斯定律的含义,能用盖斯定律进行有关反应热的简单计算。
2、通过对盖斯定律的探究,提升分析问题、解决问题的能力。
3、感受化学科学对人类生活和社会发展的贡献,激发学习化学的兴趣。
二、学习重难点1、重点(1)盖斯定律的含义和应用。
(2)利用盖斯定律进行反应热的计算。
2、难点(1)盖斯定律的理解和推导。
(2)灵活运用盖斯定律解决复杂的反应热问题。
三、知识回顾1、什么是反应热?反应热是指当化学反应在一定温度下进行时,反应所释放或吸收的热量。
2、如何测定反应热?通常使用量热计来测定反应热。
3、写出热化学方程式的书写要点。
(1)标明反应物和生成物的状态。
(2)注明反应的温度和压强(若在 25℃、101kPa 下进行,可不注明)。
(3)写出反应的焓变(△H),单位为 kJ/mol,并注明“+”或“”。
(4)热化学方程式的化学计量数可以是整数,也可以是分数,只表示物质的量。
四、新课导入在化学研究和实际应用中,我们常常需要知道化学反应的反应热。
但有些反应的反应热很难直接测量,那有没有什么方法可以帮助我们解决这个问题呢?这就需要用到盖斯定律。
五、盖斯定律的内容1840 年,俄国化学家盖斯(Hess)从大量实验中总结出一条规律:不管化学反应是一步完成或分几步完成,其反应热是相同的。
换句话说,化学反应的反应热只与反应的始态(反应物)和终态(生成物)有关,而与反应的途径无关。
例如,C(s)在 O₂(g)中完全燃烧生成 CO₂(g),可以通过两种途径来实现:途径一:C(s)+ O₂(g)= CO₂(g)△H₁=-3935 kJ/mol 途径二:C(s)+ 1/2 O₂(g)= CO(g)△H₂=-1105kJ/molCO(g)+ 1/2 O₂(g)= CO₂(g)△H₃=-2830 kJ/mol我们可以发现,通过途径一直接生成 CO₂所放出的热量,与通过途径二先生成 CO 再生成 CO₂所放出的热量是相等的,即△H₁=△H₂+△H₃。
第4讲盖斯定律【学习目标】1、盖斯定律的内容2、盖斯定律的意义3、盖斯定律的应用【学习重难点】重点:盖斯定律的理解及应用难点:盖斯定律的理解及应用【自主预习】1、请结合以下数据计算H2的燃烧热,写出表示H2燃烧热的热化学方程式?①H2(g)+1/2O2(g)=H2O(g) ΔH1=241.8kJ/mol②H2O(g)=H2O(l) ΔH2=44kJ/mol2、盖斯定律:1840年,盖斯(G.H.Hess,俄国化学家)从大量的实验事实中总结出一条规律:化学反应不管是一步完成还是分几步完成,其_____是相同的。
也就是说,化学反应的____只与反应的___和_____有关,而与具体反应进行的_____无关。
如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是_______的,这就是盖斯定律。
【合作探究】一.盖斯定律的内容1盖斯定律: 如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是一样的。
【写一写】(图 1)ΔH = _____________________(图 2)ΔH = _____________________2、反应焓变的关系B=a A ΔH2【知识检测】【典例1】很难直接测得C(s) + 1/2O2(g) = CO (g) 的反应热,但我们可通过盖斯定律获得它的反应热数据。
已知①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1②CO(g)+1/2O2(g)=CO2(g) ΔH2=-283.0 kJ·mol-1(三者的关系如图)【变式1】环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶等生产。
回答下列问题:已知:(g)= (g)+H2(g) ①ΔH1= +100.3 kJ·mol −1H2(g)+ I2(g) =2HI(g) ②ΔH2= −11.0 kJ·mol −1 对于反应:(g)+ I2(g)= (g)+2HI(g) ③ΔH3=___________kJ·mol −1。
盖斯定律(学案)1.巩固化学反应热效应与反应的焓变之间的关系2.能用盖斯定律进行有关反应热的简单计算。
1.用盖斯定律进行有关反应热的简单计算。
已知1g氢气燃烧生成液态水和气态水时分别放出kJ和kJ的热量,分别写出氢气燃烧生成液态水和气态水的热化学方程式。
_______________________________________________________________________________________________________________________________________________________________一、盖斯定律1.1840年,盖斯(G.H.Hess,俄国化学家)从大量的实验事实中总结出一条规律:化学反应不管是一步完成还是分几步完成,其_____是相同的。
也就是说,化学反应的____只与反应的___和_____有关,而与具体反应进行的_____无关。
如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是_______的,这就是盖斯定律。
2.盖斯定律在生产和科学研究中的意义【练习】下列与化学反应能量变化相关的叙述正确的是()A.生成物总能量一定低于反应物总能量B.加入催化剂,能加快化学反应速率,同时提高了反应物的平衡转化率C.应用盖斯定律,可计算某些难以直接测量的反应焓变D.需要加热才能发生的反应一定是吸热反应【练习】如图所示转化关系(X代表卤素),下列说法错误的是()A.△H2>0B.△H 3=△H 1﹣△H 2 C.按Cl、Br、I的顺序,△H3依次增大D.△H1越大,HX越稳定【练习】根据图中的信息得出的结论正确的是()A.2C(s)+O2(g)═2CO(g)△H=﹣molB.C(s)+O2(g)═CO2(g)△H=molC.CO(g)+O2(g)═CO2(g)△H=﹣molD.36g碳完全燃烧放出热量【练习】在25℃、101kPa时,已知:2H2O(g)═O2(g)+2H2(g)△H1Cl2(g)+H2(g)═2HCl(g)△H22Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3则△H3与△H1和△H2间的关系正确的是()A.△H3=△H1+2△H2B.△H3=△H1+△H2C.△H3=△H1﹣2△H2D.△H3=△H1﹣△H2【练习】已知下列热化学反应方程式为H2(g)+O2(g)═H2O(l)△H1C(s)+O2(g)═CO2(g)△H2CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H32C(s)+2H2(g)+O2(g)═CH3COOH(l)△H4则△H4的正确表达式为()A.△H3﹣2△H1﹣2△H2B.2△H1+2△H2﹣△H3C.2△H1﹣2△H2+△H3D.2△H1﹣2△H2﹣△H31.下列与化学反应能量变化相关的叙述正确的是()A.应用盖斯定律可计算某些难以直接测量的反应焓变B.放热反应的反应速率总是大于吸热反应的反应速率C.化学变化中的能量变化都是以热能形式表现出来的D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同2.已知:CH4在一定条件下可发生一系列反应,如图所示:下列说法不正确的是()A.△H1>△H5B.△H3=△H2﹣△H5C.△H1=△H2+△H3+△H4D.△H4>03.已知下列热化学方程式:2Zn(s)+O2(g)═2ZnO(s);△H1=﹣mol Hg(l)+O2(g)═HgO(s)△H2=﹣mol由此可知Zn(s)+HgO(s)═ZnO(s)+Hg(l)的△H3,其中△H3的值是()A.﹣mol B.﹣molC.﹣mol D.﹣mol4.研究化学反应原理对于生产、生活及环境保护具有重要意义.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+•mol﹣12H2O2(l)═2H2O(l)+O2(g)△H=﹣•mol﹣1H2(g)+O2(g)═H2O(l)△H=﹣•mol﹣1则H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的△H为()A.+•mol﹣1B.+•mol﹣1C.﹣•mol﹣1D.﹣•mol﹣15.已知:①2H2S(g)+SO2(g)═3S(s)+2H2O(l)△H1=﹣154 kJ•mol﹣1①S(s)+O2(g)═SO2(g)△H2=﹣297 kJ•mol﹣1①2H2S(g)+O2(g)═2S(s)+2H2O(l)△H3①2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H4下列说法正确的是()A.△H3>△H4B.△H3=+143kJ•mol﹣1C.无法计算△H4的值D.H2S 燃烧热为1045kJ•mol﹣1 6.在1200℃时,天然气脱硫工艺中会发生下列反应①H2S(g)+O2(g)═SO2(g)+H2O(g)△H1①2H2S(g)+SO2(g)═S2(g)+2H2O(g)△H2①H2S(g)+O2(g)═S(g)+H2O(g)△H32S(g)═S2(g)△H4则△H4的正确表达式为()A.△H4=(△H1+△H2﹣3△H3)B.△H4=(3△H3﹣△H1﹣△H2)C.△H4=(△H1+△H2﹣2△H3)D.△H4=(△H1﹣△H2﹣3△H3)7.2mol金属钠和1mol 氯气反应的能量关系如图所示,下列说法不正确的是()A.△H2+△H3+△H4+△H5+△H6+△H7=△H1B.△H4的值数值上和Cl﹣Cl共价键的键能相等C.△H5<0,在相同条件下,2Br(g)的△H5′<△H5D.△H7<0,其原因可能是破坏了分子间作用力,却形成了离子键【课前复习】2H2(g)+O2(g)=2H2O(l) △H=mol2H2(g)+O2(g)=2H2O(g) △H=mol【知识点填空答案】反应热;焓变;始态;终态;过程;相同【练习答案】CDCAB【检测反馈答案】1-7:ABACAAC。
有关反应热的计算---盖斯定律教学目的1、知识与技能(1)知道盖斯定律的内容。
(2)能运用盖斯定律计算反应热2、过程与方法(1)通过对盖斯定律的教学,培养观察和抽象思维的能力。
(2)通过练习思考不断提升知识应用能力。
3、情感态度与价值观培养学生由具体到抽象的研究问题的方法,使学生领会从现象到本质的认识事物的科学方法。
教学重点、难点利用盖斯定律计算反应热。
教学方法讨论、探究、归纳教学用具课件教学过程【引入】知识回顾:燃烧热中和热1、燃烧热【投影】1)定义:【投影】2)意义:2、中和热:【投影】1)定义:【投影】2)举例:3、书写热化学方程式的注意事项:【投影】(1)、按照要求先准确书写出前面的方程式部分,并标明物质的状态。
【投影】(2)、ΔH的书写,分为三部分完成。
+或者-号、数值、单位。
缺一不可。
【投影】(3)ΔH的数值一定和化学计量系数成对应关系。
【投影】例1 已知下列热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则H2(g)+1/2O2(g)===H2O(g)的ΔH=__________________2H2O(g)=== 2H2(g)+O2(g) 的ΔH=_________________【归纳】1、热化学方程式同乘以某一个数时,反应热数值也必须乘上该数。
2、将一个热化学方程式的反应物和生成物颠倒时,ΔH的“+”或“-”号必须随之改变,但数值不变。
4、考向探究盖斯定律及反应热的计算【知识梳理】【设疑】例1已知:①C(s)+O 2(g)===CO 2(g) ΔH 1= - 393.5 kJ·mol -1,② C(s)+ 1/2O 2(g)=CO(g) ΔH 2= - 110.5 kJ·mol -1,③ CO(g)+1/2O 2(g)===CO 2(g) ΔH 3= - 283.0 kJ·mol -1 ,你能从方程式叠加的角度分析这三个方程式存在的关系吗?反应热之间的数量关系呢?对方程式的意义入手分析 ,你想到了什么?【学生讨论】【讲解】从C 和O 2最终生成CO 2,不管是一步还是两步完成,反应热最终并没有发生变化,这个规律早在1840年就被俄国的化学家盖斯发现了,今天我们来学习它,只是达到了知识传承的目的。
第一章第二节第一课时《盖斯定律》学案【学习目标】1. 理解盖斯定律的含义,认识同一个化学反应的反应热与反应进行的途径无关;2. 应用盖斯定律计算生产生活中常见反应的反应热,感受定量研究的意义。
【学习过程】一、盖斯定律1.概念:一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。
2.盖斯定律有什么意义?二、案例分析案例:计算碳不完全燃烧生成CO的反应热已知:C(s)+ O2(g) = CO2(g) ∆H1=-393.5kJ/molCO(g)+ 1/2O2(g) = CO2(g) ∆H2=-283.0kJ/mol1.根据盖斯定律,设计反应路径并计算反应热。
2.反应热可以加减,方程式也可以通过加合的方式,消去某些物质。
如何调整方程式消去二氧化碳?3. 总结应用盖斯定律解题模型。
三、盖斯定律的应用学习任务1:写出肼(N2H4,液态)与NO2反应的热化学方程式【资料】火箭发射时可以用肼(N2H4,液态)做燃料,NO2做氧化剂,二者反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=2NO2(g) ∆H1 = +66.4kJ/mol②N2H4(l)+ O2(g)=N2(g)+2H2O(g) ∆H2 = -534kJ/mol学习任务2:计算煤的气化反应的反应热【资料】目前,煤在我国仍然是第一能源。
工业上通过煤的干馏、气化和液化等方法来实现煤的综合利用。
其中,煤的气化是将煤转化为可燃性气体的过程,主要反应为:C(s)+H2O(g)=CO(g)+H2(g) C(s)+ O2 (g)= CO2(g) ∆H1 = -393.5kJ/mol2CO(g)+ O2 (g)= 2CO2(g) ∆H2 = -566.0kJ/mol2H2(g)+ O2(g)= 2H2O(g) ∆H3 = -483.6kJ/mol学习任务3:研究人员提出利用含硫物质的热化学循环实现太阳能的转化与存储,过程如图1-2所示。
反应I:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ❒H1=+551kJ/mol反应III:S(s)+O2(g)=SO2(g) ❒H3=-296kJ/mol写出反应II的热化学方程式:若将反应I、II、III相加,会得到什么结果?说明什么?【学习效果】一、单项选择题I1.下类有关盖斯定律的描述不正确的是A.盖斯定律是质量守恒定律和能量守恒定律的共同体现B.根据盖斯定律,热化学方程式中ΔH直接相加即可得总反应热C.不管化学反应是一步完成或分几步完成,其反应热是相同的D.利用盖斯定律可间接计算通过实验难测定的反应的反应热2.假设反应体系的始态为甲,中间态为乙,终态为丙,它们之间的变化如图所示,则下列说法不正确的是A. |ΔH1|>|ΔH2|B. |ΔH1|<|ΔH3|C. ΔH1+ΔH2+ΔH3=0D.甲→丙的ΔH=ΔH1+ΔH23.Li-Li2O体系的能量循环如图所示,则ΔH4等于A. ΔH2+ΔH3B. ΔH1+ΔH2C. -ΔH3D. ΔH1+ΔH2+ΔH34.已知煤转化成水煤气及其燃烧过程的能量变化如图所示,则下列说法正确的是A. ΔH1+ΔH2+ΔH3=0B.ΔH1<ΔH2C.由ΔH3可知,该步反应的反应物键能总和大于生成物键能总和D.若用C(s)和H2O(l) 转化为H2(g) 和CO(g) ,则ΔH2变小-1反应的中和热ΔH =-55.6 kJ·mol -1。