2020—2021学年新人教版高中化学(2019)选择性必修1第一章盖斯定律基于核心素养的教学设计
- 格式:docx
- 大小:34.30 KB
- 文档页数:4

《盖斯定律》教学设计一、课标解读1.内容要求了解盖斯定律及其简单应用。
2.学业要求能根据盖斯定律计算反应热。
二、教材分析“盖斯定律”处于选择性必修1第一章第二节“反应热的计算”第1课时。
第一节内容在编排上先后呈现了反应热的概念,中和热的测定,热化学方程式概念及书写以及燃烧热等。
整章内容基本线索是从反应热测定、表示、计算三个方面定量研究化学反应的热效应,体现了宏观与微观的结合,并用符号进行表征。
对比原人教版教材,将中和热的测定和反应热概念放在一起,有助于学生从宏观角度理解化学反应的热效应;简单介绍燃烧热概念后,过渡到反应热的计算,通过定量计算认识反应热在生产生活中的意义。
调整后的编排顺序更加符合学生的认知规律。
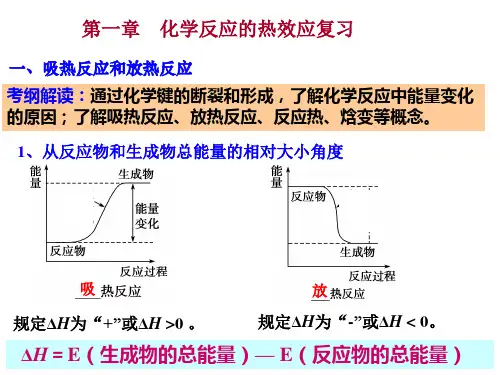
三、学情分析学生在必修教材中,已经学习了吸热反应、放热反应,知道了化学反应的能量可以与其他形式的能量进行转化,并且从定性角度认识了化学反应的能量变化取决于反应物总能量和生成物总能量的相对关系。
在微观层面,初步了解了能量变化的主要原因是化学键的断裂和形成。
本章前面的内容里,进一步学习了反应热的测定,以及用热化学方程式表示化学反应的物质和能量变化。
本节课主要引导学生应用盖斯定律,从定量角度计算化学反应的反应热。
盖斯定律的内容描述比较简单,学生缺乏对状态函数的认知,很难从理论推导的角度理解盖斯定律,同时相关的计算能力也比较弱。
四、素养目标【教学目标】1.理解盖斯定律的含义,认识同一个化学反应的反应热与反应进行的途径无关。
2.应用盖斯定律计算生产生活中常见反应的反应热,感受定量研究的意义。
【评价目标】通过生产生活中常见反应的反应热计算,诊断学生对盖斯定律的理解程度;发展学生模型认知素养。
五、教学重点、难点1.重点:盖斯定律的理解与应用。
2.难点:盖斯定律的理解。
六、教学方法类比法、讲授法、案例分析七、教学思路教学环节教学素材线教师问题线学生活动线八、教学过程环节教师活动学生活动创设情景,提出问题【提出问题】碳不完全燃烧生成CO,难以控制反应程度,不能直接测定反应热。

化学人教版(2023)选择性必修1 1.2.1盖斯定律课件(共22张ppt)(共22张PPT)第一章化学反应的热效应第二节反应热的计算第一课时盖斯定律0102运用盖斯定律进行简单计算理解盖斯定律的概念学习目标回顾旧知【回忆一】有哪些方法可以确定一个反应的反应热?① 实验法(量热计测量)----中和反应反应热的测定②宏观角度焓变计算公式:△H=H(生成物总焓)-H(反应物总焓)③微观角度焓变计算公式:△H=E(反应物断键吸收的总能量)- E(生成物成键释放的总能量)△H>0,吸热反应,焓值增大△H<0,放热反应,焓值减小【回忆二】如何判断一个化学反应是吸热反应或放热反应?方法一回顾旧知方法二:图示法判断放热反应吸热反应导入新知【思考】对于化学反应的反应热是否都可通过实验法测得?判断以下反应是否可通过实验法直接测定其反应热。
C(s)+(g)=CO (g)不能,因为燃料碳固体燃烧不可能完全转化为CO,一定有一部分碳会转化为CO2【思考】我们如何得到该反应的反应热呢?盖斯定律新知讲解1、定义:化学反应是一步完成或分几步完成,其反应热相同。
【思考】什么是盖斯定律?2、多角度理解:(爬山)化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
反应热一:盖斯定律理解3、能量守恒的角度理解始态(S)终态(L)△H1 +△H2 = 0推论:同一个热化学反应方程式,正向反应H1与逆向反应H2大小相等,符号相反,即:H1= – H2对于任何一个反应,无论反应的途径如何,其反应的能量不会凭空消失,也不会凭空产生,只会发生形式的转换。
1.反应原理H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1通过测定一定量的酸、碱溶液在反应前后温度的变化,计算反应放出的热量,由此得中和热。
一:盖斯定律理解4.图例说明从反应途径角度:A→D:ΔH=ΔH1+ΔH2+ΔH3=-(ΔH4+ΔH5+ΔH6);从能量守恒角度:ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0。

第一章化学反应的热效应第一节反应热一、反应热焓变(一)反应热及其测定1、体系与环境被研究的物质系统称为体系,与体系相互影响的其他部分称为环境。
2、反应热在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
3、实验探究:中和反应反应热的测定(1)测定原理:环境温度不变时,根据测得的体系的温度变化和有关物质的比热容等来计算反应热。
即利用公式:Q=cmΔt进行计算。
(2)实验装置①实验装置中各仪器安装如图。
②各部分仪器的作用玻璃搅拌器的作用是使反应物混合均匀充分接触。
隔热层的作用是减少热量的散失。
温度计的作用是测定反应前后反应体系的温度。
(3)实验步骤①反应物温度测量(t1):测量混合前mL0.50mol·L-1盐酸、50mL0.55mol·L-1氢氧化钠溶液的温度,取两温度平均值,记录为起始温度t1。
②反应后体系温度测量(t2):将酸碱溶液迅速混合,用玻璃搅拌器轻轻搅动溶液,并准确读取混合溶液的最高温度,记录为终止温度t2。
③重复实验操作两次,记录每次的实验数据,取其平均值作为计算依据。
(4)实验数据处理设溶液的密度均为1g·cm-3,中和后溶液的比热容c= 4.18J·g-1·℃-1,根据实验数据计算出该反应放出的热量Q≈ 1.42kJ,则生成1mol H2O时放出的热量为56.8kJ。
(5)实验结论大量实验测得,在25℃和101kPa下,强酸的稀溶液与强碱的稀溶液,发生中和反应生成1mol H2O时,放出57.3kJ的热量。
(二)反应热与焓变1、内能内能是体系内物质的各种能量的总和,受温度、压强和物质的聚集状态等影响。
3、焓与焓变(1)焓(H):是一个与内能有关的物理量。
(2)焓变(△H):在恒压下,化学反应过程中吸收或释放的热量称为该反应的焓变。
常用单位kJ/mol或kJ·mol-1。
(3)反应热与焓变的关系在等压条件下进行的化学反应的反应热等于反应的焓变,因此常用ΔH表示反应热。







2020—2021学年人教版(2019)选择性必修一章节自我强化训练 专题 盖斯定律的应用1.在1200℃时,天然气脱硫工艺中会发生下列反应 H 2S (g )+ 3/2 O 2(g )= SO 2(g )+ H 2O (g ) ΔH 1 2H 2S (g )+ SO 2(g )=3/2 S 2(g )+ 2H 2O (g ) ΔH 2 2H 2S (g )+ O 2(g )=2 S (g )+ 2H 2O (g ) ΔH 3 2S (g )= S 2(g ) ΔH 4 则△H 4的正确表达式为( ) A. ΔH 4=2/3(3ΔH 3-ΔH 1)-ΔH 2B. ΔH 4=2/3(ΔH 1+ΔH 2)+ΔH 3C. ΔH 4=2/3(ΔH 1+ΔH 2)-ΔH 3D. ΔH 4=2/3(ΔH 1-ΔH 2)-ΔH 32.已知:(1)Zn (s )+ 1/2O 2(g )=ZnO(s) ,ΔH =-350kJ ·mol -1 (2)2Ag(s) + 1/2O 2(g )=Ag 2O(s) ,ΔH = -25kJ ·mol -1 则Zn (s )+ Ag 2O(s)=ZnO(s)+ 2Ag(s)的ΔH 等于( )A .-375kJ ·mol -1B .-325kJ ·mol -1C .+375kJ ·mol -1D . +325kJ ·mol -13.下列关于反应热的说法正确的是( ) A.当ΔH <0时,表示该反应为吸热反应B. 已知:21C(s)+O (g)=CO(g) Δ=-110.5kJ/mol 2H 说明碳的燃烧热为110.5kJ/molC.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关D.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 4.已知下列数据:2Fe(s)+O2(g)=2FeO(s) ΔH=-544kJ·mol-14Al(s)+3O2(g)=2Al2O3(s) ΔH=-3350kJ·mol-1则2Al(s)+3FeO(s)=Al2O3(s)+3Fe(s)的ΔH是( )A.-859kJ·mol-1 B.+859kJ·mol-1C.-1403kJ·mol-1 D.-2491kJ·mol-15.已知有如下热化学方程式① 2C(s)+O2(g)=2CO(g) ΔH1② 2H2(g)+O2(g)=2H2O(g) ΔH2③ C(s)+ H2O(g)=CO(g) +H2(g) ΔH3则下列关系正确的是( )A.ΔH3=(ΔH1+ΔH2)/2 B.ΔH3= ΔH2-ΔH1 C.ΔH3=(ΔH2-ΔH1)/2 D.ΔH3= (ΔH1-ΔH2)/2 6.已知:氧化锂(Li2O)晶体形成过程中的能量变化如图所示下列说法正确的是( )A.ΔH1<0,ΔH2>0B.-ΔH5 +ΔH1 +ΔH1 +ΔH3 +ΔH4 +ΔH6 = 0C .ΔH 3<0,ΔH 4 < 0D .ΔH 1+ΔH 2 +ΔH 3 +ΔH 4 =ΔH 5+ΔH 67.根据能量变化示意图,下列说法不正确的是( )A.相同质量的N 2H 4(g)和N 2H 4(l),前者具有的能量较高B.相同物质的最的NO 2(g)和N 2O 4(g),后者含有的总键能较高C.ΔΗ5=ΔΗ1+ΔΗ2+ΔΗ3+ΔΗ4D.N 2H 4(l)+NO 2(g)=32N 2(g)+2H 2O(l) ΔΗ,则ΔΗ>ΔΗ48.2010年10月1日,我国在西昌卫星发射中心成功发射“嫦娥二号”。
2020-2021学年高二化学人教版(2019)选择性必修一同步课时作业 (3)盖斯定律 1.根据盖斯定律判断如图所示的物质转变过程中焓变的关系正确的是( )A.1234H H H H ∆=∆=∆=∆B.1234H H H H ∆∆=+∆∆+C.1234H H H H ++∆=∆∆∆D.1234H H H H =+∆+∆∆∆2.已知热化学方程式:C (金刚石,s )221O (g)CO (g)H +===∆; C (石墨,s )222O (g)CO (g)+=∆H ; C (石墨,s )===C (金刚石,s )3 1.9kJ /mol H ∆+。
下列说法正确的是( )A.金刚石比石墨稳定B.12H H ∆>∆C.3122∆∆=∆-H H HD. 石墨转化成金刚石的反应是吸热反应3.已知C (s )、2H (g)、3CH COOH(l)的燃烧热分别是1393.5kJ mol -⋅、1285.8kJ mol -⋅和1870.3kJ mol -⋅(注:3CH COOH 的燃烧产物是2CO 和2H O ),则反应2232C(s)2H (g)O (g)CH COOH(1)++===的H ∆为( )A.1488.3kJ mol --⋅B.1762.6kJ mol --⋅C.1654.9kJ mol --⋅D.1191kJ mol -+⋅4.2mol 金属钠和1mol 氯气反应的能量关系如图所示,下列说法不正确的是( )A.20H ∆>B.4581H H H H ∆+∆+∆=∆C. 在相同条件下,2K(g)2K (g)+→的3H H ∆<∆D.678H H H ∆+∆=∆ 5.通过以下反应可获得新型能源二甲醚(33CH OCH )。
下列说法不正确的是( ) ①1221C(s)H O(g)CO(g)H (g)kJ mol H a -+===+∆=⋅ ②12222CO(g)H O(g)CO (g)H (g)kJ mol H b -+===+∆=⋅ ③122323CO (g)3H (g)CH OH(g)H O(g)kJ mol H c -+===+∆=⋅ ④-1333242CH OH(g)CH OCH (g)H O(g)kJ?mol H d ===+∆= A. 反应①②为反应③提供原料气 B. 反应③也是2CO 资源化利用的方法之一C. 反应333211CH OH(g)CH OCH (g)H O(1)22===+的1kJ mol 2dH -∆=⋅D. 反应23322CO(g)4H (g)CH OCH (g)H O(g)+===+的1(22)kJ mol H b c d -∆=++⋅6.太阳能的开发与利用是能源领域的一个重要研究方向,由2CO 制取C 的太阳能工艺如图所示,下列有关说法正确的是(A N 代表阿伏加德罗常数的值)( )A.分解1 mol 34Fe O 转移的电子数为A 2NB.根据盖斯定律,12ΔΔ0H H +=C.FeO 在2CO 转化为C 的过程中起催化作用D.该工艺将太阳能转化为电能7.1mol 浓硫酸稀释时包含两个过程:一是部分硫酸分子分散在水里吸收热量,热效应为1H ∆;二是部分硫酸分子与水作用形成硫酸水化物释放热量热效应为2H ∆,其中具体包含以下三个变化:下列说法正确的是( )①2422423H SO (1)H O(l)H SO H O(l)H n n +===⋅∆ ②2422424H SO H O(l)H SO (aq)H O(l)n n H ⋅===+∆③22445H SO (aq)2H (aq)SO ( aq )H +-===+∆ A. 浓硫酸稀释时只有化学变化 B.120H H ∆-∆< C.50H ∆< D.2345H H H H ∆=∆+∆+∆8.在1 200 ℃ 时,天然气脱硫工艺中会发生下列反应: ①222213H S(g)O (g)SO (g)H O(g)Δ2H +=+, ②2222232H S(g)SO (g)S (g)2H O(g)Δ2H +=+,③22231H S(g)O (g)S(g)H O(g)Δ2H +=+。
盖斯定律—教学设计
课标分析: 内容要求: 1.2 了解盖斯定律及其简单应用 学业要求:能进行反应焓变的简单计算
教材分析: 本节课内容是高中化学选择性必修 1 化学反应原理第一章化学反应的热效应第二节反
应热的计算第一课时的内容,是中学化学基本理论的重要组成部分,是热化学理论性概念。
本节旨在学生了解盖斯定律,并从定量的角度来进一步认识物质发生化学反应伴随的热效 应;通过本节课的学习,学生能够了解盖斯定律并利用盖斯定律进行简单计算。
学习任务
学习活动
素养功能 评价角度 评价水平
探究盖斯定律 的内涵
深化理解盖斯 定律本质
生活模型,论 证盖斯定律
应用盖斯定 律,解决实际 问题
通过回顾 H2 标准燃烧热,完善 反应过程能量关系图,寻找热化 学方程式中物质关系和反应热 关系,从能量的角度认识物质变 化是能量变化的基础,理解盖斯 定律是能量守恒的必然结果 根据状态图示,利用盖斯定律求 始态到终态的反应热表达式,设 计 1mol 碳完全燃烧一步完成和 分步进行的途径 登山的高度与路径无关,类比盖 斯定律,反应热只与始态和终态 有关,与路径无关 利用盖斯定律计算 1mol 碳不完 全燃烧生成 CO 的反应热,解决 煤直接燃烧与转化为水煤气燃
烧两过程的反应热的大小,讨
证据推理
证据推理
模型认知
科学态度与社 会责任
探究水平 认识角度
角度进阶
思维结构化 问题解决 化学价值
单角度、多角度
物质、微粒
孤立水平、系统水平
学科价值视角、社 会价值视角、学科 和社会价值视角
论煤转化为水煤气的优点 教学目标: (1) 通过交流讨论和练习,能用盖斯定律计算反应热以及解决生产生活中的实际问题。
(2)从路径、能量守恒角度分析盖斯定律,完善“能量守恒观”,逐步构建“科学本质观”。
(3)通过化学、能量、生活模型理解盖斯定律的内涵本质,了解其意义;培养“证据推理与模 型认知”的核心素养。
(4)通过对盖斯定律的发现过程及其应用的学习,培养爱国和保护环境的情怀,渗透“科学态 度与社会责任”的学科核心素养。
评价目标: (1)通过对盖斯定律内涵探究的交流和点评,诊断并发展学生探究水平。
(2) 通过对盖斯定律本质的讨论和点评,诊断并发展学生对循环反应的反应热的认识进阶。
(3)通过对生活模型的讨论和点评,诊断并发展学生对盖斯定律认识思路的结构化水平。
(4)通过应用盖斯定律,解决实际问题的讨论与点评,诊断并发展学生对化学价值的认识
水平。
教学流程
知识线
问题线
活动线
素养线
H2+1/2O2=1/2H2O(g) ΔH=-241.8KJ/mol
思考如何计算氢气的标
该热化学方程式中的反应热是 H2 的标准燃
准燃烧热,回忆燃烧热
烧热吗?
的定义
证
要知道 H2 的标准燃烧值还需要哪个数据?
推
据
盖斯定律的内涵
利用两个反应热的加
理
观察三个反应热 ΔH 有什么关系?这是偶然 现象还是必然结果?
和,求 H2 的标准燃烧 热,引出盖斯定律,总 结得出盖斯定律的内涵
盖斯定律本质 论证盖斯定律 应用盖斯定律
从 S 到 L,和从 L 到 S,ΔH1 与 ΔH2 有什么 关系?
根据状态图示,求出
1mol 碳完全燃烧一步
完成和分步进行的反应
模
为什么 2 者之和为 0,如果不为 0,违背了
热,深化理解盖斯定律
型
什么?
认
知
什么是盖斯定律?怎样理解盖斯定律?
登山的高度与路径无 关,类比盖斯定律,用 生活模型,论证盖斯定
生活中有哪些现象也遵循这一能量变化规
科
律?
利用盖斯定律计算
学
请用盖斯定律计算碳不完全燃烧的反应热?
1mol 碳不完全燃烧生 成 CO 的反应热,知道 一些无法用实验测定的 反应热,借助盖斯定律
态 度 与 社
可以直接计算出来。
会
责
任
教学过程
活动元 1 证据推理 引出盖斯定律
时间 2min 4min 7min
5min
教师活动
学生活动
设计意图
请 同 学 观 察 下 面 热 化 学 方 程 式 : H2 (g)+1/2O2(g)=1/2H2O(g) ΔH1=-241.8KJ/mol 在反应过程能量图中标注反应物和 生成物的能量; 问:该热化学方程式中的反应热是 H2 的标准燃烧热吗?
思考,回答问题:
H2O(g) H2O(l)
追问:如果要计算 H2 的标准燃烧值 燃烧热:1mol 可燃物完全燃烧生成稳定化合
还需要哪个数据?
物时所放出的热
已知:H2O(g)= H2O(l)
1mol 气态水转化为液态水时所放的热
ΔH2=-44KJ/mol,请同学们是写出氢 书写热化学方程式,完善能量图:
气标准燃烧热的热化学方程式,并完 H2(g)+1/2O2(g)=1/2H2O(g)
善能量图。
ΔH3=-285.8KJ/mol
提问:观察思考三个 ΔH 有什么关系, 思考,回答问题:ΔH3 = ΔH1 + ΔH2
三个方程式之间又有怎样的关系?
方程式 3 等于方程式 1 加方程式 2
设问:这是偶然现象还是必然结果? 假设一个体系从始态到终态的反应
ΔH1 ‹0
热 ΔH1 ‹ 0;问:从终态到始态的 ΔH2 与 0 是什么关系?ΔH1 与 ΔH2 的和 是多少呢? 追问:为什么二者之和等于 0?如果
ΔH2>0
S(始态) ΔH1 + ΔH2 = 0
L(终态)
不等于 0,违背了什么?
违背质量守恒定律
归纳总结:经历一个循环后,体系中
的反应物并没有改变,能量也不可能 总结:反应物和生成物确定,能力就确定,与
变化。
出现上述现象是必然结果! 反应途径无关。
阅读教材 p13 页,盖斯定律的内容 阅读教材,完善笔记
回忆燃烧热 的定义,求 H2 的标准燃烧 热,引出盖斯 定律,从能量 守恒的去理 解盖斯定律 的内涵
活动元 2 模型认知 理解定律本质
引导学生分析 ΔH1
求从始态到终态采用不同路径的 ΔH 值,这些值之间有怎样的关系?
始态 S
A ΔH2
ΔH
L 终态
练习巩固
ΔH3 BΔH4 CΔH5 DΔH6
ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5+ΔH6 ΔH2=ΔH - ΔH1 设计方案:
根据状态图 示分析,练习 碳完全燃烧 一步完成和 分步进行的 反应热,深化 理解盖斯定 律
4min 4min
若有一个反应体系为 1mol 的碳,完 全燃烧生成 CO2,请同学们分别设计 一步完成和分步进行的途径,思考不 同途径的反应热有什么关系? 提问:生活中有没有类似的实例,也 遵循这一能量变化规律?
一步:C(s)+ O2(g) = CO2(g) ΔH 两步: C(s)+ 1/2O2(g) = CO(g) ΔH1
CO(g)+ 1/2O2(g) = CO2(g) ΔH2 ΔH=ΔH1+ΔH2 小组讨论交流:生活中的登山现象,物理中 的势能、高度、做功等
8min 4min
活动元 3 应用定律 解决实际问题
过渡:有同学可能疑问,学了这么久 的盖斯定律有什么用呢?反应热不 是可以通过实验方法测定吗? 设疑:碳不完全燃烧的产物为一氧化 碳,该过程的反应热用实验能否测 定?为什么? 碳和一氧化碳的燃烧热我们都可以 通过实验测定,那可否利用其求出碳 不完全燃烧的产物为一氧化碳的反 应热呢?(碳和一氧化碳完全燃烧的 燃烧热分别为-393.5 KJ/mol 和-283.0 KJ/mol)
引导学生分析求解
问:代数加减法中,计算所求反应的 焓变,如何找出可用的已知热化学方 程式? 追问:1、如何确定已知反应的加和减 2、如何消去目标反应物中没有的物 质? 总结:一些无法用实验测定的反应 热,借助盖斯定律可以直接计算出 来。
思考,回答问题:
不能,因为生成一氧化碳的同时,有部分一 氧化碳会转化成二氧化碳。
根据碳和一氧化碳的燃烧热,设计方案求: 碳不完全燃烧的产物为一氧化碳的反应热 方案: C(s)+ O2(g)=CO2(g)ΔH1=-393.5 KJ/mol ① CO(g)+1/2O2(g)=CO2(g)ΔH2=-283KJ/mol② ①-②得 C(s)+ 1/2O2(g) = CO(g) ΔH3=-110.5KJ/mol
小组讨论: 总结:目标物质,已知中找,同向加,异向减 过渡物,要消去,同侧加,异向减 焓变关系:系数同,不用官,系数不同,焓变 不同。
通过具体的 实例,认识盖 斯定律的价 值,通过巩固 练习,学会应 用盖斯定律
练习巩固:教材 p17 页 4、6 题 总结、布置作业
完成练习 回忆本节课内容
板书设计:盖斯定律 1、 内容: 2、 论证: 3、 应用:
。