8.氯、溴、碘性质的递变性实验
- 格式:doc
- 大小:31.05 KB
- 文档页数:2

一、实验目的1. 了解氯、溴、碘三种元素的性质及其氧化性的强弱。
2. 掌握氯、溴、碘氧化性的比较方法。
3. 培养实验操作能力和分析问题的能力。
二、实验原理氧化性是指物质夺取其他物质电子的能力。
氯、溴、碘三种元素在周期表中同属卤族元素,其氧化性随原子序数的增加而减弱。
本实验通过比较氯、溴、碘与碘化钾、溴化钾反应,观察四氯化碳层颜色变化,来比较三种元素的氧化性强弱。
三、实验药品与仪器1. 实验药品:氯水、溴水、碘水、碘化钾溶液、溴化钾溶液、四氯化碳、淀粉碘化钾试纸。
2. 实验仪器:试管、胶头滴管、烧杯、酒精灯、石棉网。
四、实验步骤1. 将少量氯水滴入试管中,加入1 mL四氯化碳,振荡,静置,观察四氯化碳层颜色。
2. 将少量溴水滴入试管中,加入1 mL四氯化碳,振荡,静置,观察四氯化碳层颜色。
3. 将少量碘水滴入试管中,加入1 mL四氯化碳,振荡,静置,观察四氯化碳层颜色。
4. 将少量碘化钾溶液滴入试管中,加入氯水,振荡,静置,观察溶液颜色变化。
5. 将少量溴化钾溶液滴入试管中,加入氯水,振荡,静置,观察溶液颜色变化。
6. 将少量碘化钾溶液滴入试管中,加入溴水,振荡,静置,观察溶液颜色变化。
7. 将淀粉碘化钾试纸分别滴加氯水、溴水、碘水,观察试纸颜色变化。
五、实验结果与分析1. 氯水滴入四氯化碳中,四氯化碳层呈浅黄色;溴水滴入四氯化碳中,四氯化碳层呈橙红色;碘水滴入四氯化碳中,四氯化碳层呈紫红色。
由此可知,氯的氧化性最强,其次是溴,最后是碘。
2. 氯水滴入碘化钾溶液中,溶液颜色变为浅棕色;溴水滴入溴化钾溶液中,溶液颜色变为浅棕色;碘水滴入碘化钾溶液中,溶液颜色无变化。
由此可知,氯的氧化性大于碘,溴的氧化性大于碘。
3. 氯水滴入溴化钾溶液中,溶液颜色变为浅棕色;溴水滴入碘化钾溶液中,溶液颜色变为浅棕色。
由此可知,氯的氧化性大于溴,溴的氧化性大于碘。
4. 氯水、溴水、碘水滴加在淀粉碘化钾试纸上,试纸颜色分别变为蓝色、紫色、无色。

比较氯溴碘的性质递变规律氯、溴、碘是常见的卤素元素。
它们在化学性质上有许多相似之处,但也有自己的特点。
本文将比较分析氯、溴、碘的一些性质,包括物理性质、化学性质、反应活性等,找出它们的递变规律,以增进对这三种元素的了解。
物理性质相态三种元素的常温下处于不同的物态,具体如下:•氯:气体•溴:液体•碘:固体这与它们的原子序数有关:氯的原子序数最小,碘的原子序数最大,因此氯原子间的吸引作用最小,碘原子间的吸引作用最大。
这种差别导致氯在常温下不容易凝固,而碘则容易凝固为固体。
密度三种元素的密度也有所不同:•氯:1.56 g/L•溴:3.12 g/mL•碘:4.94 g/mL由于密度与物质质量以及体积成反比,因此在等体积的情况下,碘的质量最大。
这也使得碘在实验室中常用来制备碘化钾等试剂。
化学性质氧化还原性氯、溴、碘都是强氧化剂,但它们分别在不同的反应条件下体现不同的氧化还原性:•氯:在室温下与许多物质可以剧烈反应,如氢气、铁、铝等。
它的氧化态多为-1状态,如盐酸中的氯离子Cl-。
•溴:较为活泼,在有机合成中常用于卤化反应。
它的氧化态多为-1或+1状态,在盐酸中表现为Br-。
•碘:比较不活泼,常用于空气氧化剂、褪色剂和灭菌剂等。
它的氧化态多为0或+1状态,在碘酒中为I2。
溶解性氯、溴、碘都不易溶于水。
以氯为例,相对于氯的极性,水的极性更大,在水中离子化或水化的程度不高,因此溶解度不高。
相比之下,溴和碘的分子间相互吸引力更强,所以在水中的离子化程度和溶解度就更低。
卤素氟化反应除氟以外的卤素都可以和氟反应,生成相应的氟化合物。
氟音似“非”,它的反应活性最高,可以和其他卤素在室温下反应,而其他卤素则需要高温条件下反应。
以氯为例,它的氟化反应式为:Cl2 + F2 → 2ClF类似地,溴、碘也可以和氟反应,这种反应是卤素之间递变规律的体现。
反应活性活泼程度氯、溴、碘的反应活性各有不同,由高到低排列为氯 > 溴 > 碘。

氯、溴、碘化学活泼性的探究
一、教学目标
<知识与技能>
1)理解氯、溴、碘单质的化学活泼性相似性和递变性。
2)知道氯、溴、碘原子结构相似性和递变性。
3)理解氯、溴、碘单质间的置换反应。
<过程与方法>
1)通过金属活泼性强弱,利用类比的方法,设计实验方案。
2)利用实验结论结合原子结构,体会到结构决定性质的重要化学规律。
3)通过氯、溴、碘性质的对照实验,经历根据实验现象作出结论的过程。
<情感、态度价值观>
1)通过小组实验体验共同合作、分享喜悦的快乐。
2)通过实验报告书写养成学生认真踏实的学习态度和学习习惯。
3)通过实验让学生体验科学探究的一般过程。
二、教学重点、难点
重点:氯、溴、碘的原子结构及性质的相似性和递变性。
氯、溴、碘单质间的置换反应。
难点:实验探究。
三、教学方法
实验、比较、讨论、归纳
四、教学过程
课后思考题:
阅读课本P42表2.2(卤素单质的物理性质),课本P44资料库(氯、溴、碘的单质和氢气的化合),并寻找其他有关资料,证明氯、溴、碘性质的相似性和递变性。

知识点8——氯、溴、碘单质活泼性比较一、知识疏理1、卤素单质在物理性质上的主要差异和递变规律F2Cl2Br2I2颜 色:淡黄绿色 黄绿色 深棕红色 紫黑色 (颜色逐渐加深)水中溶解性: 反应 溶解(少量反应)微溶 难溶 (溶解度减小)熔 沸 点: (气态) (气态) (液态) (固态) (由低到高)2、卤素化学性质的相似性和递变性(1)相似性① 卤素单质与氯气相似,都能跟金属、非金属(如P、H2等)、水、碱等物质反应:Zn+I2ZnI2(水作催化剂)(特殊反应,反应过程中能看到紫色蒸气,这说明了什么问题?)Fe+I2 → FeI2(不能生成FeI3)(表明I2的活泼性比Cl2、Br2、F2弱)(所以,盛碘的试剂瓶不能用铁盖。
)Br2+2NaOH→NaBr+NaBrO+H2O② 化合价相似:均有-1价,除氟外,均有+1、+3、+5、+7价。
如:HF、HBrO(次溴酸)、NaIO3(碘酸钠)、HClO4(高氯酸)。
(就知道各种价态,会写不同价态的物质的化学式。
)③ 形成气态氢化物的化学式相似,可表示为HX。
HX均易溶于水,形成氢卤酸,HX在空气中均形成白雾。
(2)递变性按氟、氯、溴、碘顺序单质氧化性:逐渐减弱。
(除氟外,其它的卤素单质也有弱还原性)卤离子(X-)还原性:逐渐增强。
(F-不能被常见的氧化剂氧化。
)气态氢化物(HX)稳定性:逐渐减弱。
(会从键长解释吗?)气态氢化物(HX)还原性:逐渐增强。
(HBr、HI能被常见的氧化剂氧化)氢卤酸酸性:增强。
(只有氢氟酸是弱酸)最高价氧化物水化物(HXO4)酸性:减弱。
(氟没有含氧酸,高氯酸为无机酸中酸性最强的酸)(3)卤素间的置换反应(略)注意:F2能从熔融状态下的卤化物中置换出其他卤素,而在水溶液中F2更易与水发生反应。
3、氟的特殊性① F原子半径小,获得电子能力强,无正价,无含氧酸。
F2是氧化性最强的非金属单质。
② F2与H2反应剧烈,低温、黑暗处妈会发生爆炸。

卤族元素实验报告卤族元素实验报告卤族元素是化学元素周期表中的第17族元素,包括氟、氯、溴、碘和砹。
它们在化学性质上有一些共同的特点,如高电负性、强氧化性和较高的沸点。
本次实验旨在探究卤族元素的一些性质和反应,并观察它们在实验条件下的表现。
实验一:氯气的制备与性质首先,我们使用盐酸和过氧化氢反应制备氯气。
实验中,我们将盐酸和过氧化氢混合,并通过一个导管将产生的氯气收集起来。
我们观察到氯气呈黄绿色,有刺激性气味,并能漂浮在空气中。
这表明氯气是一种具有较高密度的气体,因此可以用于消毒和漂白。
接下来,我们将氯气通入一杯装有水的容器中。
我们观察到氯气与水反应生成了盐酸和次氯酸。
这是一种典型的氧化还原反应,其中氯气被还原为盐酸,而水被氧化为次氯酸。
这个实验进一步证实了氯气的强氧化性。
实验二:溴的性质与反应在这个实验中,我们将砷酸银溶液滴加到溴水中。
我们观察到溴水逐渐变成了淡黄色,而砷酸银溶液变成了棕色。
这是因为溴水中的溴离子与砷酸银中的银离子发生了置换反应,生成了不溶于水的砷酸银沉淀。
这个实验表明溴是一种具有较强氧化性的元素。
实验三:碘的性质与反应在这个实验中,我们将碘晶体加热,观察到碘晶体逐渐升华成紫色的气体。
这是碘的典型性质,碘在常温下升华成气体而不融化。
我们还将一小块碘晶体放入碘酒中,观察到碘晶体逐渐溶解,使碘酒变为深蓝色。
这是因为碘与碘酒中的碘化钾反应生成了碘离子,从而改变了溶液的颜色。
实验四:卤素的氧化性在这个实验中,我们将氯、溴和碘分别与钠溶液反应。
我们观察到氯与钠反应生成了氯化钠,溴与钠反应生成了溴化钠,而碘与钠反应生成了碘化钠。
这表明卤素的氧化性随原子序数的增加而增强。
总结:通过本次实验,我们对卤族元素的性质和反应有了更深入的了解。
我们观察到氯气具有强氧化性和刺激性气味,溴水可以与银离子发生置换反应,而碘可以升华成气体并与碘酒发生反应。
此外,我们还发现卤素的氧化性随原子序数的增加而增强。
卤族元素在生活中有广泛的应用。

2021届高三化学一轮复习——氯、溴、碘的制备与性质核心知识梳理一、卤素单质的相似性、递变性和特殊性 1.相似性(1)都能与大多数金属反应:2Fe +3X 2=====点燃2FeX 3(I 2除外)。
(2)都能与H 2反应生成HX 。
(3)都能与H 2O 反应:X 2+H 2OHX +HXO(F 2、I 2除外)。
(4)都能与碱液反应:X 2+2NaOH===NaX +NaXO +H 2O(F 2、I 2除外)。
2.递变性F 2 Cl 2 Br 2 I 2颜色:――――――――――――――――――→浅黄绿色 黄绿色 深红棕色 紫黑色逐渐加深 熔、沸点:―――――――――――――――→气体 气体 液体 固体逐渐升高 密度:―――――――――――――――→逐渐增大 水溶性:――――――――――――――――→反应 溶解 溶解 微溶逐渐减小 氧化性:―――――――――――――→ (与H 2化合或与水反应由易到难)逐渐减弱 还原性(X -):―――――――――――――――→逐渐增强 3.特殊性(1)Br 2是常温下唯一呈液态的非金属单质;液溴易挥发且有毒,通常用水液封保存。
(2)I 2易升华,淀粉遇I 2显蓝色;I 2易与Na 2S 2O 3溶液反应:I 2+2S 2O 2-3===2I -+S 4O 2-6,用于通过滴定实验(以淀粉溶液为指示剂)来定量测定碘的含量。
(3)Br 2和I 2都可被某些有机溶剂(如四氯化碳)萃取。
(4)氟元素无正价,F 2与H 2O 发生置换反应生成O 2(2F 2+2H 2O===4HF +O 2),F 2与Xe 、Kr 等稀有气体反应生成白色氟化物。
二、Cl 2、Br 2、I 2之间的置换氯、溴、碘单质的氧化性强弱是Cl 2>Br 2>I 2,阴离子的还原性强弱是Cl -<Br -<I -,因此能发生如下反应:Cl 2+2Br -===2Cl -+Br 2; Cl 2+2I -===2Cl -+I 2; Br 2+2I -===2Br -+I 2。

氯溴碘实验实验报告高一化学实验报告高一化学实验报告班级姓名座号【预习思考】1、Fe2、Fe3的检验方法有几种?2、实验室制取NH3的原理是什么?NH4+怎么检验?++3、SO42-用什么试剂检验?4、Cl、Br、I的检验方法有几种?5、为什么可以用CCl4萃取I2?---【实验内容】一、Fe2、Fe3的检验++二、氨及铵盐的性质2三、硫酸根的检验四、氯、溴、碘的性质345篇二:实验报告篇三:卤族元素实验报告卤族元素性质复习重点1。
卤素单质在物理性质和化学性质上的主要差异及递变规律;2。
卤族元素的化合物性质的递变性;3。
卤化银的性质、用途及碘与人体健康的关系。
4。
重点考查卤素性质的变化规律。
1。
氯气[氯气的物理性质](1)常温下,氯气为黄绿色气体。
加压或降温后液化为液氯,进一步加压或降温则变成固态氯。
(2)常温下,氯气可溶于水(1体积水溶解2体积氯气)。
(3)氯气有毒并具有强烈的刺激性,吸入少量会引起胸部疼痛和咳嗽,吸入大量则会中毒死亡。
因此,实验室闻氯气气味的正确方法为:用手在瓶口轻轻扇动,仅使少量的氯气飘进鼻孔。
[氯气的化学性质]氯原子在化学反应中很容易获得1个电子。
所以,氯气的化学性质非常活泼,是一种强氧化剂。
(1)与金属反应:cu + c12cucl2实验现象:铜在氯气中剧烈燃烧,集气瓶中充满了棕黄色的烟。
一段时间后,集气瓶内壁附着有棕黄色的固体粉末。
向集气瓶内加入少量蒸馏水,棕黄色固体粉末溶解并形成绿色溶液,继续加水,溶液变成蓝色。
2na + cl 22nacl 实验现象:有白烟产生。
说明:①在点燃或灼热的条件下,金属都能与氯气反应生成相应的金属氯化物。
其中,变价金属如(cu、fe)与氯气反应时呈现高价态(分别生成cucl2、fecl3)。
②在常温、常压下,干燥的氯气不能与铁发生反应,故可用钢瓶储存、运输液氯。
③“烟”是固体小颗粒分散到空气中形成的物质。
如铜在氯气中燃烧,产生的棕黄色的烟为cucl2晶体小颗粒;钠在氯气中燃烧,产生的白烟为nacl晶体小颗粒;等等。

一、实验目的1. 了解氯、溴、碘的化学性质。
2. 比较氯、溴、碘的氧化性强弱。
3. 掌握使用四氯化碳作为萃取剂的方法。
二、实验原理氯、溴、碘均为卤素元素,具有较强的氧化性。
在本实验中,通过氯、溴、碘的氧化还原反应,可以观察到不同卤素单质的生成。
同时,利用四氯化碳作为萃取剂,可以将生成的卤素单质从水溶液中萃取出来,便于观察和比较其氧化性强弱。
三、实验材料1. 实验药品:NaCl溶液、KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸。
2. 实验仪器:试管、量筒、胶头滴管、振荡器、水浴锅。
四、实验步骤1. 取一支试管,加入2mL NaCl溶液,滴加1滴氯水,振荡,静置。
观察四氯化碳层颜色变化。
2. 取一支试管,加入2mL KBr溶液,滴加1滴氯水,振荡,静置。
观察四氯化碳层颜色变化。
3. 取一支试管,加入2mL KI溶液,滴加1滴氯水,振荡,静置。
观察四氯化碳层颜色变化。
4. 取一支试管,加入2mL KI溶液,滴加1滴溴水,振荡,静置。
观察四氯化碳层颜色变化。
5. 取一支试管,将淀粉碘化钾试纸浸入碘水中,观察试纸颜色变化。
6. 取一支试管,加入2mL KBr溶液,滴加1滴氯水,振荡,静置。
观察四氯化碳层颜色变化。
五、实验结果与分析1. 在步骤1中,氯水与NaCl溶液反应,四氯化碳层颜色由无色变为淡黄色,说明氯的氧化性强于溴和碘。
2. 在步骤2中,氯水与KBr溶液反应,四氯化碳层颜色由无色变为橙红色,说明氯的氧化性强于溴。
3. 在步骤3中,氯水与KI溶液反应,四氯化碳层颜色由无色变为深紫色,说明氯的氧化性强于碘。
4. 在步骤4中,溴水与KI溶液反应,四氯化碳层颜色由无色变为红棕色,说明溴的氧化性强于碘。
5. 在步骤5中,淀粉碘化钾试纸浸入碘水中,试纸变蓝,说明碘具有氧化性。
6. 在步骤6中,氯水与KBr溶液反应,四氯化碳层颜色由无色变为橙红色,说明氯的氧化性强于溴。
综上所述,氧化性从强到弱的顺序为:氯 > 溴 > 碘。

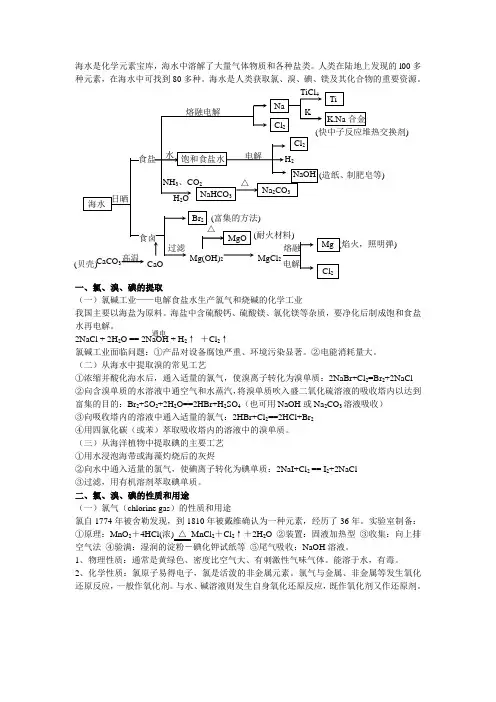
海水是化学元素宝库,海水中溶解了大量气体物质和各种盐类。
人类在陆地上发现的l00多种元素,在海水中可找到80多种。
海水是人类获取氯、溴、碘、镁及其化合物的重要资源。
一、氯、溴、碘的提取(一)氯碱工业——电解食盐水生产氯气和烧碱的化学工业我国主要以海盐为原料。
海盐中含硫酸钙、硫酸镁、氯化镁等杂质,要净化后制成饱和食盐水再电解。
2NaCl + 2H 2O == 2NaOH + H 2↑ +Cl 2↑氯碱工业面临问题:①产品对设备腐蚀严重、环境污染显著。
②电能消耗量大。
(二)从海水中提取溴的常见工艺①浓缩并酸化海水后,通入适量的氯气,使溴离子转化为溴单质:2NaBr+Cl 2=Br 2+2NaCl ②向含溴单质的水溶液中通空气和水蒸汽,将溴单质吹入盛二氧化硫溶液的吸收塔内以达到富集的目的:Br 2+SO 2+2H 2O==2HBr+H 2SO 4(也可用NaOH 或Na 2CO 3溶液吸收) ③向吸收塔内的溶液中通入适量的氯气:2HBr+Cl 2==2HCl+Br 2④用四氯化碳(或苯)萃取吸收塔内的溶液中的溴单质。
(三)从海洋植物中提取碘的主要工艺①用水浸泡海带或海藻灼烧后的灰烬②向水中通入适量的氯气,使碘离子转化为碘单质:2NaI+Cl 2 == I 2+2NaCl③过滤,用有机溶剂萃取碘单质。
二、氯、溴、碘的性质和用途(一)氯气(chlorine gas )的性质和用途氯自1774年被舍勒发现,到1810年被戴维确认为一种元素,经历了36年。
实验室制备:①原理:MnO 2+4HCl(浓) △ MnCl 2+Cl 2↑+2H 2O ②装置:固液加热型 ③收集:向上排空气法 ④验满:湿润的淀粉-碘化钾试纸等 ⑤尾气吸收:NaOH 溶液。
1、物理性质:通常是黄绿色、密度比空气大、有刺激性气味气体。
能溶于水,有毒。
2、化学性质:氯原子易得电子,氯是活泼的非金属元素。
氯气与金属、非金属等发生氧化还原反应,一般作氧化剂。

一、实验目的1. 探究卤素单质及其化合物的性质及其递变规律;2. 了解卤素元素在元素周期表中的位置及性质变化;3. 培养学生的实验操作能力和分析问题、解决问题的能力。
二、实验原理卤族元素位于元素周期表的第VIIA族,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
它们的最外层电子数为7,具有强烈的氧化性。
本实验通过观察卤素单质及其化合物的性质,分析卤素元素性质的递变规律。
三、实验材料与仪器1. 实验材料:氟化钠(NaF)、氯化钠(NaCl)、溴化钠(NaBr)、碘化钠(NaI)、浓硫酸(H2SO4)、浓盐酸(HCl)、浓硝酸(HNO3)、碘酒、淀粉溶液、蒸馏水、酒精灯、试管、滴管、镊子、试管夹、玻璃片等。
2. 实验仪器:分析天平、酒精灯、烧杯、玻璃棒、滴定管、烧瓶、试管等。
四、实验步骤1. 卤素单质性质的观察(1)观察氟、氯、溴、碘的颜色、状态和气味;(2)将卤素单质分别滴入水中,观察溶解情况和颜色变化;(3)将卤素单质分别滴入淀粉溶液中,观察反应现象。
2. 卤素氢化物的性质(1)将NaF、NaCl、NaBr、NaI分别加入蒸馏水中,观察溶解情况和溶液颜色;(2)分别用滴管吸取少量NaF、NaCl、NaBr、NaI溶液,加入浓硫酸,观察反应现象;(3)分别用滴管吸取少量NaF、NaCl、NaBr、NaI溶液,加入碘酒,观察反应现象。
3. 卤化银的溶解性、稳定性和卤素离子的检验(1)将NaCl、NaBr、NaI分别加入蒸馏水中,观察溶解情况和溶液颜色;(2)分别用滴管吸取少量NaCl、NaBr、NaI溶液,加入硝酸银溶液,观察沉淀颜色;(3)分别用滴管吸取少量NaCl、NaBr、NaI溶液,加入稀硝酸,观察沉淀溶解情况。
五、实验结果与分析1. 卤素单质性质的观察(1)氟、氯、溴、碘颜色分别为浅黄绿色、黄绿色、深红棕色、紫黑色,状态分别为气态、气态、液态、固态,气味分别为刺激性、刺激性、有腐蚀性、有腐蚀性;(2)卤素单质在水中溶解,溶液颜色分别为无色、浅黄绿色、黄棕色、棕色;(3)卤素单质与淀粉溶液反应,溶液变蓝色。
氯溴碘实验实验报告氯溴碘实验实验报告一、引言氯溴碘是一种常见的无机化合物,由氯、溴和碘三种元素组成。
本次实验的目的是通过合成氯溴碘,探究其物理性质和化学性质,进一步了解化学元素的特性。
二、实验方法1. 实验材料和仪器本次实验所需材料和仪器有:氯气、溴液、碘酒、烧杯、滴管、试管、玻璃棒等。
2. 实验步骤(1)将烧杯置于实验台上,加入适量的溴液。
(2)用滴管滴加碘酒到溴液中,同时用玻璃棒搅拌均匀。
(3)将烧杯放置在通风橱中,向其中通入氯气。
(4)观察溴液的颜色变化,并记录结果。
三、实验结果在通入氯气的过程中,溴液的颜色逐渐变淡,最终变成淡黄色。
实验结束后,得到了氯溴碘化合物。
四、实验讨论1. 氯溴碘的物理性质氯溴碘是一种固体化合物,具有淡黄色的颜色。
它的熔点为XXX摄氏度,沸点为XXX摄氏度。
在常温下,氯溴碘呈现为结晶状固体。
2. 氯溴碘的化学性质氯溴碘具有一定的化学活性。
它可以与其他物质发生反应,产生新的化合物。
例如,当氯溴碘与氧气反应时,会生成氯氧溴化合物。
当与金属反应时,会生成相应的金属氯溴碘化合物。
3. 实验中的观察结果在实验过程中,我们观察到溴液的颜色逐渐变淡,最终变成淡黄色。
这是因为氯气与溴液中的溴发生反应,生成了氯溴碘化合物。
实验结果与我们的预期相符。
4. 实验中的注意事项在进行氯溴碘实验时,需要注意以下几点:(1)实验操作时要戴上防护眼镜和手套,避免直接接触有害物质。
(2)氯气具有刺激性气味和毒性,实验过程中要确保通风良好,避免吸入过量氯气。
(3)实验结束后,要妥善处理废弃物品,避免对环境造成污染。
五、实验总结通过本次氯溴碘实验,我们成功合成了氯溴碘化合物,并观察到了其颜色变化。
实验结果与我们的预期相符。
通过实验,我们进一步了解了氯溴碘的物理性质和化学性质,加深了对化学元素的认识。
六、参考文献[1] XXX,XXX. XXX实验原理与操作[M]. 北京:XXX出版社,20XX年。
[2] XXX,XXX. XXX化学实验指南[M]. 北京:XXX出版社,20XX年。
氯溴碘的实验报告氯溴碘的实验报告引言:氯溴碘是一种重要的无机化合物,具有广泛的应用领域。
本实验旨在通过合成氯溴碘,并对其性质进行分析和探究。
实验材料和方法:材料:1. 溴水2. 氯化钠溶液3. 碘酸钠溶液4. 氯化钾溶液5. 玻璃容器6. 实验室器具:量筒、试管、滴管等方法:1. 取一定量的溴水,加入适量的氯化钠溶液,搅拌均匀。
2. 将碘酸钠溶液滴加到上述混合物中,同时观察颜色变化。
3. 持续搅拌,加入氯化钾溶液,直到颜色变浅。
4. 将反应物转移到玻璃容器中,放置一段时间,观察沉淀形成情况。
实验结果:在实验过程中,我们观察到溴水与氯化钠溶液混合后,溶液呈现橙黄色。
随着碘酸钠溶液的滴加,溶液颜色逐渐变为红色。
最后加入氯化钾溶液后,颜色变浅为淡黄色,并出现了一定的沉淀。
实验分析:氯溴碘的合成反应是一种氧化还原反应。
在实验中,溴水中的溴离子(Br-)被氯化钠中的氯离子(Cl-)取代,形成氯溴离子(BrCl-)。
而碘酸钠溶液则提供了氧化剂的作用,将氯溴离子进一步氧化为氯溴碘(BrClI)。
实验中的沉淀是氯溴碘的产物之一。
氯溴碘在溶液中的溶解度较低,因此在反应过程中会逐渐沉淀出来。
沉淀的形成是由于溶液中的离子浓度超过了饱和度,导致溶解度下降,从而形成固体沉淀。
结论:通过本实验,我们成功合成了氯溴碘,并观察到了其颜色变化和沉淀的形成。
氯溴碘是一种重要的无机化合物,在光敏材料、医药、农业等领域有着广泛的应用。
本实验的结果对于深入研究氯溴碘的性质和应用具有一定的参考价值。
实验的局限性和改进方向:1. 实验过程中,我们没有进行氯溴碘的定性分析,只是通过颜色变化和沉淀的形成来判断合成结果。
可以进一步使用化学分析方法,如红外光谱、质谱等,对合成产物进行鉴定和分析。
2. 实验中的溶液浓度和反应条件可能对合成结果产生影响。
可以进一步优化实验条件,探究最佳的反应条件,提高合成效率和产物纯度。
3. 实验中的沉淀形成情况可能受到其他因素的干扰,如溶液的pH值、温度等。
实验目的:1. 了解卤族元素置换反应的基本原理。
2. 观察卤族元素之间的置换反应现象。
3. 通过实验验证卤族元素活动性顺序。
实验原理:卤族元素包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At),它们在元素周期表中位于第七主族。
卤族元素具有强烈的氧化性,可以与许多金属发生置换反应,生成相应的卤化物。
在卤族元素中,氟的活动性最强,依次递减。
本实验通过观察不同卤素与金属钠的置换反应,验证卤族元素的活动性顺序。
实验材料:1. 金属钠2. 氯化钠溶液3. 溴化钠溶液4. 碘化钠溶液5. 烧杯6. 试管7. 滴管8. 玻璃棒9. 酒精灯10. 稀硝酸实验步骤:1. 将金属钠切成小块,用滤纸吸去表面的煤油。
2. 取一支试管,加入少量氯化钠溶液,用滴管滴加少量金属钠,观察反应现象。
3. 用另一支试管,加入少量溴化钠溶液,重复步骤2,观察反应现象。
4. 用第三支试管,加入少量碘化钠溶液,重复步骤2,观察反应现象。
5. 将上述三种溶液分别加入稀硝酸中,观察是否有沉淀生成。
6. 将金属钠加热至熔融状态,分别与氯化钠、溴化钠、碘化钠反应,观察反应现象。
实验现象:1. 氯化钠溶液中加入金属钠,产生大量气泡,溶液颜色变为无色。
2. 溴化钠溶液中加入金属钠,产生大量气泡,溶液颜色变为淡黄色。
3. 碘化钠溶液中加入金属钠,产生大量气泡,溶液颜色变为深棕色。
4. 将氯化钠、溴化钠、碘化钠溶液分别加入稀硝酸中,均无沉淀生成。
5. 将金属钠加热至熔融状态,与氯化钠反应,生成白色固体;与溴化钠反应,生成浅黄色固体;与碘化钠反应,生成深棕色固体。
实验结果分析:1. 氯化钠溶液中加入金属钠,生成氯化钠和氢气,反应方程式为:2Na + 2HCl → 2NaCl + H2↑。
2. 溴化钠溶液中加入金属钠,生成溴化钠和氢气,反应方程式为:2Na + 2NaBr → 2NaBr + H2↑。
3. 碘化钠溶液中加入金属钠,生成碘化钠和氢气,反应方程式为:2Na + 2NaI → 2NaI + H2↑。