磷化氢PH3
- 格式:pdf
- 大小:258.22 KB
- 文档页数:9

磷化氢检测报告
磷化氢(PH3)是一种无色、有毒、易燃的气体,常用于杀虫剂、膨胀剂等工业用途。
磷化氢的检测报告通常包括以下内容:
1. 报告编号:用于唯一标识该份报告。
2. 检测目的:说明为何进行磷化氢的检测。
3. 检测日期:指出进行检测的具体日期。
4. 检测地点:指出进行检测的具体地点。
5. 检测方法:描述进行磷化氢检测所采用的方法和设备。
6. 检测结果:列出磷化氢的浓度结果,常用单位为parts per million(ppm)或mg/m³。
7. 参考标准:根据相关法规或行业标准,说明磷化氢浓度是否符合安全要求。
8. 分析和评价:对检测结果进行分析和评价,如评估是否存在安全风险以及可能的影响。
9. 建议措施:根据检测结果和评价,提出相应的安全措施和建议,如通风设施改进、个人防护措施等。
10. 检测人员:列出进行检测的人员姓名和单位。
11. 备注:对于检测过程中发现的任何特殊情况或注意事项进
行说明。
12. 签字和日期:检测人员或相关负责人的签字和日期。
以上是一份典型的磷化氢检测报告的基本内容,具体报告内容可能因检测目的和要求而有所不同。
需要根据实际情况进行检测和报告编制。

磷化氢的吸收光谱
磷化氢(PH3)是一种无色易燃气体,在紫外-可见光区域(200-800 nm)具有吸收特性。
磷化氢的吸收光谱可以通过分光光度计或紫外可见分光光度计进行测量。
磷化氢的吸收光谱主要包括两个区域:紫外吸收区和可见光吸收区。
在紫外吸收区,磷化氢的吸收峰通常出现在200-300 nm范围内。
在可见光吸收区,磷化氢的吸收峰通常出现在400-600 nm范围内。
磷化氢的吸收光谱具有一些特征峰,这些峰可以用来确定磷化氢的存在和浓度。
然而,由于磷化氢的吸收强度较弱,需要使用高灵敏度的仪器进行测量。
需要注意的是,磷化氢是一种有毒气体,具有剧毒和易燃性。
在进行磷化氢吸收光谱测量时,应采取必要的安全措施,并在适当的实验室环境下进行操作。

磷化的反应方程式
磷化的反应方程式有很多种,其中一种最常见的磷化反应是磷化氢(PH3)的合成反应,如下所示:
4P + 3NaOH + 3H2O → PH3 + 3NaH2PO2
这个反应是通过将金属磷和钠氢氧化物混合,加水并加热来进行的。
在该反应中,磷和钠氢氧化物反应生成磷化氢和磷酸氢钠。
另一个常见的磷化反应是磷化镓的合成反应,如下所示:
2Ga + 3P → GaP
这个反应是通过将镓和磷在高温下反应而成。
在该反应中,镓和磷反应生成磷化镓。
还有其他一些磷化反应,如磷化铝、磷化镁等的合成反应,具体的反应方程式可以根据具体的反应物和条件来确定。

高纯磷化氢
高纯磷化氢是指纯度较高的磷化氢(PH3),通常用于半导体工业、化学气相沉积(CVD)、太阳能电池生产等领域。
磷化氢是一种无色、有毒、易燃的气体,其化学式为PH3。
高纯度的磷化氢通常需要去除杂质,以确保其在半导体生产等高技术领域的应用质量和稳定性。
生产高纯度磷化氢的方法包括:
1. 化学合成法:通过化学反应制备高纯度的磷化氢。
这种方法通常需要高纯度的磷源和氢气,通过适当的反应条件,如温度、压力和催化剂等,可以得到高纯度的磷化氢。
2. 气体分离法:使用物理或化学方法分离杂质气体,以提高磷化氢的纯度。
这包括使用吸附剂、膜分离、冷凝和净化柱等技术,去除磷化氢中的杂质气体,从而提高其纯度。
3. 电化学方法:通过电解或电化学反应产生高纯度的磷化氢。
这种方法通常需要使用高纯度的电解质和电极材料,控制反应条件以确保产物的纯度。
4. 气相化学反应法:利用气相化学反应来制备高纯度的磷化氢。
这种方法可以在适当的反应条件下,将适当的原料气体转化为磷化氢,并通过适当的分离和纯化步骤提高其纯度。
高纯度磷化氢的应用广泛,包括半导体工业中的化学气相沉积、太阳能电池生产、半导体材料生长等领域,对气体纯度和稳定性要求较高。
因此,在生产和应用过程中需要严格控制气体的纯度和质量。
1/ 1。

磷化氢测试
磷化氢(分子式PH3)是一种无色气体,具有强烈的恶臭味道。
它是由磷原子和三个氢原子组成的分子。
磷化氢是一种极易燃和有毒的物质,在室温下会与氧气反应生成磷酸,因此需要在通风良好的环境中进行测试。
磷化氢的测试可以通过多种方法进行,以下是几种常见的测试方法:
1. 气体检测仪:使用专用的气体检测仪来检测磷化氢的浓度。
气体检测仪通常具有高灵敏度和快速响应的特点,可以准确地测量磷化氢的浓度,并发出警报以提醒操作人员。
2. 化学试剂:磷化氢可以与许多化学试剂反应生成可见的颜色变化或气体产物。
例如,可以使用海尔伯特试剂(一种含有蒽酮和硫酸的溶液)来检验磷化氢的存在。
磷化氢与海尔伯特试剂反应会产生紫红色的溶液。
3. 火焰测试:磷化氢在点燃时会产生明亮的气体火焰,并发出绿色的荧光。
可以通过点燃一小量磷化氢气体来确认其存在。
无论使用何种方法,测试操作应当谨慎,并遵循安全操作规程。
在测试磷化氢时,务必保证通风良好,并使用适当的个人防护装备。
如果不具备必要的实验条件和专业知识,建议咨询专业机构或实验室进行测试。

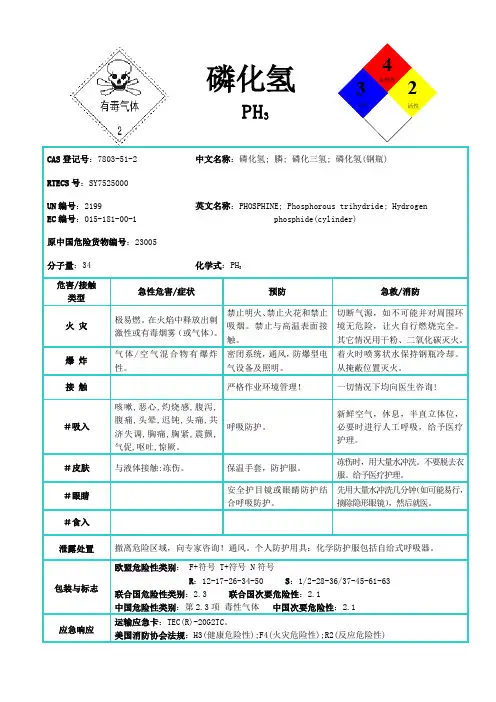
磷化氢标识中文名磷化氢;膦英文名hydrogen phosphide;Phosphine分子式 PH3相对分子质量 34.04CAS号 7803—51—2危险性类别第2.3类有毒气体化学类别非金属氢化物二主要组成与性状主要成分纯品外观与性状五色,有类似大蒜气味的气体。
主要用途用于缩合催化剂,聚合引发剂及制备磷的有机化合物等。
三健康危害侵入途径吸入。
健康危害磷化氢作用于细胞酶,影响细胞代谢,发生内窒息。
其主要损害神经系统,呼吸系统、心脏、肾脏及肝脏。
10 mg/m3接触6小时,有中毒症状;409~846mg/m3时,半至1小时发生死亡。
急性中毒:轻度中毒,病人有头痛、乏力、恶心、失眠、口渴、鼻咽发干、胸闷、咳嗽和低热等;中度中毒,病人出现轻度意识障碍、呼吸困难、心肌损伤;重度中毒则出现昏迷、抽搐、肺水肿及明显的心肌、肝脏及肾脏损害。
四急救措施皮肤接触眼睛接触吸入迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
·食入五燃爆特性与消防燃烧性易燃闪点(℃) 无意义爆炸下限(%) 无资料引燃温度(℃) 100爆炸上限(%) 无资料最小点火能(mJ) 无资料最大爆炸压力(MPa) 无资料危险特性极易燃,具有强还原性。
遇热源和明火有燃烧爆炸的危险。
暴露在空气中能自燃。
与氧接触会爆炸,与卤素接触激烈反应。
与氧化剂能发生强烈反应。
灭火方法消防人员必须佩戴过滤式防毒面具(全面罩)或隔离式呼吸器、穿全身防火防毒服,在上风处灭火。
切断气源。
若不能立即切断气源,则不允许熄灭正在燃烧的气体。
喷水冷却容器,可能的话将容器从火场移至空旷处。
灭火剂:雾状水、泡沫、干粉、二氧化碳。
六泄漏应急处理迅速撤离泄漏污染区人员至上风处,并立即隔离450m,严格限制出入。
切断火源。
建议应急处理人员戴自给正压式呼吸器,穿防毒服。
尽可能切断泄漏源。
合理通风,加速扩散。
喷雾状水稀释、溶解。

ph3分解温度ph3分解温度指的是磷化氢(PH3)分解为磷和氢气的温度。
磷化氢是一种无色有毒气体,常用于半导体工业和实验室中。
了解磷化氢的分解温度对于安全操作和应用具有重要意义。
本文将就ph3分解温度进行探讨。
我们来了解磷化氢的性质。
磷化氢的化学式为PH3,是由一个磷原子和三个氢原子组成的分子。
它的分子量为34.00 g/mol,沸点约为-87.7°C,熔点约为-133.5°C。
磷化氢是一种剧毒气体,具有刺激性气味,并能引起呼吸系统和眼睛的刺激。
因此,在使用磷化氢时必须采取适当的防护措施。
磷化氢的分解温度是指磷化氢分解为磷和氢气的温度。
磷化氢分解的化学方程式为:2PH3 → 2P + 3H2。
根据这个方程式,我们可以看出,一个磷化氢分子分解为一个磷原子和三个氢原子。
磷是一种非金属元素,具有较高的燃烧性。
而氢气是一种易燃气体,与空气中的氧气可以发生燃烧反应。
磷化氢分解的温度是受多种因素影响的。
首先,温度是影响反应速率的重要因素之一。
一般来说,温度升高会加快反应速率,而温度降低则会减慢反应速率。
因此,磷化氢的分解温度应该在一定范围内进行控制,以保证反应的进行和安全。
反应的催化剂也会影响磷化氢的分解温度。
催化剂可以降低反应的活化能,使反应更容易发生。
在磷化氢分解的过程中,可以添加一些催化剂,如金属催化剂或过渡金属催化剂,来促进反应的进行。
这样可以降低磷化氢的分解温度,提高反应的效率。
磷化氢的分解温度还受到压力的影响。
一般来说,压力升高会增加反应速率,而压力降低则会减慢反应速率。
因此,在磷化氢分解的过程中可以通过调节压力来控制反应速率和分解温度。
根据文献报道,磷化氢的分解温度大约在500-800°C之间。
实际上,磷化氢的分解温度是与反应条件密切相关的。
除了温度、催化剂和压力外,反应时间、反应物浓度等因素也会对磷化氢分解的温度产生影响。
因此,在实际应用中,需要根据具体的反应条件来确定磷化氢的分解温度。


磷化氢分解方程式磷化氢(PH3)是一种无色、有毒、易燃的气体,其化学式为PH3。
它是由磷和氢气在高温高压条件下反应生成的。
磷化氢在自然界中存在,也可以通过人工制备。
磷化氢的物理性质如下:1.颜色:无色2.气味:具有刺激性气味3.熔点:-84.2℃4.沸点:-61.6℃5.密度:0.64 kg/m(气态,0℃)6.溶解性:不易溶于水,易溶于有机溶剂磷化氢在空气中容易燃烧,生成五氧化二磷(P4O10)和水(H2O)。
其化学方程式为:4PH3 + 5O2 → 2P4O10 + 6H2O磷化氢的分解反应主要受到温度、压力、催化剂等因素的影响。
在工业生产中,通常采用加热分解的方法,使磷化氢分解为磷和氢气。
反应方程式为:2PH3 → P2 + 3H2磷化氢分解在农业和工业领域具有广泛的应用。
在农业中,磷化氢作为一种农药,可以有效地杀灭土壤中的害虫和微生物。
其使用方法包括土壤熏蒸和种子处理。
土壤熏蒸是将磷化氢气体注入土壤中,通过分解产生的磷和氢气对土壤进行消毒。
种子处理则是将磷化氢气体熏蒸在种子上,以杀死附着在种子表面的害虫和病原菌。
在工业领域,磷化氢分解可用于制备磷酸盐、磷化合物等化学品。
例如,在磷酸盐工业中,磷化氢可作为原料用于生产磷酸。
然而,磷化氢具有高度毒性,对人体和环境具有很大危害。
因此在磷化氢分解过程中,必须采取严格的安全和环保措施。
1.防护措施:操作人员应穿戴防护设备,如口罩、防护眼镜、防护服等。
同时,要确保通风良好,降低磷化氢浓度。
2.环保措施:磷化氢分解产生的废气需经过处理,达到国家排放标准。
处理方法包括活性炭吸附、催化燃烧等。
此外,还需对废水、废渣进行妥善处理,避免对环境造成污染。
总之,磷化氢分解方程式及其应用涉及农业、工业等多个领域。

磷化氢分解方程式摘要:一、磷化氢简介1.磷化氢的定义2.磷化氢的用途二、磷化氢分解反应1.磷化氢分解方程式2.反应条件三、磷化氢分解产物1.磷化氢分解的主要产物2.副反应及可能的杂质四、磷化氢分解的应用1.用于实验室研究2.工业生产中的应用五、磷化氢分解的安全措施1.实验室操作注意事项2.工业生产中的安全措施正文:磷化氢(Phosphine),是一种无色、有毒的气体,化学式为PH3。
磷化氢在许多化学反应中都有重要作用,尤其是在有机合成中,它经常被用作还原剂或氧化剂。
此外,磷化氢还被广泛应用于杀虫剂、熏蒸剂等领域。
磷化氢的分解反应可表示为:PH3 → P + 2H2。
这是一个自发性反应,可以在常温下进行。
分解反应主要发生在磷化氢暴露在空气中的情况下,其分解产物为磷和氢气。
需要注意的是,在高温、高压或存在催化剂的情况下,磷化氢的分解反应会加速进行。
磷化氢分解的主要产物是磷(P),它是一种非金属元素,在许多化学反应中具有重要作用。
除了磷之外,还可能产生一些副反应产物和杂质,如磷化氢酸(H3PO2)和磷化氢酸盐(H3PO3-)。
磷化氢分解在实验室和工业生产中都有广泛应用。
在实验室中,磷化氢的分解被用于研究气相中磷的化学反应,以及磷化氢与其他物质的相互作用。
在工业生产中,磷化氢的分解被用于制备磷和磷化合物,如磷酸、磷酸盐等。
由于磷化氢具有毒性,因此在实验操作和工业生产中都需要特别注意安全措施。
在实验室中,应避免直接接触磷化氢,并确保通风良好。
在工业生产中,应使用专门的设备来处理磷化氢,并确保工人穿戴适当的防护装备。
磷化氢水解反应方程式
磷化氢水解反应方程式:
PH3 + 3H2O → H3PO3 + 3H2
磷化氢(PH3)与水(H2O)发生水解反应时,生成磷酸(H3PO3)和氢气(H2)。
在反应中,一个磷化氢分子与三个水分子反应,形成一分子磷酸和三分子氢气。
这个反应的方程式表明了反应物和生成物的摩尔比例。
当一个磷化氢分子与三个水分子反应时,生成一分子磷酸和三分子氢气。
这是一个化学方程式,用于描述反应物与生成物之间的关系。
化学方程式用化学符号表示反应物与生成物的种类和数量。
磷化氢水解反应是一种化学反应,是磷化氢分子与水分子之间的化学变化。
在水解反应中,磷化氢和水发生化学反应,产生磷酸和氢气。
这个反应是在一定条件下进行的,通常需要适当的温度和触媒来催化反应的进行。
磷化氢水解反应的方程式描述了该反应的化学过程。
通过了解反应物与生成物之间的摩尔比例,我们可以推断出反应的化学性质和产物。
这个方程式提供了关于反应物和生成物之间的化学关系的信息,以及反应过程中的物质转化。
总结而言,磷化氢水解反应方程式为:PH3 + 3H2O → H3PO3 + 3H2。
这个方程式描述了磷化氢和水之间的化学反应,生成磷酸和氢气。
了解反应物与生成物之间的关系对于理解和研究化学反应是非常重要的。
磷化氢中磷的化合价
磷化氢是一种重要的有机化合物,它是由氢原子和磷原子组成的化合物。
磷化
氢的化学式为PH3,它是一种无色气体,有刺激性气味。
磷化氢中磷的化合价是3。
磷化氢是一种重要的有机化合物,它在化学反应中起着重要的作用。
它可以用
来制备磷酸盐,也可以用来制备磷酸酯。
磷化氢也可以用来制备磷酸根,这些磷酸根可以用来制备各种有机化合物。
磷化氢中磷的化合价是3,这意味着磷原子可以与3个氢原子结合。
磷原子的
电子结构是3s2 3p3,它有5个电子可以参与化学反应。
磷原子可以与3个氢原子
结合,形成PH3分子,这就是磷化氢的结构。
磷化氢是一种重要的有机化合物,它在化学反应中起着重要的作用。
它的化学
式为PH3,磷原子的化合价是3,它可以与3个氢原子结合,形成PH3分子。
磷化
氢可以用来制备磷酸盐、磷酸酯和磷酸根,这些物质可以用来制备各种有机化合物。
磷化氢的威力研究磷化氢在半导体工业中的应用磷化氢的威力研究及其在半导体工业中的应用磷化氢(PH3)是一种有机磷化合物,由一个磷原子和三个氢原子构成。
作为一种无色气体,磷化氢在半导体工业中具有广泛的应用。
本文将重点探讨磷化氢的威力研究以及其在半导体工业中的应用。
一、磷化氢的威力研究磷化氢作为一种高能源化合物,具有极强的还原性和易燃性,因此在研究其威力时需要极其小心谨慎。
科学家们通过对磷化氢的分子结构进行分析和模拟,研究了其分子间的相互作用和化学反应。
实验结果表明,磷化氢可以在特定条件下发生爆炸,造成严重的安全威胁。
因此,在磷化氢的处理和应用过程中,必须采取严格的安全措施,确保工作环境的安全和人员的身体健康。
二、磷化氢在半导体工业中的应用磷化氢在半导体工业中发挥着重要的作用,特别是在制备磷化镓(GaP)等半导体材料过程中。
以下是磷化氢在半导体工业中的几项主要应用:1. 气相外延(VPE)生长:VPE是一种将气体通过热分解形成薄膜的技术。
磷化氢作为一种常用的磷源,可以与金属有机化合物(如金属有机砷化合物)反应产生磷化物。
这种反应在高温下进行,生成的磷化物可以沉积在基底上,形成磷化物薄膜。
这种方法可用于制备磷化镓等半导体材料。
2. 气相扩散(VD):VD是将气体通过原子或分子的扩散在固体表面上形成沉积层的方法。
磷化氢可以作为磷源,通过在高温下与基底表面的材料反应,形成磷化物沉积层。
这种方法在制备磷化镓晶片和掺杂磷氮化硅等器件中得到广泛应用。
3. 硅掺磷化:磷化氢在硅管的制备过程中也发挥着重要作用。
通过将磷化氢引入高温反应管中,可以将磷原子掺入到硅晶体中,改变其电学性能。
这对于制备具有特定电学性能的硅器件至关重要,如掺杂层和二极管。
4. 低温等离子体增强化学气相沉积(PECVD):PECVD是一种在较低温度下进行薄膜沉积的方法,常用于制备一些特殊的半导体材料薄膜。
磷化氢可以作为磷源引入到低温等离子体反应室中,与其它气体一起通过等离子体反应生成磷化物薄膜。
磷化氢磷化
磷化氢是一种无色、剧毒、易燃的储存于钢瓶内的液化压缩气体,化学式为PH3.纯净的磷化氢气体是无色无味的,但在金属磷化物产生磷化氢气体时常带有乙炔味或者大蒜味或者腐鱼味。
如果遇到痕量其它磷的氢化物如乙磷化氢,会引起自燃。
磷化氢按照高毒性且自燃的气体处理。
吸入磷化氢会对心脏、呼吸系统、肾、肠胃、神经系统和肝脏造成影响。
性状:纯净的磷化氢气体是无色无味的。
磷化氢为人体吸收相当快的剧毒气体,主要由呼吸道吸入中毒。
空气中浓度若达到1390mg/m。
可使人迅速死亡。
误服磷化钙、磷化铝、磷化锌后,可水解生成磷化氢,由肠道吸收中毒。
磷化氢吸收后,除对呼吸道及胃肠道有局部刺激及腐蚀作用外,很快经过血液分布到肝、肾、脾等处,1h后可遍及全身,并由尿排出,少量经肺呼出。
磷化氢分解方程式
(实用版)
目录
1.磷化氢分解方程式的概述
2.磷化氢分解反应的过程
3.磷化氢分解方程式的应用
正文
1.磷化氢分解方程式的概述
磷化氢(PH3)是一种无色、剧毒、易燃的气体,分子量为 34.02,它是磷的一种氢化物。
在工业上,磷化氢被广泛应用于半导体生产、有机合成和农药生产等领域。
在磷化氢的众多应用中,对其分解过程的研究具有重要意义。
磷化氢分解方程式描述了磷化氢在特定条件下分解为磷(P)和氢气(H2)的化学反应过程。
2.磷化氢分解反应的过程
磷化氢分解反应可以在气相、液相和固相中进行。
在气相中,磷化氢在高温高压条件下分解为磷和氢气。
具体的反应过程如下:
PH3(g) → P(s) + 3/2 H2(g)
在液相中,磷化氢在液态金属(如镓、铟等)催化下发生分解反应。
液相分解反应具有较高的选择性和较好的可控性,因此在实际生产中具有广泛的应用前景。
在固相中,磷化氢在固体催化剂(如氧化铝、氧化钛等)作用下发生分解反应。
固相分解反应具有操作简便、安全性高等优点,因此在某些特定领域具有实际应用价值。
3.磷化氢分解方程式的应用
磷化氢分解方程式在磷化工业、半导体产业和有机合成等领域具有广泛的应用。
例如,在半导体生产中,磷化氢分解产生的磷可以用于制备磷酸盐膜,进一步用于制造光电子器件。
此外,磷化氢分解产生的氢气是一种清洁能源,可用于燃料电池等氢能利用领域。
总之,磷化氢分解方程式描述了磷化氢在特定条件下分解为磷和氢气的化学反应过程。