化学考点精要——分析与计算题
- 格式:doc
- 大小:650.50 KB
- 文档页数:2

(化学)初中化学化学计算题技巧(很有用)及练习题含解析一、中考化学计算题1.现有一份氧元素质量分数为 89.5%的过氧化氢溶液,加入 MnO2充分反应后,得到液体的质量为 90g(不考虑操作过程中液体的损失),则生成氧气的质量为________________g(精确到小数点后 1 位)。
【答案】 5.2【解析】解法一:设生成氧气的质量为x,过氧化氢溶液的质量为y,根据反应前后氧元素的质量不变可得关系式:①y-90g=x,②y 89.5%=x+90g 100%,x=5.2g,答:生成氧气的质量为5.2g。
解法二:可根据反应前后氢元素的质量不变进行分析解答,则:根据题意过氧化氢溶液的质量=90g 100%(1-89.5%),生成氧气的质量=90g 100%(1-89.5%)-90g=5.2g,答:生成氧气的质量为5.2g。
2.20g含杂质(杂质不溶于水,也不溶于酸)的锌样品,与一定质量的稀硫酸恰好完全反应,所得溶液质量为80.5g,同时生成氢气0.4g。
试计算:(1)样品中锌的质量分数是_____;(2)完全反应后生成溶液中溶质的质量分数是_____;(3)所用稀硫酸的质量分数是_____(计算结果保留到0.01%)。
【答案】65% 40% 28.87%【解析】【分析】样品中的锌能与稀硫酸反应生成硫酸锌和氢气。
【详解】设样品中锌的质量为x;生成的硫酸锌的质量为y;硫酸中溶质的质量为z;2442Zn+H SO=ZnSO+H65981612x z y0.4g65981612===x z y0.4gx=13gy=32.2gz=19.6g(1)样品中锌的质量分数为13g×100%=65% 20g(2)完全反应后生成溶液中溶质的质量分数为32.2g×100%=40% 80.5g(3)所用稀硫酸的质量分数为19.6g×100%28.87% 80.5g+0.4g-13g答:样品中锌的质量分数为65%,完全反应后生成溶液中溶质的质量分数为40%,所用稀硫酸的质量分数为28.87%。

【化学】九年级化学化学计算题解题技巧分析及练习题(含答案)含解析一、中考化学计算题1.向13.6g碳酸钠和氯化钠的固体混合物滴加稀盐酸,所加稀盐酸质量与生成气体质量的关系如图所示。
计算:(1)固体混合物中碳酸钠的质量。
(2)该稀盐酸中溶质的质量分数。
(3)恰好完全反应时所得的溶液中溶质的质量分数。
(计算结果精确至0.1%)【答案】(1)10.6克(2)10%(3)17.9%【解析】试题分析:设固体混合物中Na2CO3的质量为x,稀盐酸中溶质的质量为y,反应生成NaCl 的质量为z。
Na2CO3+ 2HCl ="=" 2NaCl + H2O + CO2↑106 2×36.5 2×58.5 44x y z 4.4g得x=10.6克稀盐酸中溶质的质量分数为:恰好完全反应时所得的溶液溶质质量分数为:考点:根据化学方程式的计算物质的质量分数2.某校化学兴趣小组为了测定某一碳酸钠样品中碳酸钠的质量分数,进行如下实验,取13.25g碳酸钠样品(杂质既不溶于酸也不溶于水)放入烧杯中,加入95.8g水使其完全溶解,再向其中加入稀盐酸,测得反应放出气体的总质量与所加入稀盐酸的质量关系曲线如图所示,请回答:(1)当加入212g稀盐酸时,放出气体的质量为_____g。
(2)碳酸钠样品中碳酸钠的质量分数为多少?_____(写出计算过程)(3)加入106g稀盐酸(即A点)时烧杯中溶液的溶质质量分数为多少?_____(写出计算过程)【答案】4.4g 80% 5.6%【解析】【分析】【详解】(1)根据图像,可以看出当加入106g稀盐酸的时候,反应就结束,产生气体质量为4.4g,所以当加入212g稀盐酸时,放出气体的质量仍然为4.4g(2)发生反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,根据方程式中碳酸钠与二氧化碳的质量关系可算出碳酸钠的质量,进而可以计算碳酸钠样品中碳酸钠的质量分数,反应后得到的是NaCl溶液,所以也可根据方程式中NaCl与二氧化碳的质量关系,求出溶液中溶质的质量解:设碳酸钠的质量为x,生成的NaCl质量为y。

初中化学计算题解析方法总结-初中化学计算题解题方法(含答案)初中化学计算题解析方法总结初三化学计算的类型有:①有关质量分数(元素和溶质)的计算②根据化学方程式进行计算③由①和②两种类型混合在一起计算(一)、溶液中溶质质量分数的计算(二)、化合物(纯净物)中某元素质量分数的计算(三)、混合物中某化合物的质量分数计算(四)、混合物中某元素质量分数的计算(五)、解题技巧1、审题:看清题目的要求,已知什么,求什么,有化学方程式的先写出化学方程式。
找出解此题的有关公式。
2、根据化学方程式计算的解题步骤:①设未知量②书写出正确的化学方程式③写出有关物质的相对分子质量、已知量、未知量④列出比例式,求解⑤答。
重要概念的含义与应用化学计算是借助于用数学计算的知识,从量的方面来对化学的概念或原理加深理解或通过计算进一步掌握物质的性质及其变化规律。
另外,通过计算还能培养分析、推理、归纳等逻辑思维能力和解决实际问题的能力。
初中化学计算的主要内容如下:(一)有关化学式的计算用元素符合来表示物质组成的式子叫做化学式。
本知识块的计算关键是抓住这一概念,理解概念的含义,并要深刻理解化学式中各符号及数字的意义,处理好部分与整体之间的算术关系。
1.计算相对分子质量。
相对分子质量是指化学式中各原子的相对原子质量的总和。
通过化学式可以计算出该物质的相对分子质量,也可以通过相对分子质量,求某物质的化学式。
在计算的过程中应注意化学式前面的数字(系数)与相对分子质量及元素符号右下角的数字与相对原子质量之间的关系是“相乘”不是“相加”;若计算结晶水合物的相对分子质量时,化学式中间的“·”与结晶水的相对分子质量之间是“相加”不是“相乘”。
推荐阅读》》2014化学压轴题大过关中考经典训练40题例计算5CuSO4·5H2O的相对分子质量总和。
5CuSO4·5H2O=5×[64+32+16×4+5×(1×2+16)]=5×[160+5×18]=12502.计算化合物中各元素的质量比宏观上物质是由元素组成的,任何纯净的化合物都有固定的组成,这样可以计算化合物中所含元素的质量比。
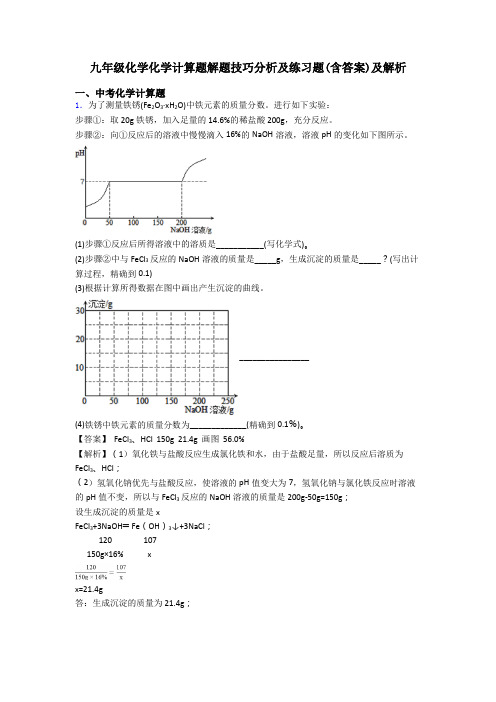
九年级化学化学计算题解题技巧分析及练习题(含答案)及解析一、中考化学计算题1.为了测量铁锈(Fe2O3·xH2O)中铁元素的质量分数。
进行如下实验:步骤①:取20g铁锈,加入足量的14.6%的稀盐酸200g,充分反应。
步骤②:向①反应后的溶液中慢慢滴入16%的NaOH溶液,溶液pH的变化如下图所示。
(1)步骤①反应后所得溶液中的溶质是___________(写化学式)。
(2)步骤②中与FeCl3反应的NaOH溶液的质量是_____g,生成沉淀的质量是_____?(写出计算过程,精确到0.1)(3)根据计算所得数据在图中画出产生沉淀的曲线。
________________(4)铁锈中铁元素的质量分数为_____________(精确到0.1%)。
【答案】 FeCl3、HCl 150g 21.4g 画图 56.0%【解析】(1)氧化铁与盐酸反应生成氯化铁和水,由于盐酸足量,所以反应后溶质为FeCl3、HCl;(2)氢氧化钠优先与盐酸反应,使溶液的pH值变大为7,氢氧化钠与氯化铁反应时溶液的pH值不变,所以与FeCl3反应的NaOH溶液的质量是200g-50g=150g;设生成沉淀的质量是xFeCl3+3NaOH═Fe(OH)3↓+3NaCl;120 107150g×16% xx=21.4g答:生成沉淀的质量为21.4g;(3)所以产生沉淀的曲线为;(4)所以铁锈中铁的质量分数为 =56%。
2.某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10克样品放入烧杯中,再取60克稀硫酸分六次加入烧杯中,均充分反应,实验数据如下:第一次第二次第三次第四次第五次第六次101010101010加入稀硫酸的质量(g)剩余固体的质量(g)9.358.78.057.4 6.75 6.75(1)黄铜样品中锌的质量分数为多少?(写出计算步骤,下同)(2)所用稀硫酸的质量分数为多少?【答案】(1)32.5%;(2)9.8%【解析】质量分数的一种常用的计算方法是分别计算出目的物质的质量和样品的总质量,然后求比值。

高中化学气体的摩尔体积计算题解析与答题技巧在高中化学学习中,气体的摩尔体积计算是一个重要的考点。
了解和掌握摩尔体积计算的方法和技巧,不仅可以帮助我们解题,还可以加深对气体性质的理解。
本文将通过具体的题目举例,分析和说明摩尔体积计算的考点和解题技巧,以帮助高中学生和他们的父母更好地掌握这一知识点。
首先,我们来看一个常见的摩尔体积计算题目:题目:某气体在25℃和1 atm下的摩尔体积为22.4 L,求该气体在35℃和2 atm下的摩尔体积。
解析:这是一个典型的摩尔体积计算题目,涉及到气体的状态方程和气体性质的关系。
根据理想气体状态方程PV = nRT,摩尔体积与温度和压力成正比,与摩尔数成反比。
首先,我们需要将题目中的温度和压力转化为绝对温度和标准大气压。
25℃等于298K,1 atm等于101.3 kPa。
35℃等于308K,2 atm等于202.6 kPa。
然后,根据摩尔体积与温度和压力的关系,我们可以列出等式:V1 / T1 = V2 / T2其中,V1为已知的摩尔体积,T1为已知的温度,V2为待求的摩尔体积,T2为待求的温度。
代入已知值,我们可以得到:22.4 L / 298K = V2 / 308K通过交叉相乘计算,我们可以得到:V2 = (22.4 L / 298K) * 308K计算结果为23.7 L,即该气体在35℃和2 atm下的摩尔体积为23.7 L。
通过这个例子,我们可以看出,摩尔体积计算题目的关键在于理解和运用摩尔体积与温度、压力的关系。
需要注意的是,温度要转化为绝对温度,压力要转化为标准大气压,以保证计算结果的准确性。
除了掌握基本的计算方法,我们还可以通过一些技巧来简化解题过程。
下面给出两个常用的技巧:技巧一:利用摩尔体积的比例关系在一些题目中,我们可以利用摩尔体积的比例关系来简化计算。
比如,题目给出了某气体在一组条件下的摩尔体积,要求求解在另一组条件下的摩尔体积。
我们可以通过比较两组条件的温度和压力的变化情况,判断摩尔体积是增大还是减小,从而确定待求的摩尔体积是大于还是小于已知的摩尔体积。

重、难点考点11—化学计算题专题突破(二)考点剖析:此题型在中考中主要考查化学方程式的计算,化学方程式的计算题应注意的问题:1:正确书写题目中相关的化学方程式。
2:对题目中所给的数据,表格及图像进行正确的分析,确定已知量和未知量。
3:根据题意写出相关的化学方程式式,并正确设出未知量。
4:在化学方程式式中列出相关物质的相对分子质量并把已知和未知的数据写到相关物质的下面。
5:正确列出比例式,并正确求解。
6:对所求出的数据或化学量进行作答。
典例剖析:例1:(2020年河北中考)某小组用粗锌测定某稀硫酸中溶质的质量分数。
取一定质量的稀硫酸于烧杯中,称量稀硫酸和烧杯的总质量;然后,向其中分两次加入粗锌(杂质不参加反应),实验过程和数据如图所示。
请计算:(1)生成氢气的总质量为g。
(2)稀硫酸中溶质的质量分数。
例2:(2020年广元中考)某兴趣小组同学将100g氢氧化钠溶液分五次加入到139.6g硫酸铜溶液中,测得实验数据如下表所示:(1)表格中m的值为多少。
(2)计算恰好完全反应时所得溶液中溶质的质量分数。
(写出计算过程)例3:(2019河北中考试题)为测定某CuSO4溶液中溶质的质量分数,取150gCuSO4溶液,平均分为三份,每份样品均按如图所示进行实验,实验数据见表。
请计算:(1)溶液完全反应时,所得沉淀的质量为g 。
(2)CuSO4溶液中溶质的质量分数。
例4:(2020年黑龙江齐齐哈尔中考)合金是重要的金属材料,常用来制造机械零件、仪表和日用品。
某化学研究小组利用黄铜(铜、锌合金)进行了下图所示实验:请计算:(1)生成氢气的质量为多少g,黄铜中锌的质量为多少g。
(2)过滤后所得溶液的溶质质量分数。
例5:(2020年自贡中考)取一定量铜粉、铁粉的混合物,加入过量稀硫酸,完全反应(酸溶)后过滤,将滤渣洗净、烘干后在足量氧气中充分灼烧(金属元素在产物中显+2价)。
固体质量与各步实验的时间关系如图。
(1)b点时溶液中溶质的化学式为。
误差1测定铁矿石中铁的质量分数(以32O Fe W 表示),5次结果分别为:67.48%,67.37%,67.47%,67.43%和67.40%。
计算:(1)平均偏差(2)相对平均偏差 (3)标准偏差;(4)相对标准偏差;(5)极差。
解:(1)%43.675%407.67%43.67%47.67%37.67%48.67=++++=-x∑=+++==-%04.05%03.0%04.0%06.0%05.0||1i d n d (2)%06.0%100%43.67%04.0%100=⨯=⨯=--x d d r (3)%05.015%)03.0(%)04.0(%)06.0(%)05.0(122222=-+++=-=∑n dS i(4)%07.0%100%43.67%05.0%100=⨯=⨯=-xS S r(5)X m =X 大-X 小=67.48%-67.37%=0.11%酸碱滴定1欲配制100 mL 氨基乙酸缓冲溶液,其总浓度c=0.10 mol·L -1,pH=2.00,需氨基乙酸多少克?还需加多少毫升1.0 mol·L -1酸或碱?已知氨基乙酸的摩尔质量M=75.07g ·mol -1。
解:1)设需氨基乙酸x g ,由题意可知∵c MVm= ∴10.01000.007.75=⨯xg x 75.0=(2)因为氨基乙酸为两性物质,所以应加一元强酸HCl ,才能使溶液的pH=2.00 。
设应加y mL HClHAA a c c pK pH -+=lgyy 0.110000.11.01.0lg35.200.2-⨯+=y=6.9 mL2某一弱酸HA 试样1.250 g 用水溶液稀释至50.00 mL ,可用41.20 mL 0.09000mol·L -1NaOH 滴定至计量点。
当加入8.24 mLNaOH 时溶液的pH=4.30。
(1) 求该弱酸的摩尔质量;(2)计算弱酸的解离常数Ka 和计量点的pH ;选择何种指示剂?解:(1)由0412.009.0250.1⨯=M得 M=337.1g/mol (2)aba C C pK pH log+= 9.424.85024.85024.809.0log =++⨯-=pH pK aK a =1.3×10-5,20W b K CK >> 400>bK C62106.5][--⨯==∴CK OH75.826.51414=-=+=pOH pH故 酚酞为指示剂。
【化学】中考化学初中化学化学计算题解题技巧分析及练习题(含答案)一、中考化学计算题1.某品牌纯碱中含有杂质NaCl ,化学兴趣小组的同学进行了如下实验探究:称取12g 样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图(1)纯碱恰好完全反应时,生成CO 2的质量为___g(2)计算该样品中含杂质的质量分数是多少?(计算结果保留一位小数,下同)____________(3)计算当盐酸与纯碱恰好完全反应时,所得溶液的溶质质量分数是多少?____________【答案】4.4g 11.7% 16.3%【解析】【分析】(2)根据题意可知:已知量为二氧化碳的质量,未知量为样品中含杂质的质量分数。
解题思路为:可根据反应中二氧化碳与碳酸钠的质量关系求出碳酸钠的质量。
进一步可求出样品中含氯化钠的质量分数。
(3)根据题意可知:已知量为二氧化碳的质量,未知量为所得溶液中溶质的质量分数。
解题思路为:所得溶液为氯化钠溶液,可根据反应中二氧化碳与氯化钠的质量关系求出生成氯化钠的质量。
再加上样品中原有氯化钠的质量,即为所得溶液中的溶质的质量。
再根据质量守恒定律可求出所得溶液的质量。
最后可计算出所得溶液中溶质的质量分数。
具体过程如下:【详解】(1)纯碱样品中的主要成分为碳酸钠,可与盐酸反应生成二氧化碳气体。
根据图示可知:当加入73g 稀盐酸时,生成气体的质量达到了最大值,即此时碳酸钠恰好完全反应。
所以恰好完全反应时生成二氧化碳的质量为4.4g 。
(2)解:设样品中含碳酸钠的质量为x ,反应生成氯化钠的质量为y2322Na CO 2HCl 2NaCl H O +=++CO 10611744x y 4.4g106x =44 4.4gx=10.6g 117y=44 4.4g y=11.7g样品中含杂质的质量分数为:12g-10.6g×100%11.7% 12g≈(3)所得溶液中溶质的质量分数为:12g-10.6g+11.7g×100%16.3% 12g+73g-4.4g≈答:(1)生成二氧化碳的质量为4.4g;(2)样品中含杂质的质量分数为11.7%;(3)所得溶液中溶质的质量分数为16.3%。
高考化学计算题解题技巧(含例题解析)1、守恒法多数计算题是以化学反应为依据,化学方程式可表示反应物和生成物之间的质量、微观粒子、物质的量、气体体积等变化关系,又反映出化学反应前后的电荷数、电子得失数、微粒个数都是守恒的。
在有关的多步反应、并行反应、混合物的综合计算等问题中,如能巧用这些守恒规律,可使难度较大和计算过程繁杂的题目达到解题思路简明、方法简单、步骤简化的目的,收到事半功倍的效果。
(1)质量守恒法例1把过量的铁粉加入到FeCl3和CuCl2组成的混合液中,充分搅拌,反应后过滤、干燥、称得不溶物的质量与加入铁粉的质量相等。
求混合物中FeCl3和CuCl2的物质的量之比是多少?解析:设混合物中CuCl2的物质的量为x,FeCl3物质的量为yFe+CuCl2=Cu+FeCl2Fe+2FeCl3=3FeCl2xmol xmol xmol y/2mol ymol反应后所得不溶物为铜粉和过量的铁粉。
按题意,反应中与FeCl3和CuCl2反应而消耗的铁粉的质量与置换出铜粉的质量相等。
按此等量关系用代数法求解。
56(x+y/2)=64x∴x:y=2:7(2)摩尔守恒法这是利用某种原子(或原子团)反应前物质的量等于转化为各种产物中所含该原子(或原子团)的物质的量进行计算的一种方法。
例2(1994年高考24题)38.4mg铜与适量的浓硝酸反应,铜全部作用后,共收集到气体22.4ml(标准状况),反应消耗的HNO3的物质的量可能是()A、1.0×10—3molB、1.6×10—3molC、2.2×10—3molD、2.4×10—3mol解析:此题的隐含条件是“随着铜与硝酸反应,硝酸越来越稀,因而产生的气体有NO2和NO”。
根据N原子守恒(不考虑NO2聚合成N2O4)有:nHNO3=nCu(NO3)2+nNO2+nNO=nCu×2+n总气体=[(38.4×10—3)/64]×2+(22.4×10—3)/22.4=2.2×10—3(mol)应选C。
化学考点精要——分析与计算题
1、有一不纯的尿素[CO(NH 2)2]样品,测知含氮元素44.8%,若已知杂质不含氮元素,此化肥的有效成分尿素的质量分数为_________________________
2、“珍爱生命,拒绝毒品”是每个公民的责任,但是在某些娱乐场所,还有人服用俗称摇头丸的毒品。
该毒品能使人手舞足蹈,呈癫狂状态,严重危害人的身心健康和社会稳定,有一种“摇头丸”的化学式为C 12H x O 2N ,相对分子质量为209,试回答下列问题:(1)该物质由 种元素组成,它属于 (填“无机物”、 “有机物”中之一) 。
(2)该物质的一个分子中,含氢原子 个。
(3)该物质中碳元素与氧元素的质量比为 。
(最简整数比)
3、人体缺钙容易导致“骨质疏松症”,如右图所示,每天服用某种钙片5片,可补充钙元素0.4g 。
已知该钙片的有效成分是葡萄糖酸钙[其化学式为(C 6H 11O 7)2Ca],请回答下列问题:
(1)组成葡萄糖酸钙的元素共有 种。
(2)该求出葡萄糖酸钙中各元素的质量比 。
(3)若每片钙片的质量是1g ,则该钙片中含葡萄糖酸钙的质量分数是多少?
4、工人师傅要用98%的浓硫酸(ρ=1.84g/cm 3
)稀释成15%的稀硫酸来清洗钢铁表面的铁锈(水的密度约为1g/cm 3
)。
问:
(1)500mL 溶质质量分数为98%的浓硫酸的质量为_____g ,其中溶质的质量为_______g ;
(2)将500mL98%的浓硫酸稀释成15%的稀硫酸,约需加水______mL(计算结果保留1位小数);
5、小明同学购买了一瓶白醋,标签上注明醋酸(化学式为CH 3COOH)的质量分数≥5%。
小明用刚刚学到的酸碱中和反应的知识,定量地测定了醋酸的含量。
实验数据如下:取用20g 白醋,与6.4g10%的氢氧化钠溶液恰好完全中和,生成醋酸钠(CH 3COONa)和水。
请通过计算说明,这瓶白醋中的醋酸含量是否与标签的标注相符?
6、某课外活动小组,为了检测本地钢铁厂生铁产品的质量,在实验室中称取生铁屑样品10.0g ,放入烧杯中,加入一定质量的稀硫酸。
加热,使之充分反应(杂质不参加反应)。
然后冷却、称量。
反应后烧杯中物质的质量比反应前减少了0.34g 。
计算:
(1)生铁样品中杂质的含量;
(2)生产100t 这种生铁,至少需要含氧化铁80%的赤铁矿的质量。
7、某化工厂运用我国著名化学家侯德榜先生的“侯氏制碱法”制得的纯碱中含有少量氯化钠。
现取某种仅含有氯化钠杂质的纯碱样品11.1g ,全部溶解在120g 水中,再加入氯化钡溶液144g ,恰好完全反应并生成碳酸钡沉淀:Na 2CO 3+BaCl 2 = BaCO 3↓+2NaCl ,过滤干燥后,称得沉淀质量为19.7g 。
求:
(1)纯碱样品中Na 2CO 3的质量分数;
(2)滤液中溶质的质量分数(计算结果精确到0.1)。
8、烧杯中盛有不纯的锌粒7.0g ,加入50g 的稀硫酸恰好完全反应,生成氢气0.2g 。
(杂质不参加反应,反应前后都不溶解)问:
①参加反应的锌的质量。
②所用的稀硫酸中溶质的质量分数。
③生成的溶液中溶质的质量分数。
9、下面是某化肥厂在一公共场所的围墙上做的广告:请仔细观察、分析,并回答下列问题:
(1)碳酸氢铵(化学式为:NH 4HCO 3)是由 种元素组成的。
(2)碳酸氢铵的氮含量是指氮元素的质量分数。
根据所学化学知识,你认为此广告是 广告(填“真实”或“虚假”),判断的依据是什么?请通过计算说明。
(3)碳酸氢铵受潮时在常温下就能分解,温度越高分解越快,因此保存时应注意
10、向碳酸钠和氯化钠的混合物15.6 g 中加入100 g 稀盐酸,恰好完全反应后,得到111.2 g 溶液。
试计算:
(1)产生二氧化碳多少克?
(2)所得溶液中溶质的质量分数是多少?
11、用20g 的KMnO 4加热制氧气,制得所需氧气后,停止加热,称取剩余固体质量为18.72g 。
问:
①、制取氧气多少克?
②、通过计算回答:剩余物中含哪些物质?各多少克?
12、1989年,世界卫生组织把铝列为食物污染源之一,每日铝元素摄人量应控制在4mg 以下,过多摄入会损害脑细胞,是造成老年痴呆的原因之一。
炸油条时,需加人明矾[KAl (SO 4)2·12H 2O ](相对分子质量为474)晶体作膨松剂。
①计算明矾晶体中铝元素的质量分数。
②在1000g 调合好的炸油条的面中,含有明矾晶体2g ,若每根油条平均用面50g ,试计算早餐食用2根油条是否超过安全摄入量(假设烹炸过程中铝不损耗)?
13、碘盐就是在食盐中加入一定量的碘酸钾(KIO 3的相对分子质量为214),食用碘盐可以有效地预防碘盐缺乏病,(计算结果保留一位小数) (1)_________mg 碘酸钾中含碘20mg
(2)成人每天约需0.15mg ,假设这些碘盐主要是从碘盐中摄取的,若1000g 碘盐中含碘20mg ,则成人每天需食用碘盐____________g
14、某校化学兴趣小组为测定空气中二氧化硫的含量,用NaOH 溶液吸收SO 2,反应方程式如下:2NaOH +SO 2=Na 2SO 3+H 2O ,用NaOH 溶液吸收1000L 已除去CO 2的空气样品,溶液质量增重了0.64g 。
已知此时空气的密度约为1.3g /L ,求:
(!)被吸收的SO 2的质量。
(2)发生反应的NaOH 的质量。
(3)空气中SO 2的质量分数(计算结果精确到0.01%)。
15、非典型肺炎在我国部分地区造成的疫情形势非常严重,为了预防非典型肺炎,很多部门用过氧乙酸对环境进行消毒,已知过氧乙酸的化学式为C 2H 4O 3
(1) 过氧乙酸的相对分子质量为________,碳、氢、氧三种元素的质量比为__________。
(2) 用含溶质的质量分数为20%的过氧乙酸溶液(密度为1.1g/cm ³)配制溶质的质量分数为0.4%的消毒液(密度为1.0g /cm³)15L ,需要20%的过氧乙酸溶液体积是多少毫升(最后结果保留一位小数)?。