镁和铝[2]1
- 格式:ppt
- 大小:878.00 KB
- 文档页数:17
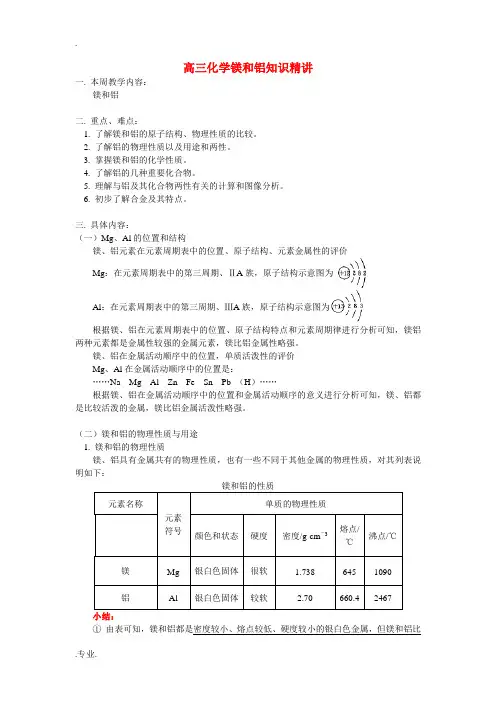
高三化学镁和铝知识精讲一. 本周教学内容:镁和铝二. 重点、难点:1. 了解镁和铝的原子结构、物理性质的比较。
2. 了解铝的物理性质以及用途和两性。
3. 掌握镁和铝的化学性质。
4. 了解铝的几种重要化合物。
5. 理解与铝及其化合物两性有关的计算和图像分析。
6. 初步了解合金及其特点。
三. 具体内容:(一)Mg、Al的位置和结构镁、铝元素在元素周期表中的位置、原子结构、元素金属性的评价Mg:在元素周期表中的第三周期、ⅡA族,原子结构示意图为Al:在元素周期表中的第三周期、ⅢA 族,原子结构示意图为根据镁、铝在元素周期表中的位置、原子结构特点和元素周期律进行分析可知,镁铝两种元素都是金属性较强的金属元素,镁比铝金属性略强。
镁、铝在金属活动顺序中的位置,单质活泼性的评价Mg、Al在金属活动顺序中的位置是:……Na Mg Al Zn Fe Sn Pb (H)……根据镁、铝在金属活动顺序中的位置和金属活动顺序的意义进行分析可知,镁、铝都是比较活泼的金属,镁比铝金属活泼性略强。
(二)镁和铝的物理性质与用途1. 镁和铝的物理性质镁、铝具有金属共有的物理性质,也有一些不同于其他金属的物理性质,对其列表说明如下:元素名称元素符号单质的物理性质颜色和状态硬度密度/g·cm-3熔点/℃沸点/℃镁Mg 银白色固体很软 1.738 645 1090铝Al 银白色固体较软 2.70 660.4 2467小结:①由表可知,镁和铝都是密度较小、熔点较低、硬度较小的银白色金属,但镁和铝比较,铝比镁的硬度稍大,熔点和沸点都是铝比镁的高。
②在元素周期表中,同一主族的金属从上到下熔点降低,硬度减小;同一周期的主族金属从左到右熔点升高,硬度增大。
2. 镁和铝的重要用途铝由其优良的物理性质所决定的重要用途,主要有:(1)延展性——铝线、铝箔、多种容器(2)导电性——做电的导体。
铝的导电性仅次于铜,是优良的导体之一。
(3)导热性——做热的导体。


镁和铝●教学目的要求1、使学生了解金属的通性。
2、使学生了解名的物理性质和用途。
3、使学生掌握镁和铝的化学性质。
4、使学生了解铝的几种重要化合物。
5、使学生初步了解合金。
2●教学重点、难点教学重点:镁和铝的化学性质、氢氧化铝的两性。
教学难点:氢氧化铝的两性。
一.镁和铝的物理性质由镁和铝在元素周期表中的位置归纳镁和铝的结构及其物理性质.合金:合金指由两种或两种以上析金属(或金属与非金属)熔合而成的具有金属特性的物质.一般来说,合金的熔点比它的各成份金属的熔点都低.如:铝合金.二.镁和铝的化学性质Mg-2e-→Mg2+ Al-3e-→Al3+说明:1.[实验4-5]铝箔在氧气中燃烧,条件:点燃;现象;注意点.2. [实验4-6]铝与碱反应产物的检验.3. [实验4-7]镁与CO2反应的注意点4.铝热反应用蔗糖与氯酸钾的混合物滴入浓硫酸;现象;注意点铝粉与某些金属氧化物的混和物叫铝热剂,在高温下发生铝热反应.利用铝热法可冶炼钒,铬,锰,也可焊接钢轨.3[例题分析]1.将相同质量的镁条分别在①氧气②空气③N2④二氧化碳中燃烧.燃烧后所得产物的质量是( )A.②<①<③<④B. ④=③=②=①B.③<②<①<④ D.③<①<②<④[解析]:空气中有1/5的氧气,4/5的氮气.可用“变换化学式法” .设镁均为1mol,则与氧气反应生成1 molMgO;在氮气中燃烧时生成Mg3N2,1在CO2燃烧生成均为1在空气中燃烧时生成和的混合物,其中镁的物质的量为由于镁的物质的量相同,因此比较生成固体的质量即可比较它们的化学式不同的部分的相对原子质量.2.某无色透明的溶液,能与铝反应放出氢气,但不与镁反应.该溶液中可能大量存在H+,Ba2+,Cu2+,OH-,SO42-,Cl-,CO32-,NO3-.试根据上述性质推断:该溶液中肯定存在的离子是 ;可能存在的离子是 ;不存在的离子是 .3.简答为什么不能用干粉灭火剂(主要成份为NaHCO3)来扑灭燃烧的镁粉?[学生练习]:1.某无色透明的溶液,跟金属铝反应时放出H2,试判断下列离子:Mg2+,Cu2+,Ba2+,H+,Ag+,SO42-,SO32-,HCO3-,OH-,NO3- .何者能存在此溶液中?(A)当生成Al3+时可存在 ;(B)当生成AlO2-时可存在 .2.将等物质的量的镁和铝混合,取四份等质量的该混合物分别加到足量的下列溶液中,充分反应后,放出氢气最多的是A.3mol/LHCl B. 4mol/LHNO3 C.8mol/LNaOHD.18mol/LH2SO43.在两份体积相同的NaOH和稀硫酸溶液中分别加入过量铝粉,充分反应后,在相同状况下,若放出氢气的体积相同,则两溶液的物质的量浓度之比是A. 3 :1B. 1 :3C. 3 :2D. 2 :34.将镁铝硅的混和物分为等质量的两份.一份跟足量的NaOH溶液反应,另一份跟足量的HCl反应,最终产生的H2一样多.则镁与硅物质的量之比是A.2 :1B.4:1C.1 :1D.3 :1三、铝的重要化合物1.氧化铝(Al2O3)概述:白色难熔物,是冶炼铝的原料,是一种比较好的耐火材料Al2O3:两性氧化物,能跟强酸、强碱反应,不跟水反应。

镁和铝的相似性和差异性比较431800 湖北省京山一中贾珍贵 2011-9-14一、相似性1位置:都处于元素周期表的第三周期,都是主族元素;2结构:都有三个电子层,价电子都较少,原子半径、离子半径较大(比非金属);金属键3性质:A.都属轻金属、有色金属、常见金属B.都易失去电子,显还原性,金属性、金属活动性都较强C.都是银白色,有金属光泽,不透明,易导电、导热、有延展性D.熔点低、密度小、硬度小E.都能与一些氧化剂反应;如:常温下与空气中的氧气反应,生成致密的氧化物保护膜,能阻止继续氧化,所以,都有抗腐蚀性能;点燃时,能在空气或氧气中剧烈燃烧,发出耀眼的白光,放出大量的热;与硫加热反应生成硫化物;与氯气点燃生成氯化物;与非氧化性酸反应,置换酸里的氢;与较不活泼的金属的盐溶液发生置换反应,如铜盐、亚铁盐;与醇类反应产生氢气有等。
F.存在:在自然界都以化合态存在;G.制法:都用电解法制备;H.用途:都可用作合金。
I.化合物的性质:其盐都能水解;其硫化物遇水完全水解,所以都不能在水溶液中制备,只能用金属与硫加热化合;其无水氯化物都不能蒸干溶液制备,也不能加热结晶水合物制备,都必须加盐酸或在氯化氢气流中加热蒸干,以便抑制水解;其氧化物的熔点都很高,都可作耐火材料,都溶于酸;其最高价氧化物的水化物——氢氧化物都难溶于水,而溶于酸,加热灼烧时都能分解。
二、差异性1位置:镁在ⅡA族,铝在ⅢA族;2结构:价电子镁较铝少,原子半径、离子半径Mg(Mg2+)>Al(Al3+);金属键:Al > Mg。
3物理性质:A.熔沸点、导电、导热、延展性:Al > MgB.密度、硬度:Al > Mg;4.化学性质A.失去电子能力,还原性,金属性、金属活动性:Mg>Al;B.与一些氧化剂(氧气、水、酸等)反应时,反应难易、剧烈程度:Mg>Al;C.铝是典型的两性元素,能与强碱溶液反应,镁不能;D.镁能在CO2中燃烧,铝能与一些氧化物发生铝热反应;E.存在:在地壳中,铝的含量比镁高;F.制法:镁通常电解熔融氯化镁的方法制备,铝通常电解熔融冰晶石氧化铝制备;不电解熔融氧化镁是因其熔点很高,不电解熔融氯化铝制备铝是因其是共价化合物;G.铝在冷浓硫酸、浓硝酸中钝化,镁不能;H.用途:铝的用途比镁广。


镁和铝其化合物性质知识点归纳一Mg的化学性质1与非金属反应(1)与。
2反应。
常温下与空气中的02反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。
镁、铝都能在空气中燃烧:2Mg+0? 一2Mg0。
4AI+ 30 2』2AI 2O 3(2)与卤素单质、硫等反应。
__ Mg+ C 2 门"MgCI 2AI+ 3CI 2 ' '2AICI 32AI+ 3S——AI2S3 (用于工业制备) Mg+ MgS[特别提醒]:①镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。
镁在空气中燃烧时有三个反应发生:I占烬I总堆頁烬I2Mg+O2 … 2Mg0 3Mg+N 2 … Mg 3N2 2Mg+C0 2 2Mg0+C②燃烧时都放出大量的热,发出耀眼的白光。
禾U用镁的这种性质来制造照明弹。
③集气瓶底部都要放一些细纱,以防止集气瓶炸裂。
2. 与H20反应Mg、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气Mg+2H 2^^= Mg(0H) 2+H2T 2A1+6H 2^^= 2A1(0H) 3+3H2T3. 与酸反应置换出H2Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓H2S04,冷浓硝酸中发生钝化现象。
所以可用铝制容器贮存冷的浓硫酸或浓硝酸。
4.与某些氧化物反应(1)镁与二氧化碳反应:2Mg+C0 2 * 2Mg0+C[特别提醒]: “ CQ不能助燃”的说法是不全面的,C0 2对绝大多数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂。
(2)铝热反应:2AI+ Fe 2O3 11 2Fe+ AI2O3铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。
[特别提醒]:①铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe203、Fe0、Fe304、Cr 2。
3、V205、Mn0 2等。
②铝热反应的特点是反应放出大量的热,使生成的金属呈液态。

镁和铝的性质二. 重点、难点1. 镁和铝的原子结构比较。
2. 镁和铝的单质物理性质比较(色、态、熔沸点、硬度、密度、延展性等)。
3. 合金及其特点(定义、熔点等),镁、铝的重要用途。
4. 镁、铝的化学性质(与氧气、硫、卤素的反应,与非氧化性酸、某些氧化物的反应,铝的钝化,铝与碱反应),铝热反应的有关知识,铝的两性。
三.知识分析:(一)金属的物理性质有金属光泽、不透明、有导电性、导热性有延展性、多数具有较高熔点、较大硬度金属可以根据其颜色、密度、存在形式可把金属分为以下几类:从颜色分:黑色金属(Fe、Cr、Mn)有色金属(除以上金属外)从密度分:轻金属(d <4.5g/cm-3)重金属(d > 4.5g/cm-3)从存在分:常见金属(Fe、Al、Cu)稀有金属以上同学们对金属应有一定的认识,下面我们通过学习镁和铝的性质来深入了解金属的性质及用途。
(二)合金1. 定义——由两种或两种以上的金属(或金属与非金属)熔合在一起形成的具有金属特性的物质,合金属于混合物。
2. 合金的性质特点一般说来,合金的熔点比其成分金属都低,而在硬度、韧性等方面却往往有其成分金属所不具有的独特的性质。
3. 镁、铝的合金简介(三)镁和铝1. 原子结构(1)原子结构示意图(2)电子式2. 物理性质(1)共同点:均为银白色,属于轻金属,熔点较低,硬度较小、有良好的导电性、导热性。
(2)不同点:密度:铝>镁熔点、硬度:铝>镁思考:a. 镁和铝分别位于元素周期表的第几周期,第几族?b. 分别画出镁和铝的原子结构示意图,它们的原子结构有哪些特点?c. 为什么镁的化学性质比铝活泼?举出几个能说明镁的化学性质比铝活泼的实验事实。
3. 化学性质:(1)与非金属反应: a. 镁条在空气中的燃烧2Mg + O 2 = 2MgO 3Mg + N 2 = Mg 3N 2 b. 铝在氧气中的燃烧4Al + 3O 2 = 2 Al 2O 3 (2)与酸的反应: a. 与非氧化性酸反应: Mg + 2H + = Mg 2+ + H 2↑ 2Al + 6H + = 2Al 3+ + 3H 2↑b. 与氧化性酸反应:镁与浓硫酸、浓硝酸的反应: Mg + 2 H 2SO 4(浓)= MgSO 4 + SO 2 ↑+ 2H 2O Mg + 4HNO 3(浓)= 23)Mg(NO +2NO 2↑ + 2H 2O 铝与浓硫酸、浓硝酸发生钝化 (3)镁与水的反浓应:Mg +2 H 2O (沸水)=↑+↓22H Mg(OH)(4)铝与碱的反应:2Al + 2NaOH + 6H 2O = 2NaAlO 2 +3H 2↑+ 4H 2O 还原剂:Al 氧化剂: H 2O(5)镁、铝与某些氧化物的反应:镁条在二氧化碳里燃烧:2 Mg + CO 2 = 2MgO + C 铝热反应:2Al + Fe 2O 3 = Al 2O 3 +2Fe铝热剂:铝粉和某些金属氧化物组成的混合物运用:焊接钢轨;可以用于冶炼工业,冶炼难熔金属。

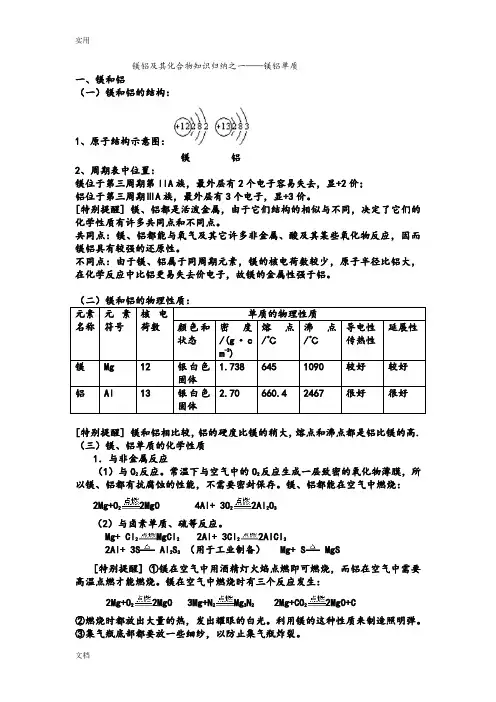
镁铝及其化合物知识归纳之一——镁铝单质一、镁和铝(一)镁和铝的结构:1、原子结构示意图:镁 铝 2、周期表中位置:镁位于第三周期第IIA 族,最外层有2个电子容易失去,显+2价; 铝位于第三周期ⅢA 族,最外层有3个电子,显+3价。
[特别提醒] 镁、铝都是活泼金属,由于它们结构的相似与不同,决定了它们的化学性质有许多共同点和不同点。
共同点:镁、铝都能与氧气及其它许多非金属、酸及其某些氧化物反应,因而镁铝具有较强的还原性。
不同点:由于镁、铝属于同周期元素,镁的核电荷数较少,原子半径比铝大,在化学反应中比铝更易失去价电子,故镁的金属性强于铝。
(二)镁和铝的物理性质:元素名称 元素符号 核电荷数 单质的物理性质颜色和状态 密度/(g ·c m -3)熔点/℃ 沸点/℃ 导电性 传热性延展性镁 Mg 12 银白色固体1.738 645 1090 较好 较好铝 Al 13 银白色固体2.70 660.4 2467 很好 很好[特别提醒] 镁和铝相比较,铝的硬度比镁的稍大,熔点和沸点都是铝比镁的高. (三)镁、铝单质的化学性质1.与非金属反应(1)与O 2反应。
常温下与空气中的O 2反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能,不需要密封保存。
镁、铝都能在空气中燃烧:2Mg+O 22MgO 4Al+ 3O 22Al 2O 3(2)与卤素单质、硫等反应。
Mg+ Cl 2MgCl 2 2Al+ 3Cl 22AlCl 32Al+ 3S Al 2S 3 (用于工业制备) Mg+ SMgS③集气瓶底部都要放一些细纱,以防止集气瓶炸裂。
[特别提醒] ①镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。
镁在空气中燃烧时有三个反应发生:2Mg+O 22MgO 3Mg+N 2Mg 3N 2 2Mg+CO 22MgO+C②燃烧时都放出大量的热,发出耀眼的白光。
利用镁的这种性质来制造照明弹。

