国家食品药品监督管理局北京市医疗器械检验所
- 格式:doc
- 大小:23.00 KB
- 文档页数:1


附件:
医疗器械可靠性与维修性标准化技术归口
单位信息
一、归口单位名称
医疗器械可靠性与维修性标准化技术归口单位。
二、专业领域
医疗器械可靠性与维修性标准化技术归口单位主要负责医疗器械可靠性和维修性相关的基础标准和方法标准的制修订工作。
基础标准包括术语定义与通用要求等;方法标准以可靠性与维修性的设计分析与验证评价为核心内容,建立相关通用方法标准和应用指南标准。
三、对口国际组织
无。
四、筹建单位
广东省医疗器械质量监督检验所。
五、秘书处承担单位
广东省医疗器械质量监督检验所。
六、专家名单
(一)专家组成员(60人)
(二)观察员(17人)。

全国医疗器械检验机构调查医疗器械检验机构,没有明显的优劣之分,国家食药总局对各检验中心进行了专业分工,各检验中心检验专长和领域各不相同。
企业根据自己的产品选择检验机构,看该检验机构的受检项目,包不包括企业的送检产品。
当前国家食品药品监督管理局下属的、全国比较出名、结果比较认可的检验机构分别是:中检所医疗器械质量监督检验中心、北京医疗器械质量监督检验中心、北大医疗器械质量监督检验中心、济南医疗器械质量监督检验中心、上海医疗器械质量监督检验中心、沈阳医疗器械质量监督检验中心、天津医疗器械质量监督检验中心、武汉医疗器械质量监督检验中心、杭州医疗器械质量监督检验中心、广州医疗器械质量监督检验中心。
1、中检所医疗器械质量监督检验中心2011年12月29日,中国食品药品检定研究院医疗器械检定所(以下简称“中检院器械所”)揭牌成立。
中检院医疗器械检测体系规模由原来的一个处三个科室扩大到一个所六个内设机构,主要职能和人员构成也得到了很大扩充。
中检院器械所的成立是中检院医疗器械检测体系发展的里程碑,标志着医疗器械体系进入了一个新纪元.主要职能及内设机构中国食品药品检定研究院医疗器械检定所主要职责为:承担医疗器械注册检验、监督检验、委托检验和进口检验工作。
承担全国医疗器械检验检测复验和技术检定的相关组织工作。
承担相关医疗器械标准制修订及其实验室验证等工作。
承担医疗器械标准物质研究和标定工作.开展与医疗器械检验检测方法、质量标准、技术规范等相关新方法、新技术研究。
承担全国食品药品监管系统医疗器械检验机构的业务指导,组织开展医疗器械研究、生产、经营相关单位以及医疗机构中的医疗器械检验机构及人员的业务指导工作。
根据上述职责,中检院器械所设置6个内设机构:(一)综合办公室负责综合协调所内各部门的有关事宜;负责组织制订与实施所内规章制度;负责工作计划的制定和总结;组织起草所内重要会议领导讲话、综合性报告等重要文稿;负责文秘、接待、政务信息、公文、文件管理、机要工作;负责会议的组织和决定事项的督办;负责检验样品管理及检验报告汇总、审核、校对等;负责质量管理体系的建立及运行工作;负责仪器设备管理及计量管理工作;承办所交办的其他事项。
![国家食品药品监督管理局关于印发医疗器械生物学评价和审查指南的通知-国食药监械[2007]345号](https://uimg.taocdn.com/3de2cc3aabea998fcc22bcd126fff705cc175c07.webp)
国家食品药品监督管理局关于印发医疗器械生物学评价和审查指南的通知制定机关国家食品药品监督管理局(已撤销)公布日期2007.06.15施行日期2007.06.15文号国食药监械[2007]345号主题类别药政管理,专利申请效力等级部门规范性文件时效性现行有效正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 国家食品药品监督管理局关于印发医疗器械生物学评价和审查指南的通知(国食药监械[2007]345号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局):为规范医疗器械生物学评价和审查工作,我局组织制定了《医疗器械生物学评价和审查指南》。
现印发给你们,请参照执行,并将有关事项通知如下:一、申请涉及生物学评价的产品注册的企业,可提供生物学评价报告(含支持性文件)代替产品注册检验报告中的生物学试验部分,或进行全项生物学试验。
二、国外企业提供的医疗器械生物学评价报告中含有生物学试验报告的,企业应提供生物学试验室所在国的GLP证明。
附件:1.医疗器械生物学评价和审查指南2.《医疗器械生物学评价报告》的出具与审查要点国家食品药品监督管理局二○○七年六月十五日附件1:医疗器械生物学评价和审查指南一、目的与范围为使GB/T 16886-ISO 10993系列标准能够正确而有效地实施,特制定本指南。
本指南为医疗器械评价者提供了生物学评价指南,为医疗器械的审查提供了生物安全性审查指南。
注:本指南不涉及微生物污染、灭菌(如“无菌”、“细菌内毒素”)、除菌和动物源性医疗器械的病毒去除与控制等方面的生物安全性。
二、术语(一)医疗器械:同《医疗器械管理管理条例》。
(二)制造者:医疗器械制造者或商标持有人/单位。

北京市食品药品监督管理局关于印发《北京市医疗器械生产企业信息采集和报告规定(试行)》的通知文章属性•【制定机关】北京市食品药品监督管理局•【公布日期】2017.09.04•【字号】京食药监械监〔2017〕37号•【施行日期】2017.09.04•【效力等级】地方规范性文件•【时效性】现行有效•【主题分类】医疗管理正文北京市食品药品监督管理局关于印发《北京市医疗器械生产企业信息采集和报告规定(试行)》的通知京食药监械监〔2017〕37号各有关单位:为深入贯彻落实《医疗器械监督管理条例》(国务院令第650号)、《医疗器械生产监督管理办法》(国家食品药品监督管理总局令第7号),加强对北京市医疗器械生产企业的监督管理,我局制定了《北京市医疗器械生产企业信息采集和报告规定(试行)》,现印发给你们,请遵照执行。
北京市食品药品监督管理局2017年9月4日北京市医疗器械生产企业信息采集和报告规定(试行)第一条为建立医疗器械生产企业基本情况和重大事项报告机制,加强医疗器械生产企业监督管理,根据《医疗器械监督管理条例》(国务院令第650号)、《医疗器械生产监督管理办法》(国家食品药品监督管理总局令第7号),制定本规定。
第二条北京市辖区内的医疗器械生产企业均应按本规定,对企业基本情况和重大事项进行报告。
第三条医疗器械生产企业在以下情况发生变化后,应在十日内填写《医疗器械生产企业基本情况和重大事项采集报告表》(见附件1),在向所属区食品药品监督管理局(以下简称区局)或市食品药品监管局直属分局(以下简称直属分局)报送:(一)企业基本情况第三类医疗器械产品注册证取得、变更及延续情况;企业联系方式,包括联系人、通讯地址、邮政编码、联系电话、传真、电子邮箱等。
(二)企业重大事项变化情况1.停产、恢复生产,委托或接受委托的变化情况。
2.企业生产、质量、技术负责人变化情况,以及专职检验人员、质量体系内审员变化情况。
3.生产场地变化情况(包括洁净间、灭菌场地、检验室、库房等);主要生产工艺、重要原材料及其供方变化情况。

国家食品药品监督管理局关于国家药品监督管理局10个医疗器械质量监督检验机构更名的通知文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2003.09.17•【文号】国食药监械[2003]244号•【施行日期】2003.09.17•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局关于国家药品监督管理局10个医疗器械质量监督检验机构更名的通知(国食药监械[2003]244号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局),有关医疗器械质量监督检验中心:根据《国务院关于机构设置的通知》(国发〔2003〕8号),在国家药品监督管理局基础上组建国家食品药品监督管理局。
为了理顺工作关系,保证医疗器械日常监督检验工作的开展,现决定将原国家药品监督管理局的10个医疗器械质量监督检验中心更名为国家食品药品监督管理局的10个医疗器械质量监督检验中心。
名单如下:国家药品监督管理局中检所医疗器械质量监督检验中心更名为国家食品药品监督管理局中检所医疗器械质量监督检验中心;国家药品监督管理局北京医疗器械质量监督检验中心更名为国家食品药品监督管理局北京医疗器械质量监督检验中心;国家药品监督管理局北大医疗器械质量监督检验中心更名为国家食品药品监督管理局北大医疗器械质量监督检验中心;国家药品监督管理局天津医疗器械质量监督检验中心更名为国家食品药品监督管理局天津医疗器械质量监督检验中心;国家药品监督管理局沈阳医疗器械质量监督检验中心更名为国家食品药品监督管理局沈阳医疗器械质量监督检验中心;国家药品监督管理局济南医疗器械质量监督检验中心更名为国家食品药品监督管理局济南医疗器械质量监督检验中心;国家药品监督管理局武汉医疗器械质量监督检验中心更名为国家食品药品监督管理局武汉医疗器械质量监督检验中心;国家药品监督管理局上海医疗器械质量监督检验中心更名为国家食品药品监督管理局上海医疗器械质量监督检验中心;国家药品监督管理局杭州医疗器械质量监督检验中心更名为国家食品药品监督管理局杭州医疗器械质量监督检验中心;国家药品监督管理局广州医疗器械质量监督检验中心更名为国家食品药品监督管理局广州医疗器械质量监督检验中心。

北京市食品药品监督管理局关于发布《北京市医疗器械网络销售监督管理办法实施细则(试行)》的通知文章属性•【制定机关】北京市食品药品监督管理局•【公布日期】2018.04.08•【字号】京食药监药械〔2018〕10号•【施行日期】2018.04.08•【效力等级】地方规范性文件•【时效性】现行有效•【主题分类】药政管理正文北京市食品药品监督管理局关于发布《北京市医疗器械网络销售监督管理办法实施细则(试行)》的通知京食药监药械〔2018〕10号为贯彻落实国家食品药品监督管理总局《医疗器械经营监督管理办法》(国家食品药品监督管理总局令第38号),进一步加强我市医疗器械网络销售和交易服务的监督管理工作,保障首都公众用械安全,北京市食品药品监督管理局制定了《北京市医疗器械网络销售监督管理办法实施细则(试行)》,经第10次局长办公会审议通过,现予以印发,请遵照执行。
特此通知。
北京市食品药品监督管理局2018年4月8日北京市医疗器械网络销售监督管理办法实施细则(试行)第一章总则第一条为加强医疗器械网络销售和医疗器械网络交易服务监督管理,保障公众用械安全,根据《中华人民共和国网络安全法》《医疗器械监督管理条例》《互联网信息服务管理办法》《医疗器械经营监督管理办法》《医疗器械网络销售监督管理办法》(以下简称《监督管理办法》),结合监管实际,制定本细则。
第二条在北京市行政区域内从事医疗器械网络销售、提供医疗器械网络交易服务及其监督管理,应当遵守本细则。
第三条北京市食品药品监督管理局负责制定全市医疗器械网络销售和交易服务监管政策,实施医疗器械网络交易服务第三方平台提供者(以下简称网络交易服务第三方平台)备案及监管工作,指导、督促区食品药品监督管理局及直属分局开展医疗器械网络销售监督管理工作,并组织开展医疗器械网络销售和交易监测处置工作。
区食品药品监督管理局及直属分局负责实施医疗器械网络销售备案工作,指导、督促辖区食品药品监督管理所开展医疗器械网络销售监督检查工作,开展医疗器械网络销售监测处置工作。

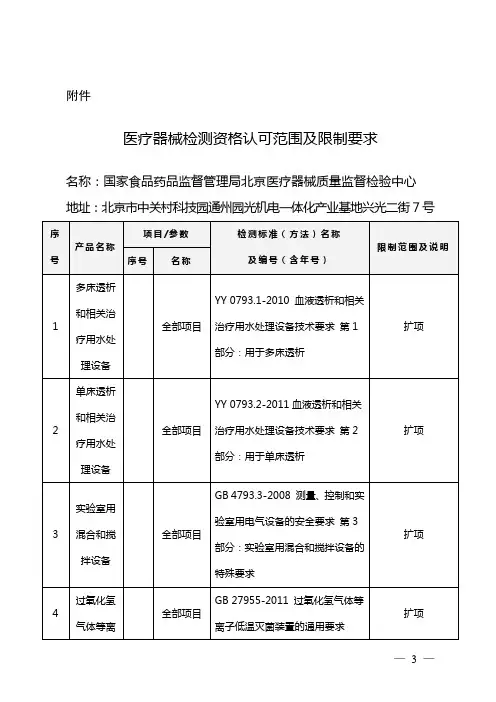
医疗器械检测中心联系地址1.国家食品药品监督管理局中检所医疗器械质量监督检验中心北京市天坛西里2号100050
2.国家食品药品监督管理局北京医疗器械质量监督检验中心北京市北三环中路2号100011
3.国家食品药品监督管理局北大医疗器械质量监督检验中心北京市海淀区中关村南大街22号100081
4.国家食品药品监督管理局济南医疗器械质量监督检验中心山东省济南市解放路11号250013
5.国家食品药品监督管理局上海医疗器械质量监督检验中心上海市民和路154号250013
6.国家食品药品监督管理局沈阳医疗器械质量监督检验中心辽宁沈阳市铁西区重工北街22号110026
7.国家食品药品监督管理局天津医疗器械质量监督检验中心天津市南开区红旗南路237号300191
8.国家食品药品监督管理局武汉医疗器械质量监督检验中心湖北省武汉市武昌中北路岳家咀430077
9.国家食品药品监督管理局杭州医疗器械质量监督检验中心浙江杭州市环城东路23号310009
10.国家食品药品监督管理局广州医疗器械质量监督检验中心广州市寺右新马路寺右中街9号510600。

医疗器械十大检测中心联系地址1.国家食品药品监督管理局中检所医疗器械质量监督检验中心北京市天坛西里2号100050
2.国家食品药品监督管理局北京医疗器械质量监督检验中心
北京市北三环中路2号100011
3.国家食品药品监督管理局北大医疗器械质量监督检验中心
北京市海淀区中关村南大街22号100081
4.国家食品药品监督管理局济南医疗器械质量监督检验中心山东省济南市解放路11号250013
5.国家食品药品监督管理局上海医疗器械质量监督检验中心
上海市民和路154号250013
6.国家食品药品监督管理局沈阳医疗器械质量监督检验中心
辽宁沈阳市铁西区重工北街22号110026
7.国家食品药品监督管理局天津医疗器械质量监督检验中心
天津市南开区红旗南路237号300191
8.国家食品药品监督管理局武汉医疗器械质量监督检验中心
湖北省武汉市武昌中北路岳家咀430077
9.国家食品药品监督管理局杭州医疗器械质量监督检验中心
浙江杭州市环城东路23号310009
10.国家食品药品监督管理局广州医疗器械质量监督检验中心
广州市萝岗区科学城光谱西路1号510663。
中国食品药品检定研究院医疗器械检定所中国食品药品检定研究院医疗器械检定所简介中国食品药品检定研究院医疗器械检定所是国家食品药品监督管理总局授权的全国医疗器械检定机构之一,也是全国性检验检测机构之一。
成立于1979年,是中国医院协会定点机构。
目前,医疗器械检定所已成为中国最具综合性的医疗器械检定机构之一,拥有完备的科研实验室,先进的设备仪器和高水平的技术团队。
医疗器械检定所的主要任务是开展医疗器械检定、技术研究、产品标准规范制定、技术咨询、质量监测、技术培训等业务。
并为食品药品监管部门提供技术支持服务,为市场监管和行业管理机构提供技术支持服务。
在医疗器械检定领域,医疗器械检定所具备较高的名誉度和公信力,在行业和用户中树立了良好的形象。
医疗器械检定所的主要业务一、医疗器械检定医疗器械检定是指对临床使用的各类医疗器械产品进行鉴定、测试、验证、检测和评价,以确定其性能和安全性的一项技术服务活动。
医疗器械检定所主要开展一般医疗器械、体外诊断试剂、医用耗材、医用材料等类别的检定业务,业务范围主要包括:1. 一般型医用设备检定:如麻醉机、除颤仪、电刀、输液泵、血压监护仪等。
2. 体外诊断试剂检定:如尿常规分析仪、血常规分析仪、生化分析仪、血型仪、荧光定量分析仪、ELISA检测试剂、快速诊断试剂等。
3. 医用材料检定:如医用外科手套、医用消毒液、医用绷带、医用手术刀片、医用透明胶带、医用注射器等。
二、技术研究和技术支持医疗器械检定所还积极开展医疗器械技术研究,提高自身技术水平和检定能力,紧跟国际医疗器械行业发展趋势。
同时,医疗器械检定所还积极为食品药品监管部门和市场监管、行业管理机构提供技术支持和服务,为医疗器械行业的规范化和健康发展做出贡献。
三、标准制定和质量监测医疗器械检定所还积极参与医疗器械相关标准的制定工作,并在相关标准的修订和完善等方面提供技术支持和建议。
同时,医疗器械检定所还开展质量监测业务,监测医疗器械产品的质量状况,帮助企业提高医疗器械产品的质量和竞争力。
国家药监局关于发布国家医疗器械监督抽检结果的通告(第1号)文章属性•【制定机关】国家药品监督管理局•【公布日期】2021.03.17•【文号】国家药品监督管理局通告2021年第22号•【施行日期】2021.03.17•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家药品监督管理局通告2021年第22号国家药监局关于发布国家医疗器械监督抽检结果的通告(第1号)为加强医疗器械监督管理,保障医疗器械产品质量安全有效,国家药品监督管理局组织对电位治疗设备、金属接骨螺钉等14个品种进行了产品质量监督抽检,共33批(台)产品不符合标准规定。
具体情况通告如下:一、抽检项目不符合标准规定的医疗器械产品(一)B型超声诊断设备/超声彩色血流成像系统2台:分别为成都汇声科技有限公司、Esaote S.p.A百胜股份有限公司生产,涉及样品在检验过程中不能正常使用、识别、标记和文件不符合标准规定。
(二)电位治疗设备1台:烟台亚利朗医疗器械有限公司生产,涉及正常工作温度下的连续漏电流和患者辅助电流不符合标准规定。
(三)金属接骨螺钉3批次:分别为广东施泰宝医疗科技有限公司、爱派司生技股份有限公司、Synthes GmbH辛迪思有限公司生产,涉及最大扭矩和断裂扭转角、尺寸(螺纹顶径和底径)不符合标准规定。
(四)麻醉机(麻醉系统)3台:分别为北京亿安吉医疗科技有限公司、江苏奥凯医疗设备有限公司、南京晨伟医疗设备有限公司生产,涉及传输气体浓度的准确性、麻醉气体输送系统、呼出气量监测不符合标准规定。
(五)人工晶状体1批次:1stQ GmbH生产,涉及光焦度不符合标准规定。
(六)天然胶乳橡胶避孕套3批次:分别为Nipponeka IndustriesSdn.Bhd、东洋松蒲乳胶(锦州)有限公司生产,涉及爆破体积和压力、针孔不符合标准规定。
(七)无创自动测量血压计(电子血压计)5台:分别为湖南诺盾医疗器械有限公司、深圳市贝莱斯电子科技有限公司、InBody Co.,Ltd.、深圳市惟拓力医疗电子有限公司、湖南三谊医疗科技有限公司生产,涉及说明书、可重复性、压力传感器准确性不符合标准规定。
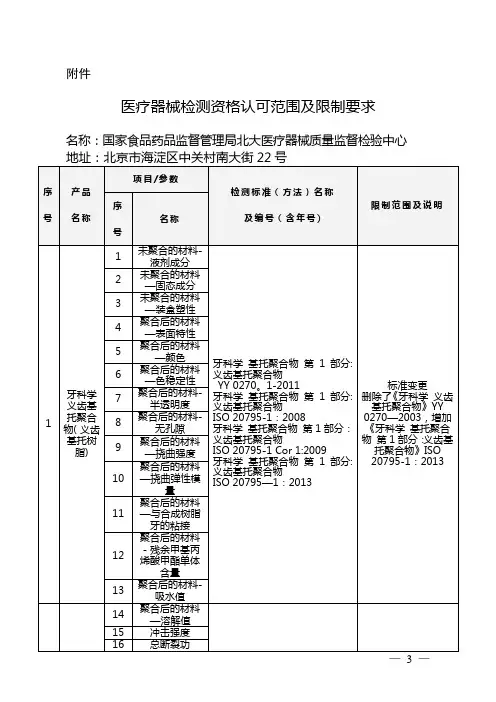
国家食品药品监督管理总局关于认可国家食品药品监督管理局北大医疗器械质量监督检验中心医疗器械产品和项目检测
资格的通知
【法规类别】质量管理监督机构与人员
【发文字号】食药监械管[2013]42号
【发布部门】国家食品药品监督管理总局
【发布日期】2013.07.01
【实施日期】2013.07.01
【时效性】现行有效
【效力级别】部门规范性文件
国家食品药品监督管理总局关于认可国家食品药品监督管理局北大医疗器械质量监督检
验中心医疗器械产品和项目检测资格的通知
(食药监械管〔2013〕42号)
国家食品药品监督管理局北大医疗器械质量监督检验中心:
根据《医疗器械监督管理条例》及《医疗器械检测机构资格认可办法(试行)》(国药监械〔2003〕125号)的规定,2012年6月23日至24日,原国家食品药品监督管理局组织专家组对国家食品药品监督管理局北大医疗器械质量监督检验中心的医疗器械检测能力进行了现场评审。
经审查,认可该中心修复用人工牙等133个医疗器械产品和项目(见附件)检测资格,有效期5年。
附件:医疗器械检测资格认可范围及限制要求
国家食品药品监督管理总局
2013年7月1日
附件
医疗器械检测资格认可范围及限制要求
名称:国家食品药品监督管理局北大医疗器械质量监督检验中心
地址:北京市海淀区中关村南大街22号。
国家食品药品监督管理局北京市医疗器械检验所
检验报告
报告编号:w(x)-1921-2015 共26页第1页样品名称医用X射线摄影系统型号规格Multi RAD
委托单位SEDECAL(Sociedad Espaola de
Electtomedicinay Calidad,S.A.)
商标SESECAL
客户地址C/Pelaya 9-13,poligono Industrial Rio
de Janeiro,18110Algete,Madrid,Spain
检验类别注册检验
受检单位SEDECAL(Sociedad Espaola de
Electtomedicinay Calidad,S.A.)
生产日期2014年6月
生产单位SEDECAL(Sociedad Espaola de
Electtomedicinay Calidad,S.A.)
抽样日期——
送样单位——到样日期——
抽样地点——抽样基数——
检验地点北京市医疗器械检验所样品数量1台
检验日期2014.6.20~2014.7.27 样品等级合格品
检验项目全部要求样品编号S1201-2
检验依据BS058010-2013数字化X射线摄影系统
检验结论符合BS058010-2013标准要求
(检验报告专用章)
备注1)报告中“--”表示此项不适应或此项空白。
2)判定中P为检测结果符合要求,F为检验结果不符合要求,N为要求不适用于该产品。
3)报告者GB9706.11-1997中压力容器和受压部件试验结果(45.2),认可企业提供的测试报告。
(E7843X型X射线管组件)。