物化第六章自测题
- 格式:doc
- 大小:117.50 KB
- 文档页数:5



第六章综合测试可能用到的相对原子质量:H1 C12 N14 O16 Na 23 Al 27 S 32 Cl 35.5 K 39 Cu 64 一、选择题(每小题3分,共48分。
每小题只有一个选项符合题意。
) 1.在密闭容器中进行如下反应:()()()2232SO g O g 2SO g +,已知反应过程中某一时刻2SO 、2O 、3SO 的浓度分别为0.2mol/L 、0.1mol/L 、0.2mol/L ,当反应达平衡时,可能存在的数据是( ) A .2SO 为0.4mol/L B .2SO 为0.25mol/L C .2SO 、3SO 均为0.15mol/L D .3SO 为0.4mol/L2.一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中和代表不同元素的原子。
关于此反应说法错误的是( ) A .一定属于吸热反应 B .一定属于可逆反应 C .一定属于氧化还原反应 D .一定属于分解反应3.下列反应中热量变化与图一致的是( )A .天然气的燃烧B .油脂在人体内氧化C .NaOH 溶液和3HNO 溶液反应D .氢氧化钡晶体和氯化铵晶体反应4.一种“即食即热型快餐”适合外出旅行时使用。
其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质混合并发生反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )A .浓硫酸与水B .生石灰与水C .熟石灰与水D .氯化钠与水5.下列说法不正确的是( ) A .原电池负极被氧化B .任何化学反应都能设计成原电池C .化学反应的速率和限度均可通过改变化学反应条件而改变D .化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变 6.下列有关化学反应速率和限度的说法中,不正确的是( ) A .实验室用22H O 分解制2O ,加入2MnO 后,反应速率明显加快 B .2232SO O 2SO +反应中,2SO 不能全部转化为3SOC .实验室用碳酸钙和盐酸反应制取2CO ,用碳酸钙粉末比用块状碳酸钙反应要快D .在金属钠与足量的水的反应中,增加水的量能增大反应速率7.氧化反应和还原反应分别在两个电极上自发进行时,便能构成原电池。

第六章相平衡练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、纯物质两相达平衡时,两相的吉布斯函数值一定相等. ()2、理想液态混合物与其蒸气达成气、液两相平衡时,气相总压力p与液相组成x B呈线性关系.()3、已知Cu-Ni 可以形成完全互溶固熔体,其相图如右图,理论上,通过精炼可以得到两个纯组分。
( )4、二组分的理想液态混合物的蒸气总压力介于二纯组分的蒸气压之间. ()5、在一定温度下,稀溶液中挥发性溶质与其蒸气达到平衡时气相中的分压与该组分在液相中的组成成正比。
()6、恒沸混合物的恒沸温度与恒沸组成不随压力而改变。
( )7、在一个给定的体系中,特种数可以分析问题的角度不同而不同,但独立组分数是一个确定的数。
()8、自由度就是可以独立变化的变量.()9、单组分体系的相图中两相平衡线都可以用克拉贝龙方程定量描述.()10、在相图中总可以利用杠杆规则计算两相平衡时两相的相对量.()二、选择题1、在p下,用水蒸气蒸馏法提纯某不溶于水的有机物时,系统的沸点:( )。
(1)必低于373。
2 K;(2)必高于373。
2 K;(3)取决于水与有机物的相对数量;(4)取决于有机物相对分子质量的大小。
2、已知A(l)、B(l)可以组成其t—x(y)图具有最大恒沸点的液态完全互溶的系统,则将某一组成的系统精馏可以得到:( ).(1)两个纯组分; (2)两个恒沸混合物;(3)一个纯组分和一个恒沸混合物。
3、已知A和B 可构成固溶体,在组分A 中,若加入组分B 可使固溶体的熔点提高,则组B 在此固溶体中的含量必________组分B 在组分液相中的含量。
(1)大于;(2)小于;(3)等于;(4)不能确定.4、硫酸与水可形成H2SO4⋅H2O(s),H2SO4⋅2H2O(s),H2SO4⋅4H2O(s)三种水合物,问在101325 Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种?( )(1)3种;(2) 2种;(3) 1种;(4) 不可能有硫酸水合物与之平衡共存5、对恒沸混合物的描写,下列各种叙述中哪一种是不正确的?(1) 与化合物一样,具有确定的组成;(2) 恒沸混合物的组成随压力的改变而改变;(3)平衡时,气相和液相的组成相同;(4)其沸点随外压的改变而改变.6、将固体NH4HCO3(s)放入真空容器中,等温在400 K,NH4HCO3按下式分解并达到平衡:NH4HCO3(s) = NH3(g)+ H2O(g) + CO2(g)系统的组分数C和自由度数F为:().(1)C=2,F=1;(2)C=2,F=2;(3)C=1,F=0; (4)C=3,F=2。
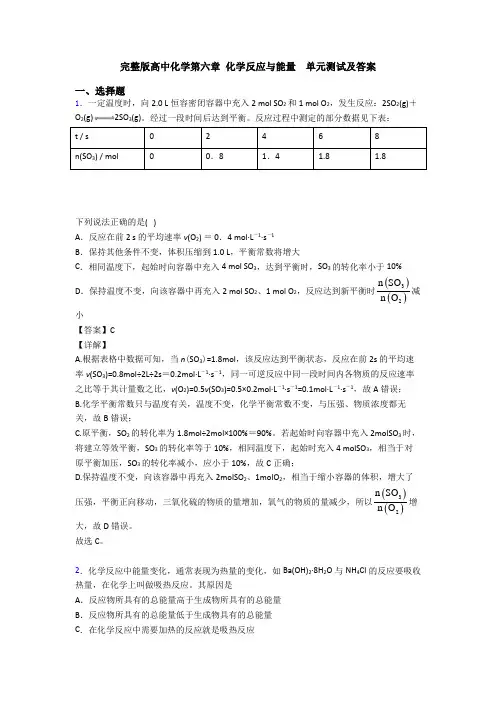
完整版高中化学第六章化学反应与能量单元测试及答案一、选择题1.一定温度时,向2.0 L恒容密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g)2SO3(g)。
经过一段时间后达到平衡。
反应过程中测定的部分数据见下表:t / s02468n(SO3) / mol00.81.4 1.8 1.8下列说法正确的是( )A.反应在前2 s 的平均速率v(O2) = 0.4 mol·L-1·s-1B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大C.相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率小于10%D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时() ()32n SOn O减小【答案】C【详解】A.根据表格中数据可知,当n(SO3)=1.8mol,该反应达到平衡状态,反应在前2s的平均速率v(SO3)=0.8mol÷2L÷2s=0.2mol·L-1·s-1,同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比,v(O2)=0.5v(SO3)=0.5×0.2mol·L-1·s-1=0.1mol·L-1·s-1,故A错误;B.化学平衡常数只与温度有关,温度不变,化学平衡常数不变,与压强、物质浓度都无关,故B错误;C.原平衡,SO2的转化率为1.8mol÷2mol×100%=90%。
若起始时向容器中充入2molSO3时,将建立等效平衡,SO3的转化率等于10%,相同温度下,起始时充入4 molSO3,相当于对原平衡加压,SO3的转化率减小,应小于10%,故C正确;D.保持温度不变,向该容器中再充入2molSO2、1molO2,相当于缩小容器的体积,增大了压强,平衡正向移动,三氧化硫的物质的量增加,氧气的物质的量减少,所以() ()32n SOn O增大,故D错误。

第六章相平衡练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、纯物质两相达平衡时,两相的吉布斯函数值一定相等。
()2、理想液态混合物与其蒸气达成气、液两相平衡时,气相总压力p与液相组成x呈线性关系。
()B3、已知Cu-Ni 可以形成完全互溶固熔体,其相图如右图,理论上,通过精炼可以得到两个纯组分。
()4、二组分的理想液态混合物的蒸气总压力介于二纯组分的蒸气压之间。
( )5、在一定温度下,稀溶液中挥发性溶质与其蒸气达到平衡时气相中的分压与该组分在液相中的组成成正比。
()6、恒沸混合物的恒沸温度与恒沸组成不随压力而改变。
( )7、在一个给定的体系中,特种数可以分析问题的角度不同而不同,但独立组分数是一个确定的数。
()8、自由度就是可以独立变化的变量。
()9、单组分体系的相图中两相平衡线都可以用克拉贝龙方程定量描述。
()10、在相图中总可以利用杠杆规则计算两相平衡时两相的相对量。
( )二、选择题1、在p下,用水蒸气蒸馏法提纯某不溶于水的有机物时,系统的沸点:()。
(1)必低于 K;(2)必高于 K;(3)取决于水与有机物的相对数量;(4)取决于有机物相对分子质量的大小。
2、已知A(l)、B(l)可以组成其t-x(y)图具有最大恒沸点的液态完全互溶的系统,则将某一组成的系统精馏可以得到:( )。
(1)两个纯组分;(2)两个恒沸混合物;(3)一个纯组分和一个恒沸混合物。
3、已知A和B 可构成固溶体,在组分A 中,若加入组分B 可使固溶体的熔点提高,则组B 在此固溶体中的含量必________组分B 在组分液相中的含量。
(1)大于;(2)小于;(3)等于;(4)不能确定。
4、硫酸与水可形成H2SO4H2O(s),H2SO42H2O(s),H2SO44H2O(s)三种水合物,问在101325 Pa的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种( )(1) 3种; (2) 2种; (3) 1种; (4) 不可能有硫酸水合物与之平衡共存5、对恒沸混合物的描写,下列各种叙述中哪一种是不正确的(1) 与化合物一样,具有确定的组成;(2) 恒沸混合物的组成随压力的改变而改变;(3) 平衡时,气相和液相的组成相同;(4) 其沸点随外压的改变而改变。

湖南省邵东县第一中学高中化学化学第六章化学反应与能量试题及答案一、选择题1.H2能在Cl2中燃烧生成 HCl,HCl也能在一定条件下分解为H2和Cl2。
图为H2、Cl2和HCl 三者相互转化的微观过程示意图,下列说法正确的是A.过程 1 放热B.过程 2 吸热C.过程 3 放热D.过程 4 放热【答案】C【详解】化学反应的过程中存在化学键的断裂与形成,其中键断裂吸热,键形成放热,图中过程1是吸热过程,过程2是放热过程,氢气在氯气中燃烧是放热过程,而氯化氢的分解是吸热过程,故答案为C。
2.工业合成氨反应在催化剂表面的反应历程及能量变化如图所示,下列说法正确的是( )A.合成氨的正、逆反应的焓变相同B.若使用催化剂,生成等量的NH3需要的时间更短C.在该过程中,N原子和H原子形成了含有非极性键的氨气分子D.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量【答案】B【详解】A.在可逆反应中,正反应和逆反应的焓变数值相同,但符号相反,A错误;B,使用催化剂,化学反应速率加快,生成等量的NH3需要的时间更短,B正确;C.N原子和H原子吸引电子的能力不同,形成的是极性键,C错误;D.根据图示,合成氨反应是放热反应,因此反应物断键吸收的能量小于生成物形成键释放的能量,D错误;答案选B。
3.对于可逆反应 4NH3+5O2⇌4NO+6H2O(g),下列叙述正确的是A.达到平衡时,4v(O2)正=5v(NO)逆B.达到平衡状态后,NH3、O2、NO、H2O(g)的物质的量之比为 4:5:4:6C.达到平衡状态时,若增加容器体积,则反应速率增大D.若单位时间生成 xmolNO 的同时,消耗 xmolNH3,则反应达到平衡状态【答案】A【详解】A.达到平衡时,4v(O2)正=5v(NO)逆,说明正逆反应速率相等,选项A正确;B.到达平衡时,反应混合物的物质的量关系与起始投入量及转化率有关,达到化学平衡时, NH3、O2、NO、H2O(g)的物质的量之比不一定为4∶5∶4∶6,选项B错误;C.达到平衡状态时,若增加容器体积,相当于减小压强,则反应速率减小,选项C错误;D.若单位时间生成xmolNO的同时,消耗xmolNH3,都是指正反应速率,无法说明正逆反应速率相等,则反应不一定达到平衡状态,选项D错误。

高一化学第六章化学反应与能量单元测试及答案一、选择题1.在密闭容器中进行下列反应:X2(g) +Y2(g)⇌2Z (g)。
已知X2、Y2和Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,当反应在一定条件下达到平衡时,各物质的浓度有可能是( )A.Y2为0.2mol·L-1B.Z为0.3mol·L-1C.X2为0.2mol·L-1D.Z为0.4mol·L-1【答案】B【详解】A.若Y2为0.2mol·L-1,Y2减少0.1mol·L-1,根据方程式,消耗X2 0.1mol·L-1,则X2的浓度0,可逆反应不可能彻底进行,故不选A;B.若Z为0.3mol·L-1,Z增加0.1mol·L-1,根据方程式,消耗X2 0.05mol·L-1、消耗Y20.05mol·L-1,则平衡时X2的浓度为0.05mol·L-1、Y2的浓度为0.25mol·L-1,符合可逆反应的特征,故选B;C.若X2为0.2mol·L-1,X2增加0.1mol·L-1,根据方程式,消耗Z 0.2mol·L-1,则Z的浓度0,可逆反应不可能彻底进行,故不选C;D.若Z为0.4mol·L-1,Z增加0.2mol·L-1,根据方程式,消耗X2 0.1mol·L-1、消耗Y2 0.1mol·L-1,则平衡时X2的浓度为0、Y2的浓度为0.2mol·L-1,可逆反应不可能彻底进行,故不选D;选B。
2.反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为:①v A═1mol/(L•min),②v C═0.5 mol/(L•min),③v B═0.5mol/(L•min),三种情况下该反应速率大小的关系正确的是( )A.②>③>①B.①>②>③C.③>①>②D.②>①>③【答案】C【详解】都转化为A表示的反应速率来比较反应速率的快慢。

第六章测评(时间:90分钟满分:100分)一、选择题(本题包括10小题,每小题只有一个正确选项,每小题2分,共20分)1.肯定条件下,某容器中各微粒在反应前后变更的示意图如下,其中和代表不同元素的原子。
关于此反应说法错误的是( )A.肯定属于吸热反应B.肯定属于可逆反应C.肯定属于氧化还原反应D.肯定属于分解反应解析视察示意图知,该反应的反应物是一种,生成物是两种,该反应为分解反应,一般的分解反应是吸热反应,但也有的分解反应(如2H2O22H2O+O2↑)是放热反应,A项错误、D项正确;依据图示可知,充分反应后,反应物与生成物共存,所以该反应是可逆反应,B项正确;该反应中反应物为化合物,生成物中有单质,有元素化合价的变更,属于氧化还原反应,C项正确。
2.“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O2Mg(OH)2。
下列关于该电池的说法错误的是( )A.镁片作为正极B.食盐水作为电解质溶液C.电池工作时镁片渐渐被消耗D.电池工作时实现了化学能向电能的转化,镁为负极,发生氧化反应;氧气在正极发生还原反应。
3.一种“即食即热型快餐”适合外出旅行时运用。
其内层是用铝箔包袱的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,运用时拉动预留在外的拉线,使这两种化学物质混合并发生反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )A.浓硫酸与水B.生石灰与水C.熟石灰与水D.氯化钠与水,但浓硫酸是液体,又具有猛烈的腐蚀性,不相宜给食品加热;而相同质量的生石灰和熟石灰分别溶于水,前者放出的热量比后者多;氯化钠溶于水能量变更不明显。
4.下列说法不正确的是( )A.原电池负极被氧化B.任何化学反应都能设计成原电池C.化学反应的速率和限度均可通过改变更学反应条件而变更D.化学反应达到平衡状态时,只要条件不变更,各物质的浓度就不再变更,因此非氧化还原反应是不能设计成原电池的。

人教版高中化学必修第二册第六章测试题及答案一、单选题(共15题)1.下列说法中不正确的是A.化学键的断裂与形成是化学反应过程的本质B.化学键的断裂与形成是化学反应中能量变化的主要原因C.从能量的角度看,断开化学键要吸收能量,形成化学键要放出能量D.若化学反应吸收能量时,其断键吸收的能量小于成键放出的能量2.SO2的催化氧化是工业制硫酸的一步重要反应,在恒容密闭容器中发生该反应:2SO3,下列有关说法不正确的是2SO2+O2催化剂ΔA.温度升高,可加快反应速率B.平衡时,SO2、SO3的浓度一定相等C.平衡时,正、逆反应速率相等且不为零D.平衡时,SO2或O2不可能100%转化为SO33.有A、B、C、D四种金属,当A、B用导线连接浸泡在稀硫酸中,组成原电池时,A的质量减小;将A、C分别投入等浓度的盐酸中,C比A反应剧烈;将金属B浸入到D的盐溶液中,有D生成。
则A、B、C、D金属活动性由强到弱的顺序为A.A>B>D>C B.A>B>C>DC.C>D>A>B D.C>A>B>D4.中华优秀传统文化涉及了很多化学知识。
下列有关说法错误的是A.《神农本草经》中“石胆……能化铁为铜、成金银”描述的是湿法炼铜B.刘长卿诗云“水声冰下咽砂路雪中平”,固态冰转化为液态水需要吸热C.《本草纲目拾遗》中对强水的记载:“性最猛烈,能蚀五金。
”强水为强电解质D.“火树银花合,星桥铁锁开”中涉及化学能转化为热能和光能5.下列装置能形成原电池的是A.B.C.D.6.化学反应的速率是通过实验测定的。
下列说法错误的是A.酸性KMnO4溶液和H2C2O4溶液反应,可以通过记录溶液褪色时间来测定反应速率B.锌与稀硫酸反应,可以通过测量一定时间内产生的H2体积来计算反应速率C .可以依靠科学仪器测量光的吸收、光的发射、导电能力等来测定反应速率D .恒温恒容条件下发生反应:222CO(g)H O(g)CO (g)H (g)++,可以通过测量单位时间内压强的变化来测定反应速率7.关于能源和能量转化,下列说法正确的是A .太阳能电池的能量转化:光能→化学能→电能B .生物光合作用中的能量转化:光能(太阳能)→生物质能(化学能)C .化学反应过程中,除了物质变化外,可能伴有能量变化D .燃气灶具中的能量转化:化学能全部转化为热能8.多个专家研究组经过通力合作,设计了双单原子协同催化剂,该催化剂在协同作用下不仅可以最大程度上提高原子利用率,而且可以提高催化剂的选择性。

第一章:气体的PVT 关系一、选择题1. 在温度、容积恒定的容器中,含有A 和B 两种理想气体,这时A 的分压和分体积分别是A p 和A V 。
若在容器中再加入一定量的理想气体C ,问A p 和A V 的变化为( C )。
(A )A p 和A V 都变大 (B ) A p 和A V 都变小(C ) A p 不变,A V 变小 (D ) A p 变小,A V 不变2. 在温度T 、容积V 都恒定的容器中,含有A 和B 两种理想气体,它们的物质的量、分压和分体积分别为n A ,p A ,V A 和n B ,p B ,V B 容器中的总压为p 。
试判断下列公式中哪个是正确的( A )。
(A )A A p V n RT = (B )B A B ()pV n n RT =+(C )A A A p V n RT = (D )B B B p V n RT =3. 已知氢气的临界温度和临界压力分别为633.3 K , 1.29710 Pa C C T p ==⨯。
有一氢气钢瓶,在298 K 时瓶内压力为698.010 Pa ⨯,这时氢气的状态为( B )。
(A )液态 (B )气态 (C )气-液两相平衡 (D )无法确定4. 在一个绝热的真空容器中,灌满373 K 和压力为101.325 kPa 的纯水,不留一点空隙,这时水的饱和蒸汽压为(D )。
(A )等于零 (B )大于101.325 kPa(C )小于101.325 kPa (D )等于101.325 kPa5. 真实气体在如下哪个条件下,可以近似作为理想气体处理( C )。
(A )高温、高压 (B )低温、低压(C )高温、低压 (D )低温、高压6. 在298K 时,地面上有一个直径为1m 的充了空气的球,其压力为100kPa ,将球带至高空,温度降为253K ,球的直径胀大到3m ,此时球内的压力为(D )。
(A )33.3 kPa (B )9.43 kPa (C )3.14 kPa (D )28.3 kPa7. 真实气体液化的必要条件是( B )。
第六章相平衡練習題一、是非題,下列各題的敘述是否正確,對的畫√錯的畫×1、純物質兩相達平衡時,兩相的吉布斯函數值一定相等。
()2、理想液態混合物與其蒸氣達成氣、液兩相平衡時,氣相總壓力p與液相組成x B呈線性關系。
()3、已知Cu-Ni 可以形成完全互溶固熔體,其相圖如右圖,理論上,通過精煉可以得到兩個純組分。
()4、二組分的理想液態混合物的蒸氣總壓力介于二純組分的蒸氣壓之間。
( )5、在一定溫度下,稀溶液中揮發性溶質與其蒸氣達到平衡時氣相中的分壓與該組分在液相中的組成成正比。
()6、恒沸混合物的恒沸溫度與恒沸組成不隨壓力而改變。
( )7、在一個給定的體系中,特種數可以分析問題的角度不同而不同,但獨立組分數是一個確定的數。
()8、自由度就是可以獨立變化的變量。
()9、單組分體系的相圖中兩相平衡線都可以用克拉貝龍方程定量描述。
()10、在相圖中總可以利用杠桿規則計算兩相平衡時兩相的相對量。
( )二、選擇題1、在p下,用水蒸氣蒸餾法提純某不溶于水的有機物時,系統的沸點:()。
(1)必低于373.2 K;(2)必高于373.2 K;(3)取決于水與有機物的相對數量;(4)取決于有機物相對分子質量的大小。
2、已知A(l)、B(l)可以組成其t-x(y)圖具有最大恒沸點的液態完全互溶的系統,則將某一組成的系統精餾可以得到:( )。
(1)兩個純組分;(2)兩個恒沸混合物;(3)一個純組分和一個恒沸混合物。
3、已知A和B 可構成固溶體,在組分A 中,若加入組分B 可使固溶體的熔點提高,則組B 在此固溶體中的含量必________組分B 在組分液相中的含量。
(1)大于;(2)小于;(3)等于;(4)不能確定。
4、硫酸與水可形成H2SO4?H2O(s),H2SO4?2H2O(s),H2SO4?4H2O(s)三種水合物,問在101325 Pa的壓力下,能與硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少種?( )(1) 3種;(2) 2種;(3) 1種;(4) 不可能有硫酸水合物與之平衡共存5、對恒沸混合物的描寫,下列各種敘述中哪一種是不正確的?(1) 與化合物一樣,具有確定的組成;(2) 恒沸混合物的組成隨壓力的改變而改變;(3) 平衡時,氣相和液相的組成相同;(4) 其沸點隨外壓的改變而改變。
完整版高中化学第六章化学反应与能量测试试题及答案一、选择题1.科学家近期研发出如图所示的水溶液锂离子电池体系,下列有关叙述错误..的是A.b电极不可用石墨替代LiB.正极反应为:Li1-x Mn2O4+xLi++xe- = LiMn2O4C.电池总反应为:Li1-x Mn2O4+xLi = LiMn2O4D.放电时,溶液中Li+从a向b迁移【答案】D【分析】锂离子电池中,b为Li,失去电子,作负极,LiMn2O4为正极;充电时Li+在阴极得电子,LiMn2O4在阳极失电子,据此分析。
【详解】A. C不能失电子,故b电极不可用石墨替代Li,A项正确;B. 正极发生还原反应,Li1-x Mn2O4得电子被还原,电极反应为:Li1-x Mn2O4+xLi++xe- =LiMn2O4,B项正确;C. Li失电子,Li1-x Mn2O4得电子,生成的产物为LiMn2O4,电池的总反应为:Li1-x Mn2O4+xLi = LiMn2O4,C项正确;D.放电时,阳离子移动到正极,即从b向a迁移,D项错误;答案选D。
2.化学反应中能量变化,通常表现为热量的变化,如Ba(OH)2·8H2O与NH4Cl的反应要吸收热量,在化学上叫做吸热反应。
其原因是A.反应物所具有的总能量高于生成物所具有的总能量B.反应物所具有的总能量低于生成物具有的总能量C.在化学反应中需要加热的反应就是吸热反应D.在化学反应中需要降温的反应就是放热反应【答案】B【分析】【详解】如果反应物的总能量高于生成物的总能量,则该反应是放热反应,反之是吸热反应,答案选B。
3.下列有关反应速率的说法正确的是()A.用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率B.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变C.SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢【答案】D【详解】A. 稀硫酸改为98%的硫酸,铁在浓硫酸中钝化而不能产生氢气,A错误;B. 100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,氯化钠不反应,但稀释了盐酸,氢离子浓度下降,故反应速率下降,B错误;C. 所以升高温度,反应速率加快,C错误;D. 有气体参加的反应,减小压强反应速率变慢,D正确;答案选D。
物理化学第06章习题(含答案)第六章测试练习选择题:1、某反应速率常数单位是mol·l-1·s-1,该反应级数为( D )A、3级B、2级C、1级D、0级2、某反应物反应了3/4所需时间是反应了1/2所需时间的2倍,则该反应级数为( B )A、0级B、1级C、2级D、3级3、某反应在指定温度下,速率常数是k=4.62×10-2min-1,反应物的初始浓度为0.1mol·l-1,则该反应的半衰期为( A )A、15minB、30minC、150minD、不能求解4、已知某反应的级数是一级,则可确定该反应一定是( D )A、简单反应B、单分子反应C、复杂反应D、上述都不对5、任何化学反应的半衰期与初始浓度c0、速率常数k的关系是( C)A、与k、c0均有关B、与c0有关,与k无关C、与k有关D、与c0无关,与k有关6、某反应进行时,反应物浓度与时间成线性关系,则此反应的半衰期与反应物初始浓度的关系是( A )A、成正比B、成反比C、平方成反比D、无关7、某复杂反应表观速率常数k与各基元反应速率常数间关系为k=k2(k1/2k4)1/2则表观活化能E a与各基元反应活化能E i之间关系是( B )A、E a=E2+1/2(E1-2E4)B、E a=E2+1/2(E1-E4)C、E a=E2+ (E1-2E4)1/2D、E a=E2×1/2(E1/ 2E4)8、半衰期为10天的某放射性元素净重8克,40天后其净重为( D )A、4克B、2克C、1克D、0.5克9、氢和氧的反应发展为爆炸是因为( D )A、大量的引发剂引发B、直链传递的速率增加C、自由基被消除D、生成双自由基,形成支链10、一个反应的活化能为83.68kJ·mol-1,在室温27℃时,温度每增加1K,反应速率常数增加的百分数( C )A、4%B、90%C、11%D、50%11、在T、V恒定的条件下,基元反应A(g)+B(g)→D(g),若初始浓度c A,0 >>c B,0,即在反应过程中物质A大量过剩,其反应掉的物质的量浓度与c A,0相比较,完全可以忽略不计。
第六章化学动力学(三)计算题1.293K时,敌敌畏在酸性介质中水解反响的速率常数为0.01127d-1。
若敌敌畏水解为一级反响,试求其水解反响的半衰期。
解:t1/2=ln2/k=0.6931/0.01127d-1=61.5d2.某人工放射性元素放出a粒子的半衰期为15h。
求该试样分解速率常数和分解 80%所需的时间。
解:放射性元素分解为一级反响,k=ln2/t1/2=0.6931/15h=0.04621h-1t=-ln(1-x)/k=-ln(1-0.8)/0.04621h-1=34.83h二级反响规律某溶液含有NaOH和CH3CO2C2H5,浓度均为0.0100mol·dm-3。
在308.2K时,反响经600s后有55.0% 的分解。
已知该皂化反响为二级反响。
在该温下,计算:反响速率常数?1200s能分解多少?分解50.0%的时间?解:(1)反响为NaOH+CH3CO2C2H5→CH3CO2Na+C2H5 OH该反响为二级且初浓度相同,故有dcA/dt=kcA2,cA=cA0(1-x),积分后得k=(1/t)(1/cA-1/cA0)=x/tcA0(1-x)=0.550/[600s×0.0100mol·dm-3×(1-0.550)]=0.204dm3·mol-1·s-1x=1/(1+1/ktc A0)=1/[1+1/(0.204dm3·mol-1·s-1×1200s×0.0100mol·dm-3)]0.710=71.0%t1/2=1/kc A0=1/(0.204dm3·mol-1·s-1×0.0100mol·dm-3)=490s4.溶液反响A+2B→2C+2D的速率方程为dc B/dt=kc A c B。
20℃下,反响开始时只有两反响物,其初浓度分别为0.01mol·dm-3和0.02mol·dm-3,反响26h后,测定c B=0.01562mol·dm-3,试求k。
物理化学第六章模拟试卷A班级 姓名 分数一、选择题 ( 共8题 16分 ) 1. 2 分在刚性密闭容器中,有下列理想气体的反应达到平衡 A(g) + B(g) =C(g) 若在恒温下加入一定量的惰性气体,则平衡将 ( ) (A) 向右移动 (B) 向左移动 (C) 不移动 (D) 无法确定2. 2 分在 298 K 时,气相反应H 2+I 2=2HI 的Δr G m $=-16 778 J ⋅mol -1,则反应的平衡常数K p$为: ( ) (A) 2.0×1012 (B) 5.91×106 (C) 873 (D) 18.93. 2 分饱和溶液中溶质的化学势μ与纯溶质的化学势μ*的关系式为: ( )(A )μμ=*(B )μμ>*(C )μμ<*(D )不能确定 4. 2 分已知反应 2NH 3= N 2+ 3H 2在等温条件下,标准平衡常数为 0.25,那么,在此条件下,氨的合成反应 (1/2) N 2+(3/2) H 2= NH 3 的标准平衡常数为: ( )(A) 4 (B) 0.5 (C) 2 (D) 1 5. 2 分Ag 2O 分解可用下面两个计量方程之一表示,其相应的平衡常数也一并列出:Ag O s Ag s O g 22212()()()→+ K P ()1 2422Ag O s Ag s O g ()()()→+ K p()2设气相为理想气体,且已知反应是吸热的,试判断下列结论哪个是正确的: ( )(A )K K P P ()()2112= (B )K K pp ()()21=(C )K p ()2随温度的升高而增大 (D )O 2气的平衡压力与计量方程的写法无关6. 2 分Ag 2O 分解可用下列两个反应方程之一表示,其相应的平衡常数也一并列出 I. Ag 2O (s) 2Ag (s) + (1/2) O 2 (g) K p (Ⅰ) II. 2Ag 2O (s) 4Ag (s) + O 2 (g) K p (Ⅱ)设气相为理想气体,而且已知反应是吸热的,试问下列哪个结论是正确的: (A) K p (Ⅱ) = K p (Ⅱ) (B) K p (Ⅰ) = K p 2(Ⅱ)(C) O 2 气的平衡压力与计量方程的写法无关 (D) K p (Ⅰ) 随温度降低而减小7. 2 分某低压下的气相反应,在 T =200 K 时K p =8.314×102 Pa ,则K c /mol·cm -3是:( ) (A) 5×102 (B) 14×106 (C) 14×103 (D) 0.58. 2 分理想气体反应CO g H g CH OH g ()()()+=223的r m ΔG $与温度T 的关系为:-1r m /J mol 2166052.92G ∆⋅=-+$(T /K),若使在标准状态下的反应向右进行,则应控制反应的温度: ( )(A )必须高于409.3 K (B )必须低于409.3 K (C )必须等于409.3 K (D )必须低于409.3 °C二、填空题 ( 共6题 12分 ) 9 2 分在温度为2000 K 时,理想气体反应CO g O g CO g ()()()+=1222的-1r m45817J mol G ∆=⋅$,则该反应的平衡常数K p = ()kPa -12。
湖南郴州市第一中学高中化学化学第六章化学反应与能量试题及答案一、选择题1.1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g) + aY(g)bZ(g),反应达到平衡后,测得X的转化率为50% 。
而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是A.a=l,b=2 B.a=2,b=1 C.a=2,b=2 D.a=3,b=2【答案】D【分析】1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g)+a Y(g)⇌b Z (g)。
反应达到平衡后,测得X的转化率为50%.而且,在同温同压下反应前后混合气体的密度之比和气体体积成反比即和气体物质的量成反比,讨论分析判断得到a、b的取值。
【详解】X(g)+a Y(g)⇌b Z(g)。
起始量(mol) 1 a 0变化量(mol) 0.5 0.5a 0.5b平衡量(mol) 0.5 0.5a 0.5b依据在同温同压下反应前后混合气体的密度之比和气体体积成反比即和气体物质的量成反比,在同温同压下测得反应前混合气体的密度是反应后混合气体密度的34,即反应后气体物质的量是反应前气体物质的量34,则得到;(0.5+0.5a+0.5b):(1+a)=3:4,计算得到:2b=a+1,依据选项中的取值分析判断,a=3,b=2符合计算关系。
故选D。
2.Mg-H2O2电池可用于驱动无人驾驶的潜航器。
该电池以海水为电解质溶液,示意图如图。
该电池工作时,下列说法正确的是()A.Mg电极是该电池的正极B.H2O2在石墨电极上发生氧化反应C.石墨电极附近溶液的碱性增强D.溶液中Cl-向正极移动【答案】C【分析】镁、过氧化氢和海水形成原电池,镁做负极发生氧化反应,过氧化氢在正极上发生还原反应,过氧化氢做氧化剂被还原为OH-,溶液pH增大,原电池中阴离子移向负极。
【详解】A.组成的原电池的负极被氧化,镁为负极,不是正极,故A错误;B.双氧水作为氧化剂,在石墨上被还原变为氢氧根离子,发生还原反应,故B错误;C.双氧水作为氧化剂,在石墨上被还原变为氢氧根离子,电极反应为,H2O2+2e-=2OH-,故溶液pH值增大,故C正确;D.溶液中Cl-移动方向与同外电路电子移动方向一致,应向负极方向移动,故D错误;答案选C。
第六章 化学平衡
一、 选择题
1.在温度T ,压力p 时,理想气体反应C 2H 6H 2(g)+C 2H 4(g)的
平衡常数K c /K x 比值为( )。
(a)RT (b)1/RT (c)RT /p (d)p /RT 2.气相反应A+B==2C+D 在298K ,恒定容器内进行,A 和B 的初始分压分别为101.325kPa ,当反应达平衡后,A 和B 的平衡分压均为1/3⨯101.325kPa ,起始时容器内不含C 和D ,则该反应在298K 时的K c /(mol ⋅dm -3)为( )。
(a)4.31⨯10-3 (b)8 (c)10.67 (d)16 3.标准态的选择对某些物理量有影响的是下述几组物理量中的( )。
(a) f ,μ,θ∆m r G (b) m ,μθ,A ∆ (c) a , μθ,θ∆m r G (d) a ,μ,0,,)/(=∂∂f
W p T G ξ
4.某实际气体反应的平衡常数用逸度表示为θf K ,则θf K 与下述物理量中有关的是( )。
(a)系统的总压力 (b)催化剂 (c)温度 (d)惰性气体的数量 5.反应CO(g)+H 2O(g)
CO 2(g)+H 2(g)在873K ,100kPa 下达化
学平衡,当压力增至5000kPa 时,各气体的逸度因子为2
CO γ=1.90,
2
H γ=1.10,CO γ=1.23,O H 2
γ=0.77,则平衡点将( )。
(a)向右移动 (b)不移动 (c)向左移动 (d)无法确定
6.在刚性密闭容器中,有下列理想气体反应达平衡
D(g)+E(g)F(g),若在恒温下加入一定量惰性气体,则平衡将
( )。
(a)向右移动 (b)向左移动 (c)不移动 (d)无法确定 7.在温度为1000K 时的理想气体反应2SO 3(g)==2SO 2(g)+O 2(g)的平
衡常数K p =29.0kPa ,则该反应的θ∆m r G 为( )
(a)28kJ ⋅mol -1 (b)10.3kJ ⋅mol -1 (c)-10.3kJ ⋅mol -1 (d)-28kJ ⋅mol -1
8.已知FeO(s)+C(s)==CO(g)+Fe(s),反应的θ∆m r H 为正,θ∆m r S 为正(设θ∆m r H 和θ∆m r S 不随温度而变化),欲使反应正向进行,则一定( )。
(a)高温有利 (b)低温有利 (c)与温度无关 (d)与压力有关
二、 填空题
1.在298K 时,反应N 2O 4(g)
2NO 2(g)的θp K =0.1132,当
k P a p p NO O N 1242==,反应将向 移动。
当kPa p O N 1042=,kPa
p NO 12=时,反应将向 移动。
2.实验证明:两块表面无氧化膜的光滑洁净的金属紧靠在一起时会自动粘合在一起,现有两个表面镀铬的宇宙飞船由地面进入外层空间对接时它们将 (填“会”或“不会”)自动粘在一起。
已知
θ∆m r G [Cr 2O 3(s),298.15K]=-1079kJ ⋅mol
-1
,设外层空间气压为
1.013⨯10-9Pa ,空气组成与地面相同,不考虑温度影响。
3.若以A 代表Na 2HPO 4,已知A ∙12H 2O(s)== A ∙7H 2O(s)+5H 2O(g),
A ∙7H 2O(s)== A ∙2H 2O(s)+5H 2O(g), A ∙2H 2O(s)== A(s)+2H 2O(g)。
三个反应各自的平衡水汽压力分别为0.02514p θ,0.0191p θ,0.0129p θ,298K 时的饱和水汽压为0.0313p θ。
现于某沙漠地区气温为298K ,相对湿度(实际水蒸气压与同温度下饱和水蒸气压的百分比值)稳定在45%,有一长期在此保存的A ∙7H 2O(AR)样品,该样品的稳定组成可能性最大的是 。
4.298K 时,水的饱和蒸气压为3.168kPa ,此时液态水的标准摩尔生
成Gibbs 自由能θ
∆m f G 为-237.19kJ ⋅mol -1,则水蒸气的标准摩尔生成
Gibbs 自由能为 。
5.一个抑制剂结合到碳酸酐酶中去时,在298K 下反应的平衡常数
为θa K = 4.17⨯107,θ∆m r H = -45.1kJ ⋅mol -1,则在该温度下反应的θ∆m r S
= J ⋅mol -1⋅K -1。
6.在1dm 3的玻璃容器内放入2.695g PCl 5,部分发生解离。
在250℃达平衡,容器内的压力是100kPa ,则解离度α= ,平衡常数K p = 。
7.温度从298K 升到308K ,反应的平衡常数加倍,则该反应的θ∆m r H =
(设其与温度无关)。
8. 分解反应A(s)
B(g)+2C(g),反应平衡常数θ
p K 和解离压p 解离
的关系为 。
9. 若用下列两个化学计量方程来表示合成氨的反应: (1) N
2(g) + 3H 2(g)
2NH 3(g),
(2)
21N 2(g) + 2
3
H 2(g) NH 3(g),
则K θ1,p 与K θ2,p 的关系为 。
三、 计算题
1.已知气相反应 2SO 2+ O 2=2SO 3的标准平衡常数 K θc 与 T 的函数关系为: lg K θc = 10 373K/T + 2.222 lg(T /K)-14.585
上述反应可视为理想气体反应。
(1) 求该反应在 1000 K 时的Δr U θm ,Δr H θm ,Δr G θ
m ; (2) 在1000 K ,2×101 325 Pa 下若有 SO 2,O 2,SO 3的混合气体,其中 SO 2占20%,O 2占20%(体积分数),试判断在此条件下反应的方向?
2.标准压力下,N 2O 4(g) 的解离度在60℃时为0.544,在100℃时为
0.892,求反应N 2O 4(g) = 2NO 2(g) 的θ∆m r H 及θ
m r S ∆(均可视为常数)。
3. 理想气体反应2A(g) = B(g),已知 298 K 时有如下数据:
(1)当系统中x A =0.50时,310K ,p θ下判断反应进行的方向。
(2)欲使反应向与(1)相反方向进行,T ,x A 不变,压力应控制在什么范围?若p ,x A 不变,温度应控制在什么范围?若T ,p 不变,x A 应控制在什么范围?
参考答案: 一、
daccccba 二、 1.右;左
2.不会(提示:因为反应Cr 2O 3(s)→2Cr(s)+3/2O 2(g)的∆r G m =935.2kJ ⋅mol -1>0) 3.A ∙2H 2O 4.-228.63kJ ⋅mol -1 5.-5.53
6.0.728;157.42kPa 7.52.9kJ ⋅mol -1 8. 3
3p )p 27p 4θθ=
(解离K
9. K θ1,p =(K θ2,p )2 三、
1.(1)Δr G m
$= -10.33 kJ·mol -1 Δr H m $= -1.884×105 J·mol -1
Δr U m $= -180.14 kJ·mol -1 (2)Q p = 22.2 Q p > K p
$
故反应自右向左进行
2. θ∆m r H =57.5 kJ·mol -1 , θ
m r S ∆=176.9 J·mol -1·K -1
3. (1)向左进行;
(2)p >4.35p θ, T <291.6K, x A >0.74。