有机硅化学概论
- 格式:pdf
- 大小:163.00 KB
- 文档页数:5
有机硅是新材料。
有机硅不但是七大战略性新兴产业之一新材料产业的重要组成部分,而且是其它产业不可或缺的配套材料,在发展战略性新兴产业中具有举足轻重的作用。
中国有机硅工业经过50多年的发展,已形成生产企业众多、产品种类齐全、与其他产业关联度高,发展潜力和市场前景巨大的高新技术产业。
有机硅具有独特性能。
由于硅在化学元素中独有的兼具有机和无机的性质,其Si-O-Si独特的结构决定了有机硅产品的独特性能是在诸多领域是难以被替代的,有机硅化合物是指分子结构中含有Si-C键、且至少有一个有机基是直接与硅原子相连的化合物;以重复的Si-X 键为主链的线型或环状聚合物叫有机硅聚合物;通常所说的有机硅即指有机硅聚合物。
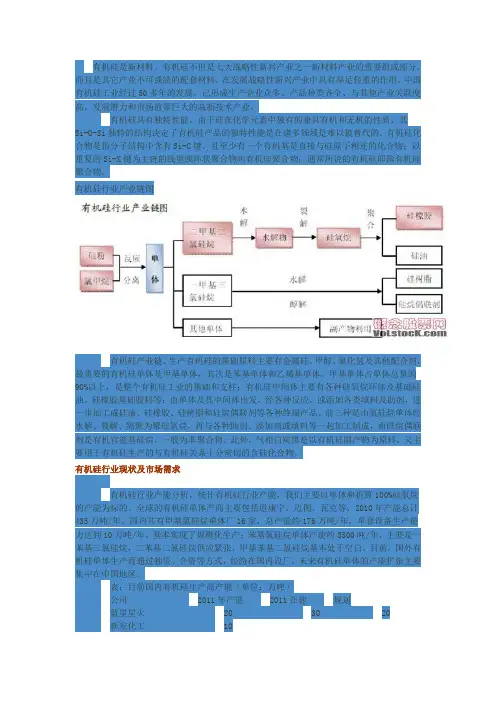
有机硅行业产业链图有机硅产业链。
生产有机硅的基础原料主要有金属硅、甲醇、氯化氢及其他配合剂,最重要的有机硅单体是甲基单体,其次是苯基单体和乙烯基单体。
甲基单体占单体总量的90%以上,是整个有机硅工业的基础和支柱;有机硅中间体主要有各种硅氧烷环体及基础硅油、硅橡胶基础胶料等;由单体及其中间体出发,经各种反应,或添加各类填料及助剂,进一步加工成硅油、硅橡胶、硅树脂和硅烷偶联剂等各种终端产品。
前三种是由氯硅烷单体经水解、裂解、缩聚为聚硅氧烷,再与各种助剂、添加剂或填料等一起加工制成,而硅烷偶联剂是有机官能基硅烷,一般为非聚合物。
此外,气相白炭黑是以有机硅副产物为原料,又主要用于有机硅生产的与有机硅关系十分密切的含硅化合物。
有机硅行业现状及市场需求有机硅行业产能分析。
统计有机硅行业产能,我们主要以单体和折算100%硅氧烷的产能为标的。
全球的有机硅单体产商主要包括道康宁、迈图、瓦克等,2010年产能总计435万吨/年。
国内共有甲基氯硅烷单体厂16家,总产能约176万吨/年,单套设备生产能力达到10万吨/年,基本实现了规模化生产;苯基氯硅烷单体产能约8500吨/年,主要是一苯基三氯硅烷,二苯基二氯硅烷供应紧张,甲基苯基二氯硅烷基本处于空白。


有机硅主要分类及概述
有机硅,也被称为胶状硅,是一类采用有机硅树脂或预硅化物作为基料,采用特殊的热固工艺,制成的宽范围的高分子材料。
因其材料具有优
异的机械性能和抗化学腐蚀性能及耐温性能,使其在航空航天、汽车制造、机械制造、能源开发、节能环保等行业中有着广泛的应用。
有机硅材料可
以分为热固性和半热固性两大类。
热固性有机硅,又称热固性有机硅树脂,是由硅氧环或硅氧环类化合物,经过聚合反应,形成芳环结构,制成透明至微薄黄色材料,具有良好
的热稳定性和耐化学腐蚀性,耐热性特别好,承受温度可达260℃。
热固
性硅树脂的主要性能,如粘附力、抗衡硬度、线绕线损失、厚度膨胀、氧
化稳定性、机械性能等,均要求很高。
热固性有机硅的应用,广泛地用于
生产电子工业用电缆和布线,绝缘层和绝缘层,电容器,电阻器和避雷器
等电气元器件,紧固件,汽车零部件等。
半热固性有机硅,也称聚氨酯硅树脂,主要由三氯甲烷、氧化硅及聚
氨酯为原料经过聚合反应制成,具有良好的机械强度、抗老化性能和耐油性,可弯曲,抗拉伸,热收缩性能优异,电绝缘性能也比热固性硅树脂更好。

在有机硅核心分子结构中加入不同分子及化合物能够增强或改变有机硅性质,使其具有令人惊奇的万能用途。
由此产生的材料适应性极强,可以产生 2000 多种不同的形态,如固体、液体、油品、油 脂、半粘软膏、抗泡剂、浸渍剂、脱模剂、硅橡胶等等。
高性能、高保护、多用途,引领生活方式有机硅正改变着我们的现在,描绘着我们的未来源于自然有机硅是一类聚合体的总称,其中包括硅氧烷及硅烷——均为地壳中含量位居第二的天然元素硅的 化合物变体。
以下是部分使用有机硅的重点行业:• 汽车• 航空航天• 建筑• 化妆品• 家用电器• 电子• 食品• 保健• 机械工程• 纸张• 橡胶• 表面涂料• 织物与皮革企业家、消费者及艺术家们都希望通过出色的材料帮助提供创新、经济的解决方案,以满足各行各业的尖端要求。
稳定。
有机硅是非常稳定的化合物,具有出色的抗风雨及老化的特性,并且能够承受极限的温度及气候的变化。
有机硅不会与化学物质发生反应,可以抵抗盐、风、水及辐射等气候的影响,并且具有出色的绝缘性能。
洁净。
有机硅可以与化学物质及材料共用,或是在化学物质及材料上使用,并且通常不会产生有害的副产品或气味。
有机硅可以防水,并且不会促进细菌及真菌的滋生。
使用有机硅制造的产品易于清洁。
在建材方面,有机硅可以防止潮湿及霉菌的损害。
采用有机硅制造的医疗器械易于消毒。
耐用。
有机硅有极强的抗磨损及抗撕裂的性能。
与许多合成材料不同,有机硅在长时间暴露于恶劣环境之后仍可保持其基本的化学及物理性质。
有机硅不但自身非常可靠,还可以延长许多材料的使用寿命。
适应性强、万能用途。
有机硅使用非常方便。
相对而言,其在许多行业中易于生产、易于使用。
有机硅:概述二构建生活的先进化学品有机硅是现代生活的基本构成成分,具有极为宽广的化学及物理特性,从而成为从航空到纺织各个行业用作增强性能的首选材料。
A V O 8 5 1 6有机硅可以用于先进的生产及加工过程,并且常常推动可以简化生产流程的新型技术的产生。



工业硅基础知识系列之:有机硅有机硅化合物是指含有硅碳键的化合物,且至少有一个有机基团通过硅碳键结合到硅原子上。
如甲基硅烷CH3SiH3、二甲基二氯硅烷(C2H5)2SiCl2等都是有机硅化合物,而SiC、Si3N4等则属于无机硅化合物。
自然界中至今未发现有机硅化合物的存在,只有在动物羽毛和禾本科植物中发现有硅酸酯类化合物,但这类物质并不含有硅碳键(Si-C),而只是含有硅-氧碳键(Si—O—C)。
有机硅高聚物的种类繁多,包括聚硅氧烷、聚硅烷、聚碳硅烷、聚氮硅烷等。
有机聚硅氧烷是其中最重要的一类,其结构可表示如下:其中,R为有机基团(如甲基、苯基等);n为硅原子上连接的有机基团数(n =1、2、3), m为聚合度。
一般认为的有机硅材料主要就是指以含聚硅氧烷主链的低聚或高聚物。
有机聚硅氧烷之所以有广泛的用途,主要由于它们具有其他高分子材料所无法比拟的独特性能:如耐高温、耐低温、防潮、绝缘、耐腐蚀、耐老化及生理惰性等。
有机硅高分子产品品种非常多样,有液体(硅油)、弹性体(硅橡胶)、树脂、乳液等,它们在宇航、航空、电气、电子、轻工、机械、化工、建筑、农业、医学、日常生活等方面均已得到广泛的应用。
有机硅材料在它的组成中既有无机硅氧烷链,又含有有机基团,是一种典型的半无机高分子。
而正是这种结构特点使它成为一种很特殊的高分子材料,并具有其它材料所不能同时具备的耐高温、阻燃、电气绝缘、耐辐射和生理惰性等一系列优良性能。
特别值得一提的是,有机硅工业的发展史不同于通用合成材料。
通用合成材料是以原料制造工艺、大型生产技术及产品的加工为中心发展的;而有机硅则是以产品开发为中心而发展的。
在近几十年来,有机硅单体的生产工艺变化不大,而有机硅技术重点主要在于产品应用上,如有机基团的引入、聚合物结构和交联技术等方面。
有机硅材料可以根据需要,设计出各种不同分子结构以满足各行各业不同场合下的使用要求。
在设计多用途产品时,可以采取下列途径。




有机硅主要分类有机硅主要分为硅油、硅橡胶、硅树脂和硅烷偶联剂四大类。
分别介绍如下:一、硅油硅油是一种不同聚合度链状结构的聚有机硅氧烷。
它是由二甲基二氯硅烷加水水解制得初缩聚环体,环体经裂解、精馏制得低环体,然后把环体、封头剂、催化剂放在一起调聚就可得到各种不同聚合度的混合物,经减压蒸馏除去低沸物就可制得硅油。
最常用的硅油,有机基团全部为甲基,称甲基硅油。
有机基团也可以采用其它有机基团代替部分甲基基团,以改进硅油的某种性能和适用各种不同的用途。
常见的其它基团有氢、乙基、苯基、氯苯基、三氟丙基等。
近年来,有机改性硅油得到迅速发展,出现了许多具有特种性能的有机改性硅油。
硅油一般是无色(或淡黄色),无味、无毒、不易挥发的液体。
硅油不溶于水、甲醇、二醇和- 乙氧基乙醇,可与苯、二甲醚、甲基乙基酮、四氯化碳或煤油互溶,稍溶于丙酮、二恶烷、乙醇和了醇。
它具有很小的蒸汽压、较高的闪点和燃点、较低的凝固点。
随着链段数n的不同,分子量增大,粘度也增高,固此硅油可有各种不同的粘度,从0.65厘沲直到上百万厘沲。
如果要制得低粘度的硅油,可用酸性白土作为催化剂,并在180℃温度下进行调聚,或用硫酸作为催化剂,在低温度下进行调聚,生产高粘度硅油或粘稠物可用碱性催化剂。
硅油按化学结构来分有甲基硅油、乙基硅油、苯基硅油、甲基含氢硅油、甲基苯基硅油、甲基氯苯基硅油、甲基乙氧基硅油、甲基三氟丙基硅油、甲基乙烯基硅油、甲基羟基硅油、乙基含氢硅油、羟基含氢硅油、含氰硅油等;从用途来分,则有阻尼硅油、扩散泵硅油、液压油、绝缘油、热传递油、刹车油等。
硅油具有卓越的耐热性、电绝缘性、耐候性、疏水性、生理惰性和较小的表面张力,此外还具有低的粘温系数、较高的抗压缩性)有的品种还具有耐辐射的性能。
二、硅橡胶2.1高温硫化硅橡胶高温硫化硅橡胶是高分子量(分子量一般为40~80万)的聚有机硅氧烷(即生胶)加入补强填料和其它各种添加剂,采用有机过氧化物为硫化剂,经加压成型(模压、挤压、压延)或注射成型,并在高温下交链成橡皮。
有机硅介绍有机硅是一种含有碳硅键的化合物,具有独特的化学性质和广泛的应用领域。
有机硅化合物是由硅、碳、氢和氧等元素组成的化合物,其中硅与有机基团形成的碳硅键是其最显著的特征。
有机硅化合物具有许多特殊性质,如热稳定性、化学稳定性、电绝缘性能和生物相容性等,因此在医药、农业、化工、电子等领域有着广泛的应用。
有机硅化合物可根据硅与有机基团的连接方式分为线性有机硅化合物和交联有机硅化合物两大类。
线性有机硅化合物是由硅原子与有机基团直接通过硅碳键连接而成的,如硅烷、硅醇、硅氧烷等;而交联有机硅化合物则是由硅原子与有机基团通过硅氧键连接形成的,如硅橡胶、硅树脂、硅胶等。
这两类有机硅化合物在性质和用途上有着明显的区别,可根据具体需求选择合适的类型。
有机硅化合物在医药领域中有着重要的应用。
例如,硅树脂是一种生物相容性良好的材料,可用于制备医用填充材料、修复材料和药物缓释系统等。
硅橡胶具有优异的耐高温、耐低温性能,被广泛应用于医疗器械、医用管道等领域。
此外,有机硅化合物还可用于合成药物、生物传感器等领域,为医药科研和临床治疗提供了重要支持。
在农业领域,有机硅化合物也发挥着重要作用。
硅是植物生长所必需的微量元素,有机硅化合物可作为硅肥施用于植物生长过程中,提高植物的抗逆性、抗病性和产量。
此外,有机硅化合物还可用作农药的添加剂,增强农药的稳定性和生物利用率,减少对环境的污染。
在化工领域,有机硅化合物被广泛用于聚硅氧烷、硅烷偶联剂、硅油等化工产品的生产。
聚硅氧烷是一类重要的高分子材料,具有优异的耐热性、耐腐蚀性和绝缘性能,可用于制备密封材料、润滑油、涂料等产品。
硅烷偶联剂可用于改性聚合物、填料表面处理等领域,提高材料的附着力和耐热性。
硅油是一种优良的润滑剂和绝缘油,被广泛应用于机械设备、电气设备等领域。
总的来说,有机硅化合物具有多样的性质和广泛的应用领域,在医药、农业、化工等领域发挥着重要作用。
随着科学技术的发展,有机硅化合物的研究和应用将会得到进一步拓展和深化,为人类社会的发展和进步做出更大的贡献。
有机硅是日常生活所需各种产品的重要成分。
气囊、密封剂、静脉管道、微型芯片、涂料、掌上电脑设备、抗紫外线防晒霜及防毒面具不过是其中的几个例子。
有机硅可以解决一般及特殊的问题,使产品更加坚固、稳定、更具韧性、更为美观、易于使用或施用、寿命更长。
同时使得材料可以达到企业及消费者要求的更高标准。
高性能、高保护、多用途,引领生活方式有机硅正改变着我们的现在,描绘着我们的未来从农业到航空有机硅可以改善我们的生活质量,使我们能够最大限度地利用资源。
有机硅可以为消费者及企业提供各种解决方案来满足他们的需求。
有机硅更能够帮助人们将先进的思想转化为现实。
从农业到航空,有机硅可以提高现有材料的性能并可形成新型的材料。
与此同时,有机硅带来的新技术可以简化生产过程、节省时间、节约开支并降低对环境的影响。
性能最佳有机硅推动了优质、创新产品的诞生。
从微波炉门的保护密封到重病看护病房挽救生命的呼吸器,有机硅都可以提高性能,取得最理想的效果。
• 化肥及作物保护等农产品利用了有机硅的泡沫控制以及扩展、渗透性能。
这样可以最大限度提高喷洒覆盖率及土壤吸收性,从而促进作物生长并提高产量。
• 有机硅可以隔离保护极为敏感的电子元件,如电脑、手机以及呼机的微型芯片,公共电缆、工业马达、机车、卫星以及飞机引擎的超导体等。
• 有机硅可以确保建材的稳固、吸收应力及安全移位,使其结构更为坚固、安全。
木制地板、泳池、混凝土大桥以及摩天大楼的玻璃幕墙均受益于此。
• 有机硅几乎可以用于汽车、海洋船舶、飞机及宇宙飞船的所有接合处及垫圈的覆盖、密封、涂敷及防风化。
由于部件可以保持完好,使得车辆可以在不牺牲功能或安全的极限条件(风、水以及大气)下高速运行。
• 有机硅具有润湿、扩展特性,使用时可以增加化妆品、洗液以及清洁剂的顺滑感、均匀度。
有了有机硅,“持久型”化妆品能够保持其色彩及光泽,洗发剂及护发剂可以使头发更有光泽、更加有形、柔软。
• 有机硅帮助实现了纺织业的创新,为纺织品、织物及无纺织物带来了柔软等各种“有机硅:概述一满足现代社会的需求现代社会希望通过技术创新及产品开发使我们更长寿、更健康、并拥有更美好的生活。
第二章:高分子材料概论2.8有机硅材料主要内容:2.8.1 有机硅材料概述2.8.2主要有机硅的合成单体2.8.3 主要有机硅聚合物性能和应用简介2.8.4 思考题2.8.1 有机硅材料概述一、医用高分子的定义有机硅就是指一种元素有机化合物,凡是硅原子上接有传统的有机基团的(烃及其衍生物)都叫有机硅,这实际上是一个最广义的定义。
19世纪人们对以碳为骨架的有机化合物认识比较多了,因此对碳的同族元素硅有了极大的兴趣,想发现像碳族物质一样的奇迹,从研究甲硅烷(SiH4或叫硅甲烷)到研究硅烯(Si=Si化合物),投入了不少力量,收效甚微,但人们却发现了许多甲硅烷的衍生物并不难获得,先后合成了卤代硅烷、烃代硅烷、烃氧基硅烷等等,并制定了相应的命名原则。
20世纪20年代之后,高分子学科形成并迅速发展,许多科学家致力于研究硅烷的水解缩合反应,希望制得像玻璃一样的耐热性有机(半有机)聚合物。
到三十年代,研究取得长足进展,先后合成厂有机硅树脂和线性聚合物,其主要骨架是—Si—O—Si—O—Si,通称为聚硅氧烷,后来简称为“有机硅”,中国的习惯是把那些聚合起来的聚硅氧烷类化合物,尤其是高分子聚合物,称为“有机硅”,后来又把合成“有机硅”的单体,也笼统地称为“有机硅”。
再后来又把一些可作单体,也可作其它用途的一些低分子(如现在常说的硅烷偶联剂)也归入“有机硅”。
现在合成了一些不是—Si—O—Si—O骨架,而是—Si—Si —Si骨架的聚合物,还叫有机硅。
不过我们通常讲的“有机硅”,仍然是Silicone的含义,即指聚硅氧烷高分子物质,并略微扩大到合成它们的单体,因为现在许多单体己商品化了,统称它们为“有机硅单体”,也可简称“有机硅”。
按照中国习惯,根据聚硅氧烷的结构特征,把那些含有体型结构或者具有可交联基团,以利于形成网状立体结构的预聚物称为有机硅树脂,简称硅树脂。
把线性聚合物中分子量较小的,叫有机硅抽,常称为硅油。
有机硅内容2)硅油有机硅具有独特的硅氧键结构Si-O-Si,赋予较大的键角和键长,分子间作用力小,不像一般的有机分子容易结晶,因此,透气性良好;其较高的键能,使有机硅聚合物具有突出的耐热性和优异的柔软性,其分子链的螺旋结构和甲基纵向外侧,使之具有极低的表面张力,良好的拒水性能。
因为硅氢键(Si-H)具有较大的活性,能在高温和金属盐作用下发生水解和缩合交联成膜,有机硅季铵盐的活性基团有抗菌、防霉的功能,由于结构上的特殊性,使有机硅氧烷聚合物具有润滑、柔软、拒水、消泡、抗菌防霉等一系列特性,适用于个人护理用品中。
含聚硅氧烷的化妆品的特性主要有:①润滑性能好,涂敷皮肤后能形成一层均匀的具有防水性的保护膜,但又没有任何粘性和油腻的感觉,光泽好。
②抗紫外线辐射的性能好。
它在紫外线照射下不会氧化变质而引起对皮肤的刺激。
③抗静电性能好。
试验表明,擦过含聚硅氧烷护肤霜的皮肤静电全部消除,并有明显的防尘效果。
④透气性好,即使在皮肤上形成硅氧烷膜也不影响汗液排出。
它对香精香料具有缓释定香作用,因而保香期较长。
⑤稳定性高,化学上惰性,对化妆品其他组成,特别是活性成分没有任何不良影响,配伍性好。
⑥无毒、无臭、无味,对皮肤不会引起刺激和过敏,安全性高,对某些皮肤病具有一定疗效,如发汗困难型湿疹、神经性皮炎和职业性皮炎等。
硅油是目前应用较广泛的一类调理剂,一般会制成乳液型式。
它可在头发上形成有效的保护膜,显著改善头发的干湿梳理性,赋予头发润滑、柔顺和光泽等;硅油的使用,可极大地改善发丝的梳理性及赋予发丝特殊的滑爽、光亮及防尘抗静电性能;长期使用不会在头发上积聚,同时能降低阴离子表面活性剂对眼睛的刺激性。
硅油一般分为普通硅油与改性硅油,迄今,已开发成功用于化妆品的有机硅产品有:二甲基聚硅氧烷,甲基苯基聚硅氧烷,甲基含氢硅油,聚醚改性硅油,长链烷基改性硅油,环状聚硅氧烷,氨基改性硅油,羧基改性硅油,甲基聚硅氧烷乳液,有机硅腊,硅树脂,有机硅处理的粉体等系列。
有机硅的定义
凡是含Si—C键的化合物通称为有机硅化合物,习惯上也常把那些通过氧、硫、氮等使有机基与硅原子相连接的化合物也当作有机硅化合物。
其中,以硅氧键(—Si—0—Si—)为骨架组成的聚硅氧烷,是有机硅化合物中为数最多,研究最深、应用最广的一类,约占总用量的90%以上。
由于有机硅兼备了无机材料与有机材料的性能,因而具有耐高低温、电气绝缘、耐臭氧、耐辐射、难燃、憎水、耐服饰、无毒无味以及生理惰性等优异特性,广泛运用于电子电气、建筑、化工、纺织、轻工、医疗等各行业,应用有机硅的主要功能包括:密封、封装、粘合、润滑、涂层、层压、表面活性、脱膜、消泡、发泡、交联、防水、防潮、惰性填充等。
并且随着有机硅数量和品种的持续增长,应用领域不断拓宽,形成化工新材料界独树一帜的重要产品体系,许多品种是其他化学品无法替代而又必不可少的。
有机硅是做硅的化合物,多晶硅是做硅的晶体用于半导体和太阳能硅(Si)是地球上含量很丰富的元素,在表层占第二位(25.8%),仅次于占第一位(49.5%)的氧(O)元素。
提起硅的用途,大概人人耳尽能详,“硅谷”早已不是什么新名词,硅半导体材料催生了现代电子工业,乃至日新月异的IT产业,它的神奇魔力造就了“新经济”的滚滚浪潮;另外,以硅酸盐为基础的无机硅化合物(岩石、沙砾、水晶等)由于广泛存在于自然界中,取之不尽、用之方便,几千年来人们就利用其做成水泥、陶瓷、玻璃等制品为自己的生活服务。
涉及到证券市场上有关的上市公司,前者有有研硅股、浙大海钠,星新材料,后者就更多,如大同水泥、华光陶瓷类等公司。
本文要谈的是硅的第三种用途——有机硅化合物。
谈到有机硅化合物,多数人却知之甚少,证券市场目前也鲜见其踪影。
其实,这种自然界并不存在的、由人工合成的化合物,自40年代实现工业化以来,得到了蓬勃的发展,其应用范围也从军工、国防逐渐深入到人们日常生活的各个领域,如用于计算机、手机和各类电器键盘的导电按键,隐型眼镜,游泳镜和游泳帽,儿童用的奶嘴,高层建筑的玻璃幕墙的粘接剂,医用的人造器官,皮革、高级织物的整理剂,以及高级洗发水中的硅油柔顺剂都离不开有机硅。
可以说,有机硅化合物在人们的衣、食、住、行、医疗、美容,以及上天入海的诸多方面都有其可以发挥作用的地方,它已成为人们的日常生活中不可或缺的一部分,成为化工新材料的佼佼者,其发展正可谓方兴未艾。
有机硅本身不仅是一种新型材料,而且为相关工业领域的发展提供了新材料基础和技术保证,鉴于有机硅材料产品千变万化,具有“直接用量不大但用途广泛”的特点,因此获得了“工业味精”、“科技发展催化剂”的美誉。
有机硅行业除了少数上游的单体企业规模较大外,大量的是从事制品、添加剂生产的中小民营企业,相信随着我国主板市场规模的不断扩大,特别是二板市场的推出、企业所有制限制的放宽,必将有充满勃勃生机的有机硅企业在未来的证券市场上大显身手。
1. Introduction to Silicone ChemistryA. Colas, Dow Corning Europe SA, Seneffe (Belgium)By analogy with ketones, the name “silicone” was given in 1901 by Kipping to describe new compounds of the brut formula R2SiO. These were rapidly identified as being polymeric and actually corresponding to polydialkylsiloxanes. Among them, the most common are polydimethylsiloxanes (PDMS), trimethylsilyloxy terminated with the structure:The methyl groups along the chain can be substituted by many other groups (e.g., phenyl, vinyl or trifluoropropyl). The simultaneous presence of “organic” groups attached to an “inorganic” backbone gives silicones a combination of unique properties and allows their use in fields as different as aerospace (low and high temperature performance), electronics (electrical insulation), health care (excellent biocompatibility) or in the building industries (resistance to weathering).NomenclatureThe main chain unit in PDMS, - (SiMe2O) -, is often shortened to the letter D because, as the silicon atom is connected with two oxygen atoms, this unit is capable of expanding within the polymer in two directions. In a similar way, M, T and Q units can be defined corresponding to [1]:The above polymer (1) can also be described as MD n M. This allows simplifying the description of various structures like (Me3SiO)4Si or tetrakis(trimethylsilyloxy)silane, which becomes M4Q. Superscripts are sometimes used to indicate groups other than methyl (e.g.,D H for HMeSiO2/2).The synthesis of siloxanes has been described elsewhere [1, 2, 3]. In summary, PDMS is obtained from the hydrolysis of dimethyldichlorosilane Me2SiCl2, which leads to a mixture of linear and cyclic oligomers:Higher molecular weight PDMS is obtained after polymerisation, for example, of the above cyclics in the presence of an end-blocker such as hexamethyldisiloxane and catalysed by a strong acid or strong base according to:Using other chlorosilanes, different end-blockers and/or different cyclics leads to many structures including polymers with various functional groups grafted on the polymer chain and/or at the polymer ends (e.g., vinyl, hydrogeno, phenyl, amino alkyl). These can be formulated into solvent-based, emulsion or solventless products.Reactive polymers can be cross-linked into elastomers using:• a peroxide-initiated reaction; in particular, if the silicone polymer carries some vinyl groups• a condensation reaction; for example, between a hydroxy end-blocked PDMS and an alkoxysilane, in presence of tin salt or titanium alkoxide as catalyst •an addition reaction; for example, between a vinyl-functional PDMS and an hydrogenomethyl dimethyl siloxane oligomer, in presence of a organic platinumcomplexSuch polymer, cross-linker and catalyst are formulated with various additives as one-part, ready-to-use products or two-part products to be mixed prior to use and to cure at room temperature or only at elevated temperatures.Physicochemical PropertiesThe position of silicon, just under carbon in the periodic table, led to a belief in the existence of analogue compounds where silicon would replace carbon. Most of these analogue compounds do not exist, or if they do, they behave very differently. There are few similarities between Si-X bonds in silicones and C-X bonds [1-3]:Element (X) Bond length (Å) Ionic character (%)Si - X C - X Si - X C - X Si 2.34 1.88 -- 12C 1.88 1.54 12 --H 1.47 1.07 2 4O 1.63 1.42 50 22Between any given element and silicon, bond lengths are longer than for carbon with this element. The lower silicon electronegativity (1.8) vs. carbon (2.5) leads to a verypolarised Si-O bond, highly ionic and with a large bond energy, 452 kJ/mole (108 kcal/mol). The Si-C bond has a bond energy of ±318 kJ/mole (76 kcal/mol), slightly lower than a C-C bond, while the Si-Si bond is weak, 193 kJ/mole (46.4 kcal/mole). These values partially explain the stability of silicones; the Si-O bond is highly resistant to homolytic scission. On the other hand, heterolytic scissions are easy, as demonstrated by the re-equilibration reactions occurring during polymerisations catalysed by acids or bases. Silicon atoms do not form stable double or triple bonds of the type sp2 or sp with other elements, yet the proximity of the d orbitals allows d -p retro-coordination. Because of this retro-coordination, trialkylsilanols are more acid than the corresponding alcohols. Yet, the involvement of retro-coordination is challenged [4].Another example of the difference between analogues is the tetravalent diphenyldisilanol, (C6H5)2Si(OH)2, which is stable, while its carbon equivalent, a gem-diol, dehydrates. The Si-H bond is weakly polarised, but here in the direction of a hydride, and is more reactive than the C-H bond. Overall, there are few similarities between a silicone polymer and a hydrocarbon polymer.Silicones display the unusual combination of an inorganic chain similar to silicates and often associated with high surface energy but with side methyl groups that are, on the contrary, very organic and often associated with low surface energy [4]. The Si-O bond are strongly polarised and without protection should lead to strong intermolecular interactions. However, the methyl groups, only weakly interacting with each other, shield the main chain.This is made easier by the high flexibility of the siloxane chain; rotation barriers are low, and the siloxane chain can adopt many conformations. Rotation energy around a CH2-CH2 bond in polyethylene is 13.8 kJ/mol but only 3.3 kJ/mol around a Me2Si-O bond, corresponding to a nearly free rotation. The siloxane chain adopts a configuration that can be idealised by saying that the chain exposes a maximum number of methyl groups to the outside, while in hydrocarbon polymers, the relative backbone rigidity does not allow “selective” exposure of the most organic or hydrophobic methyl groups. Chain-to-chain interactions are low, and the distance between adjacent chains is also higher in silicones. Despite a very polar chain, silicones can be compared to paraffin, with a low critical surface tension of wetting [4]. Yet because of their low intermolecular forces, PDMS materials remain liquid in a much wider range of molecular weights and viscosities than hydrocarbons. The surface activity of silicones is displayed in many circumstances [4]:•Polydimethylsiloxanes have a low surface tension (20.4 mN/m) and are capable of wetting most surfaces. With the methyl groups pointing to the outside, this gives very hydrophobic films and a surface with good release properties, particularly if the film is cured after application. Silicone surface tension is also in the most promising range considered for biocompatible elastomers (20 to 30 mN/m).•Silicones have a critical surface tension of wetting (24 mN/m), which is higher than their own surface tension. This means that silicones are capable of wettingthemselves, a property that promotes good film formation and good surface covering.•Silicone organic copolymers can be prepared with surfactant properties, with the silicone as the hydrophobic part (e.g., in silicone polyether copolymers).The low intermolecular interactions in silicones have other consequences [4]: •Glass transition temperatures are very low (e.g., 146 K for a polydimethylsiloxane compared to 200 K for polyisobutylene, the analogue hydrocarbon); cross-linkedPDMS will be elastomeric at RT in the absence of any plasticizers.•The presence of a high free volume compared to hydrocarbons explains the high solubility and high diffusion coefficient of gas into silicones. Silicones have a highpermeability to oxygen, nitrogen and water vapour, even if in this case liquid water is not capable of wetting a silicone surface. As expected, silicone compressibility is also high.•In silicone, the activation energy to the viscous movement is very low, and viscosity is less dependent on temperature compared to hydrocarbon polymers. Moreover,chain entanglements are involved at higher temperature and contribute to limit theviscosity reduction [4].The presence of groups other than methyl along the chain allows modification of some of the above properties:• A small percentage of phenyl groups along the chain perturbs sufficiently to reduce crystallisation and allows the polymer to remain flexible at very low temperatures.The phenyl groups also increase the refractive index.•Trifluoropropyl groups along the chain change the solubility parameter of the polymer from 7.5 to 9.5 (cal/cm3)1/2. These copolymers are used to prepareelastomers with little swelling in alkane or aromatic solvents.Considering the above, many polymeric “architectures” can be prepared of different physical forms (volatile, liquid, viscoelastic, solid) with different functionalities, inert or capable of interacting or reacting with many other compounds. Formulation into convenient products leads to even more products. This explains the wide range of industries where silicones are used.References1 Hardman, B. Encycl. Polym. Sci. Eng. 1989, 15, 204.2 Rochow, E. G. Silicon and Silicones, Springer-Verlag: Berlin, Heidelberg, New York, 1987.3 Noll, W. Chemistry and Technology of Silicones; Academic Press: New York, 1968.4 Owen, M. J. Chemtech. 198111, 288. This article has been updated and republished in Chimie Nouvelle2004, 85, 27.This article has been published in the chapter “Silicones in Industrial Applications” in Inorganic Polymers, an advanced research book by Nova Science Publishers (); edited by Roger De Jaeger (Lab. de Spechtrochimie Infrarouge et Raman, Univ. des Sciences and Tecn. de Lille, France) and Mario Gleria (Inst. di Scienze e Tecn. Molecolari, Univ. di Padoa, Italy). Reproduced here with the permission of the publisher.。