第23节镧系元素
- 格式:ppt
- 大小:1.24 MB
- 文档页数:45

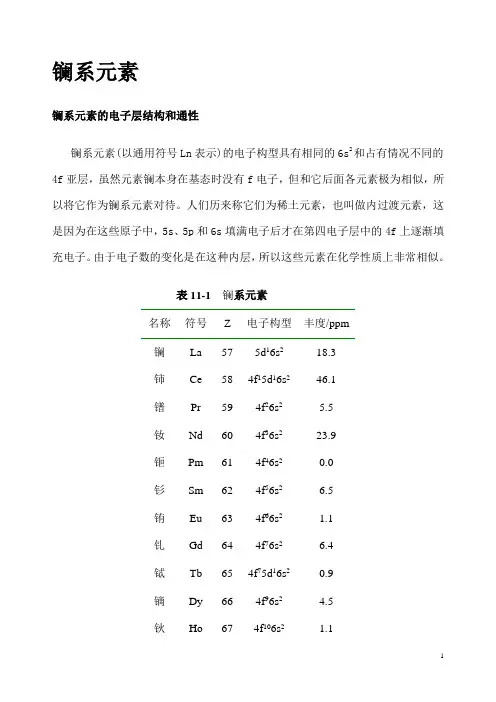
镧系元素镧系元素的电子层结构和通性镧系元素(以通用符号Ln表示)的电子构型具有相同的6s2和占有情况不同的4f亚层,虽然元素镧本身在基态时没有f电子,但和它后面各元素极为相似,所以将它作为镧系元素对待。
人们历来称它们为稀土元素,也叫做内过渡元素,这是因为在这些原子中,5s、5p和6s填满电子后才在第四电子层中的4f上逐渐填充电子。
由于电子数的变化是在这种内层,所以这些元素在化学性质上非常相似。
表11-1 镧系元素名称符号Z 电子构型丰度/ppm镧La 57 5d16s218.3铈Ce 58 4f15d16s246.1镨Pr 59 4f26s2 5.5钕Nd 60 4f36s223.9钷Pm 61 4f46s20.0钐Sm 62 4f56s2 6.5铕Eu 63 4f66s2 1.1钆Gd 64 4f76s2 6.4铽Tb 65 4f75d16s20.9镝Dy 66 4f96s2 4.5钬Ho 67 4f106s2 1.1铒Er 68 4f116s2 2.5铥Tm 69 4f126s20.2镱Yb 70 4f136s2 2.7镥Lu 71 4f145d16s20.8它们性质上的微小差别,主要是由“镧系收缩”引起的。
因为核内每增加一个质子,相应进入4f亚层的电子却太分散,不象定域程度更高的内层电子那样能有效地屏蔽核电荷,所以随着镧系元素原子序数的增加,原子核对最外层电子的引力就不断地增大,这就使得原子体积从镧到镥依次减小。
三价阳离子的收缩是十分规则的,从La3+的106pm收缩到Lu3+的35pm。
图11.1A所示金属半径,虽然总的趋向是减小,但Eu和Yb的半径比其余原子的要大得多。
它们是形成二价阳离子的倾向最大的两个镧系元素。
在固体中,这两种原子可能只将两个电子给予导带,而所形成的2+离子和其余镧系金属的3+离子相比,其半径较大、离子间的结合力较弱。
金属铕(Eu)和镱(Yb),与表中相邻的金属比,显然具有较低的密度,较低的熔点(图11.1B)和较低的升华能。




2010级宁夏师范学院化学与化学工程学院学生论文镧系元素镧、铈、镨的介绍中文摘要 (1)英文摘要 (1)1镧 (2)1.1镧的基本信息 (2)1.2镧的性质 (2)1.2.1物理性质 (2)1.2.2化学性质 (3)1.3镧的发现 (3)1.4性质与稳定性 (4)1.5镧的用途 (4)1.5.1常规用途 (4)1.5.2特殊用途 (4)2 铈 (7)2.1铈的基本信息 (7)2.2铈的性质 (7)2.2.1物理性质 (7)2.2.2化学性质 (8)2.3铈的发现 (8)2.4铈的用途 (9)2.4.1一般用途 (9)2.4.2特殊用途 (10)3镨 (11)3.1镨的基本信息 (11)3.2镨的性质 (11)3.3镨的发现 (12)3.4镨的用途 (13)3.4.1一般用途 (13)3.4.2特殊用途 (14)参考文献 (15)镧系元素镧、铈、镨的介绍摘要镧系元素是第57号元素到71号元素15种元素的统称,包括镧、铈、镨、钕、钷、钐、铕、钆、铽、镝、钬、铒、铥、镱、镥,。
镧系元素的外层和次外层的电子构型基本相同,电子逐一填充到4f轨道上。
镧系元素也属于过渡元素,只是镧系元素新增加的电子大都填入了从外侧数第三个电子层(即4f电子层)中,所以镧系元素又可以称为4f系。
为了区别于元素周期表中的d区过渡元素,故又将镧系元素(及锕系元素)称为内过渡元素。
由于镧系元素都是金属,所以又可以和锕系元素统称为f区金属。
镧系元素用符号Ln表示。
关键词:镧、铈、镨、镧系元素。
The Introduction of Lanthanide element lanthanum, cerium, praseodymiumabstractLanthanide element number is 57 to 71 # 15 elements collectively, including lanthanum, cerium, praseodymium, neodymium, promethium, samarium, europium, gadolinium, terbium, dysprosium, holmium, erbium, thulium, ytterbium and lutetium,. Lanthanide elements of outer layer and outer layer of have the same electron configuration, electronic filling in orbit to 4 f them one by one. Lanthanides also belongs to the transitional elements, just lanthanide new electronic tend to fill in the third shell from the outside (namely) of 4 f electronic shell, lanthanides and so can be referred to as the 4 f system. In order to distinguish it from d area transition elements in the periodic table of elements, so it will be the lanthanides (and actinide elements) is called the transition element. Because lanthanide metal, also can and actinides are collectively referred to as area f metal. Lanthanide represented by symbols Ln. Keywords:lanthanum, cerium, praseodymium,Lanthanide element1.镧镧:原子序数57,原子量138.9055,元素名来源于希腊文,原意是“隐蔽”。




第22章:镧系和锕系元素习题参考答案(P1110-1111)1. 答:镧系和锕系元素的名称、元素符号和原子序数如下:镧系元素:锕系元素:2.答:(1)镧系元素的特征氧化态为+3:镧系元素原子的(基态)价层结构为:4f 0~14 5d0~16s2 ;镧系元素原子的基态电子层结构中“最外三个电子层的结构”为:(4s24p64d10)4f 0~14,(5s25p6)5d0~1,6s2。
由于镧系元素最外两个电子层对4f轨道有较强的屏蔽作用,4f电子与核的作用较强(即4f电子受核的引力较大),当镧系元素与其它元素化合时,它们都是失去最外层的2个6s电子、次外层的1个5d电子或倒数第三层的1个4f电子(4f轨道中的电子一般只有1~2个能够参与形成化学键),这三级电离势之和是比较低的、且都很相近(3450~4190kJ·mol-1 ),而且它们的Ln3+离子半径很相近,Ln3+的水合能相近。
因此,镧系元素的特征氧化态为+3。
(2)Ce(铈)、Pr(镨)、Tb(铽)、Dy(镝)还常呈现+4氧化态:Ce4+(4f0)、Pr4+(4f1)、Tb4+(4f7)、Ce4+(4f8),是因为它们的4f能级具有全空或接近全空、半满或接近半满的结构,这符合Hund规则。
(3) Sm(钐)、Eu(铕)、Tm(铥)、Yb(镱)能呈现+2氧化态:凡是具有相对稳定电子层结构的镧系元素Ln2+的离子,都是可以形成的。
镧系元素中几乎有一半的元素都能形成+2氧化态的离子,特别是:Sm2+(4f6 )、Eu2+(4f7)、Tm2+(4f13)、Yb2+(4f14 )。
3.解释镧系元素在化学性质上的相似性。
答:镧系元素在化学性质上都十分相似,尤其是下列两组的元素:铈组稀土(轻稀土):La、Ce、Pr、Nd、Pm、Sm、Eu;钇组稀土(重稀土):Gd、Tb、Dy、Ho、Er、Tm、Yb、Lu(Sc)、Y。
镧系元素原子的基态电子层结构中“最外三个电子层的结构”为:(4s24p64d10)4f 0~14, (5s25p6)5d0~1,6s2,倒数一、二两个电子层结构几乎相同, 仅是倒数第三电子层中的4f能级中电子数不同,即:镧系元素原子的价层结构(4f0~14 5d 0~16s2 )十分相似。