乙烷乙烯乙炔的碳氢键键长
- 格式:docx
- 大小:35.98 KB
- 文档页数:1

有机化合物的结构式有机化合物是由碳和氢原子组成的化合物,它们可以通过共有电子对来形成碳碳键和碳氢键。
由于碳原子的特殊性质,它可以形成多种不同的化合物,并且可以通过改变其结构来改变其性质。
下面将介绍一些常见的有机化合物的结构式。
1.烷烃:烷烃是由碳和氢原子组成的直链或支链的无环烃类化合物。
最简单的烷烃是甲烷(CH4),其结构式为:HHH-C-H其他烷烃的结构式可以根据碳原子数目进行改变,如乙烷(C2H6)、丙烷(C3H8)等。
2.烯烃:烯烃是由碳和氢原子组成的含有碳碳双键的化合物。
最简单的烯烃是乙烯(C2H4),其结构式为:HHH-C=C-H其他烯烃的结构式可以根据碳原子数目和双键位置进行改变,如丙烯(C3H6)、丁烯(C4H8)等。
3.炔烃:炔烃是由碳和氢原子组成的含有碳碳三键的化合物。
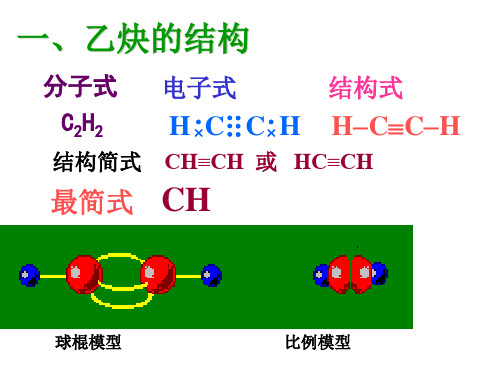
最简单的炔烃是乙炔(C2H2),其结构式为:HHH-C≡C-H其他炔烃的结构式可以根据碳原子数目和三键位置进行改变。
4.醇:醇是由碳、氢和氧原子组成的化合物,其中一个或多个氢原子被羟基(-OH)取代。
最简单的醇是甲醇(CH3OH),其结构式为:HHH-C-OH其他醇的结构式可以根据碳原子数目和羟基位置进行改变,如乙醇(C2H6O)、丙醇(C3H8O)等。
5.酮:酮是由碳、氢和氧原子组成的化合物,其中碳原子上有一个羰基(C=O)。
最简单的酮是丙酮(CH3COCH3),其结构式为:HHH-C-C=OH其他酮的结构式可以根据碳原子数目和羰基位置进行改变。
以上只是一些常见的有机化合物结构式的示例,根据碳原子数目和取代基的种类和位置,有机化合物的结构式可能会非常复杂。
通过了解有机化合物的结构式,可以更好地理解有机化学反应的机理和性质。

炔烃·编辑炔烃,为分子中含有碳碳三键的碳氢化合物的总称,是一种不饱合的碳氢化合物,简单的炔烃化合物有乙炔(C2H2),丙炔(C3H4)等。
工业中乙炔被用来做焊接时的原料。
碳氢化合物官能团·碳碳三键分子通式·CnH2n-2(其中n为非1正整数)1炔烃简介编辑炔烃(拼音:quētīng;英文:Alkyne)是一类有机化合物,属于不饱和烃。
其官能团为碳-碳三键(-C≡C -)。
通式CnH2n-2,其中n为非1正整数。
简单的炔烃化合物有乙炔(C2H2),丙炔(C3H4)等。
炔烃原来也被叫做电石气,电石气通常也被用来特指炔烃中最简单的乙炔。
“炔”字是新造字,音同缺(quē),左边的火取自“碳”字,表示可以燃烧;右边的夬取自“缺”字,表示氢原子数和化合价比烯烃更加缺少,意味着炔是烷(完整)和烯(稀少)的不饱和衍生物。
简单的炔烃的熔点、沸点,密度均比具有相同碳原子数的烷烃或烯烃高一些。
不易溶于水,易溶于乙醚、苯、四氯化碳等有机溶剂中。
炔烃可以和卤素、氢、卤化氢、水发生加成反应,也可发生聚合反应。
因为乙炔在燃烧时放出大量的热,炔又常被用来做焊接时的原料。
“炔”字是新造字,音同缺(quē),左边的火取自“碳”字,表示可以燃烧;右边的夬取自“缺”字,表示氢原子数和化合价比烯烃更加缺少,意味着炔是烷(完整)和烯(稀少)的不饱和衍生物。
2炔烃轨道编辑炔烃的碳原子2S轨道同一个2P轨道杂化,形成两个相同的SP杂化轨道。
堆成地分布在碳原子两侧,二者之间夹角为180度。
乙炔碳原子一个SP杂化轨道同氢原子的1S轨道形成碳氢σ键,另一个SP杂化轨道与相连的碳原子的SP杂化轨道形成碳碳σ键,组成直线结构的乙炔分子。
未杂化的两个P轨道与另一个碳的两个P轨道相互平行,“肩并肩”地重叠,形成两个相互垂直的π键。
3分子结构编辑分子中含有碳碳三键的碳氢化合物的总称,碳氢化合物。
炔烃是含碳碳三键的一类脂肪烃。
4物理性质编辑炔烃的熔沸点低、密度小、难溶于水、易溶于有机溶剂,一般也随着分子中碳原子数的增加而发生递变。

第二章 脂烃思考与练习2-1同系列和同系物有什么不同?丁烷的两种构造异构体是同系物吗?同系列和同系物含义不同。
同系列是指通式相同,结构相似,在组成上相差一个或多个CH 2基团的一系列化合物的总称,同系物则是指同一系列中的具体化合物。
如:烷烃是同系列,烷烃中的甲烷和乙烷互称为同系物。
丁烷的两种构造异构体不是同系物。
2-2推导烷烃的构造异构体应采用什么方法和步骤?试写出C 6H 14的所有构造异构体。
推导烷烃的构造异构体时,应抓住“碳链异构”这一关键。
首先写出符合分子式的最长碳链式,然后依次缩减最长碳链(将此作为主链),将少写的碳原子作为支链依次连在主链碳原子上。
如:C 6H 14存在以下5种构造异构体。
2-3脂烃的涵义是什么?它包括哪些烃类?分别写出它们的通式。
脂烃涵盖脂肪烃和脂环烃。
2-4指出下列化合物中哪些是同系物?哪些是同分异构体?哪些是同一化合物?同系物:⑴和⑻;⑵、⑶和⑸ 同分异构体:⑴和⑷;⑹和⑺ 同一化合物:⑵和⑶ 2-5 写出下列烃或烃基的构造式。
⑴ (CH 3)3C — ⑵ ⑶ CH 3CH=CH — ⑷ CH 2=CHCH 2—⑸ ⑹ ⑺CH 3 CH 2 CH2 CH 2 CH 2 CH3 CH 3CH CH 2CH 2CH 3CH 3CH 3 CH 2 CH CH 2 CH3CH 3CH 3 CH CH CH3CH 3CH 3 CH 3CCH CH 3CH 3CH 3(环烯烃、环炔烃、环二烯烃等)(环烷烃)不饱和脂环烃饱和脂环烃二烯烃炔烃烯烃(烷烃)不饱和烃饱和烃脂环烃脂肪烃脂烃C n H 2n+2C n H 2nC n H 2n-2C n H 2n-2C n H 2nCH 3CHCH 2CH 3CH 3CHCH 2CH 3CH 3CH 3CCH 2CH 3CH 3CH 3CH 2CCH 3CH 3⑻ ⑼ ⑽ 2-6给下列烷烃命名,用1°、2°、3°、4°标出下列烷烃分子中的伯、仲、叔、季碳原子。


绪论1、请写出下列化合物分子结构式的简写式:答案:2、请将下列简写式转化为键线式:答案:3、判断下列化合物有无偶极矩? 画出其方向:答案<请点击>答案:4、排列出乙烷、乙烯、乙炔分子中C-H键极性大小顺序:答案<请点击>答案:乙烷< 乙烯< 乙炔答案<请点击> 答案:醋酸可溶于水。
醋酸分子中的羧基可与水分子形成氢键缔合,使醋酸溶于水中。
烷烃1、命名或写出下列化合物的结构式:答案:2、回答下列问题:(1)2,2-二甲基丁烷的一氯代主要产物是(2).一分子量为72的烷烃进行氯代时,只得一种氯代产物,其结构为(3).写出1,2-二溴乙烷Newman投影式的优势构象。
(4).将下面化合物按其沸点由高到低的顺序排列A、辛烷B、3-甲基庚烷C、2,3-二甲基戊烷D、2-甲基己烷(5). 下列自由基中最稳定的是A、B、C、D、答案<请点击>答案:3、用不同符号表示下列化合物中伯、仲、叔、季碳原子答案<请点击> 答案:4、某烷烃相对分子质量为72,氯化时(1)只得一种一氯化产物,(2)得三种一氯化产物,(3)得四种一氯化产物,分别写出这些烷烃的构造式。
答案<请点击> 答案:烯烃、炔烃及共轭二烯烃1、命名或写出下列化合物的结构式:答案:(1) 4-甲基-2-己炔(2) 4-异丙基环己烯(3) 1-丁烯-3-炔(4) 反-3,4-二甲基环丁烯2、选择题:(1)下列化合物中碳氢键解离能最小的是:(2)下列碳正离子中最稳定的是:(3)下列烯烃在和溴水发生加成反应时,反应速度最快的是:(4)下列烯烃最稳定的是(),最不稳定的是()A、2,3-二甲基-2-丁烯B、3-甲基-2-戊烯C、反-3-己烯D、顺-3-己烯(5)下列烯烃不具有顺、反异构体的是:(6)下列烯烃氢化热(KJ/mol)最低的是:答案:3、完成下列反应式:答案:4、用简单并有明显现象的化学方法鉴别下列各组化合物:正庚烷1,4-庚二烯1-庚炔答案<请点击> 答案:5、合成题:(1)以环己醇为原料合成:1,2,3-三溴环己烷(2)从异丙醇为原料合成:溴丙烷(3)由1-氯环戊烷为原料合成:顺-1,2-环戊二醇。
炔烃分子中含有碳碳叁键的烃叫做炔烃,它的通式是Cn H2n-2。
炔烃的异构和命名乙炔和丙炔都没有异构体。
从丁炔开始有构造异构现象。
炔烃的构造异构现象也是由于碳链不同和叁键位置不同所引起的,但由于在碳链分支的地方,不可能有叁键存在,所以炔烃的构造异构体比碳原子数目相同的烯烃少些。
例如,丁烯有三个构造异构体,而丁炔只有两个:由于叁键碳上只可能连有一个取代基,因此炔烃不存在顺反异构现象。
戊炔有三个构造异构体,它也比戊烯的构造异构体数目(五个)少。
炔烃的系统命名法与烯烃相似,即以包含叁键在内的最长的碳链为主链,按主链的碳原子数命名为某炔,代表参键位置的阿拉伯数字,以取最小的为原则而置于名词之前,侧链基团则作为主链上的取代基来命名。
较简单的炔烃,也可以把它们看作是乙炔的衍生物,而用乙炔衍生物命名法来命名。
例如:从上例中可以看出,含有双键的炔烃在命名时,一般先命名烯再命名炔,碳链编号以表示双键与叁键位置的两个数字之和取最小的为原则,例如应命名为 3-戊烯-1-炔,而不命名为 2-戊烯-4-炔。
炔烃的结构炔烃的结构特征是分子中具有碳碳叁键。
可以以乙炔的结构为例,说明叁键的结构。
请研究下面的模型。
X光衍射和电子衍射等物理方法测定,乙炔分子是一个线形分子,四个原子都排布在同一条直线上。
成键碳原子的价电子层应满足八个电子的要求,乙炔的两个碳原子共用了三对电子,所以碳碳之间的键应当用叁键来代表。
量子化学的研究结果表明,在乙炔分子中,每个碳原子与另外两个原子(一个氢原子和另一个碳原子)结合成键时,使用了两个相同的sp杂化轨道(由一个s轨道和一个p轨道组合而成)。
已知烷烃中一个碳原子的四个sp3杂化轨道所组成的。
键是指向四面体四个顶角的四个键;由烯烃双键同一碳原子的三个sp2杂化轨道组成的。
键是在平面上指向三角形三个顶角的三个键;由炔烃叁键一个碳原子上的两个sp杂化轨道所组成的σ键则是在同一直线上方向相反的两个键。
这就是乙炔分子所以成为直线分子的原由。
第一章绪论1-1 扼要解释下列术语.(1)有机化合物(2) 键能、键的离解能(3) 键长(4) 极性键(5) σ键(6)π键(7) 活性中间体(8) 亲电试剂(9) 亲核试剂(10)Lewis碱(11)溶剂化作用(12) 诱导效应(13)动力学控制反应(14) 热力学控制反应答:(1)有机化合物-碳氢化合物及其衍生物(2) 键能:由原子形成共价键所放出的能量,或共价键断裂成两个原子所吸收的能量称为键能。
键的离解能:共价键断裂成两个原子所吸收的能量称为键能。
以双原子分子AB为例,将1mol气态的AB拆开成气态的A和B原子所需的能量,叫做A—B键的离解能。
应注意的是,对于多原子分子,键能与键的离解能是不同的。
分子中多个同类型的键的离解能之平均值为键能E(kJ.mol-1)。
(3) 键长:形成共价键的两个原子核之间距离称为键长。
(4) 极性键: 两个不同原子组成的共价键,由于两原子的电负性不同, 成键电子云非对称地分布在两原子核周围,在电负性大的原子一端电子云密度较大,具有部分负电荷性质,另一端电子云密度较小具有部分正电荷性质,这种键具有极性,称为极性共价键。
(5) σ键:原子轨道沿着轨道的对称轴的方向互相交叠时产生σ分子轨道, 所形成的键叫σ键。
(6) π键:由原子轨道侧面交叠时而产生π分子轨道,所形成的键叫π键。
(7) 活性中间体:通常是指高活泼性的物质,在反应中只以一种”短寿命”的中间物种存在,很难分离出来,,如碳正离子, 碳负离子等。
(8) 亲电试剂:在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对并与之共有形成化学键,这种试剂叫亲电试剂。
(9) 亲核试剂:在反应过程中,如果试剂把电子对给予有机化合物与它反应的那个原子并与之共有形成化学键,这种试剂叫亲核试剂。
(10) Lewis碱:能提供电子对的物种称为Lewis碱。
(11)溶剂化作用:在溶液中,溶质被溶剂分子所包围的现象称为溶剂化作用。
第六章碳氢键的化学烷烃分子由C-C和C-H两种σ键连接而成,这两种共价键的平均键能相当高,分别为347.3 kJ/mol和414.2 kJ/mol,因此具有很高的热稳定性和化学稳定性。
烷烃分子在一般条件下不易分解,只有在高温下才会C-C σ 键的均裂,这种过程称为高温裂解。
高温裂解反应是炼油工业的基本反应,可以将原油中碳链较长的烷烃裂解成日常生活中更需要的汽油组分(C6~C9)。
裂解一般在5 MPa及500~600 o C温度下进行。
在室温下,烷烃与许多化学试剂,包括强酸、强碱以及强氧化剂,都不会发生化学反应。
因此,一些低沸点的饱和烷烃,如石油醚和正己烷等,常可以作为溶剂使用,而沸点较高的饱和烷烃则可以作为润滑剂使用。
饱和烷烃只有在光照或催化剂存在下,才能发生一些化学反应。
尽管烷烃分子内的C-H键相当稳定,一般不易发生化学反应。
但C-H键一旦与其它杂原子或不饱和键相连接时,由于受到这些基团的电子效应的影响,其热稳定性和化学性质都将发生显著地变化。
例如,醚类化合物的α-氢易发生自氧化反应,烯丙位和苄位的氢原子易发生自由基取代反应,羰基化合物的α-氢因具有较强的酸性,易与碱发生质子交换反应等。
另一方面,碳原子的杂化轨道性质对碳氢键的性质也有很显著的影响。
与p轨道相比较,s轨道上的电子更接近原子核。
一个杂化轨道的s成分愈多,则此杂化轨道上的电子也愈靠近原子核。
实际上,乙炔的C-H键的键长(0.106 nm)比乙烯和乙烷的C-H键的键长(分别为0.108 nm 和0.110 nm)要短一些。
由于sp杂化轨道较靠近碳原子核,sp杂化的碳原子表现出较强的电负性。
因此,碳原子以sp杂化轨道参与组成的C—H共价键的电子云更偏向碳原子核一边,使得乙炔比乙烯具有更强的酸性。
为了清楚地了解碳氢键的化学性质以及不同基团的影响规律,本章将分别介绍不同结构类型的碳氢键的化学反应行为。
6.1 与烷基相连的碳氢键由于碳原子与氢原子的电负性十分接近(分别为2.2和2.1),饱和碳氢化合物的C-H键的极性很小,这些氢原子显示出很弱的酸性,一般不易与碱发生酸碱反应。