药品检验原始记录
- 格式:ppt
- 大小:266.50 KB
- 文档页数:54

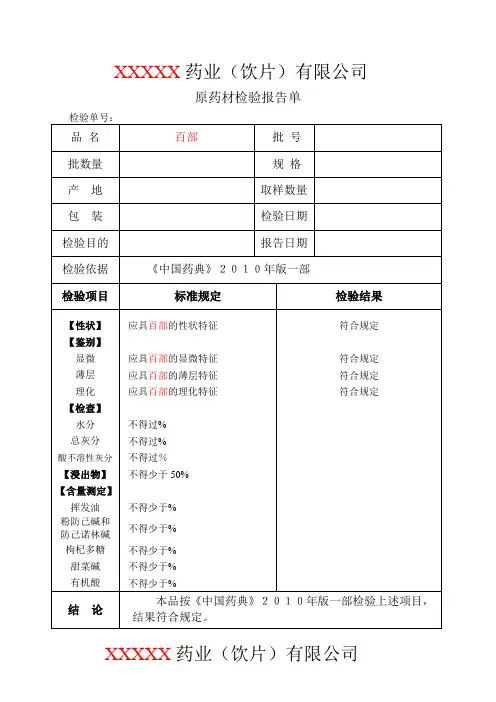
XXXXX药业(饮片)有限公司原药材检验报告单XXXXX药业(饮片)有限公司原药材检验记录【性状】结果:【鉴别】(1)显微鉴别横截面:结果:粉末:结果:(2)薄层鉴别供试品溶液的制备:取粉末1g,加乙醇15ml,加热回流1小时,放冷,滤过,滤液蒸干,残渣加乙醇5ml使溶解。
对照药材、对照品溶液配制:取菊花对照药材1g,同法制成对照药材溶液。
再取绿原酸对照品,加乙醇制成每1ml含的溶液。
温度:(℃)相对湿度:(%)展开剂:三氯甲烷-丙酮-甲醇-5%浓氨试液(6:1:1:)薄层板:硅胶G显色剂:稀碘化铋钾试液灯光:白光、紫外光灯(365nm)展距:(cm)供试品色谱中,在与对照药材色谱相对应的位置上,显相同颜色的荧光斑点。
S1为对照药材(对照品为中检所提供编号为)S2为对照品(对照品为中检所提供编号为) T为样品结果:【检查】杂质不得过 XX % (附录IX A)杂质称重: g杂质计算结果为: % (标准规定不得过 XX %)结果:膨胀度应不低于(附录IX O)温度:(℃)相对湿度:(%)电子天平型号:CP214 溶剂:水样品编号 1# 2# 3#干燥品称重: g g g第一次样品膨胀后体积: ml ml ml第二次样品膨胀后体积: ml ml ml(两次差异不超过)膨胀度计算结果为:(标准规定不低于)结果:水分不得过% (附录Ⅸ H 第一法)。
温度:(℃)相对湿度:(%)烘箱型号:DHG-91012SA型电子天平型号:CP214样品编号 1# 2#第一次称量瓶干燥(105℃ 3h) (g)(g)第二次称量瓶恒重(105℃ 1h) (g)(g)样品称重(g)(g)第一次称量瓶+样品干燥(105℃ 5h) (g)(g)第二次称量瓶+样品恒重(105℃ 1h) (g)(g)水分计算结果为:(%)(标准规定不得过%)结果:总灰分不得过%(附录Ⅸ K)温度:(℃)相对湿度:(%)马福炉型号:电子天平型号:CP214样品编号 1# 2#第一次坩锅称重(600℃ 3h) (g)(g)第二次坩锅恒重(600℃(g)(g)样品称重(g)(g)第一次坩锅+残渣称重(600℃ 3h) (g)(g)第二次坩锅+残渣恒重(600℃(g)(g)总灰分计算结果为:(%)(标准规定不得过%)结果:酸不溶性灰分不得过%(附录Ⅸ K)。


药品检验原始记录的书写细则检验记录是出具检验报告书的依据,是进行科学研究和技术总结的原始资料;为保证药品检验工作的科学性和规范化,检验记录必须做到:记录原始、真实,内容完整、齐全,书写清晰、整洁。
1、检验记录的基本要求:1.1 原始检验记录应用蓝黑墨水或碳素笔书写(显微绘图可用铅笔)。
凡用微机打印的数据与图谱,应剪贴于记录上的适宜处,并有操作者签名;如系用热敏纸打印的数据,为防止日久褪色难以识别,应以蓝黑墨水或碳素笔将主要数据记录于记录纸上。
1.2 检验人员在检验前,应注意检品标签与所填送验单的内容是否相符,逐一查对检品的编号、品名、规格、批号和效期,生产单位或产地,检验目的,以及样品的数量和封装情况等。
1.3 检验记录中,应先写明检验的依据。
凡按中国药典、部(局)颁等标准的,应列出标准名称、版本、页数或标准批准文号。
1.4 检验过程中,可按检验顺序依次记录各检验项目,内容包括:项目名称,检验日期,操作方法(如系完全按照1.3检验依据中所载方法,可简略扼要叙述;但如稍有修改,则应将改变部分全部记录),实验条件(如实验温度,仪器名称型号和校正情况等),观察到的现象(不要照抄标准,而应是简要记录检验过程中观察到的真实情况;遇有反常的现象,则应详细记录,并鲜明标出,以便进一步研究),实验数据,计算(注意有效数字和数值的修约及其运算,详见《中国药品检验标准操作规范》第450页)和结果判断等;均应及时、完整地记录,严禁事后补记或转抄。
如发现记录有误,可用单线划去并保持原有的字迹可辩,不得擦抹涂改;并应在修改处签名或盖章,以示负责。
检验或试验结果,无论成败(包括必要的复试),均应详细记录、保存。
对废弃的数据或失败的实验,应及时分析其可能的原因,并在原始记录上注明。
1.5 检验中使用的标准品、对照品或对照药材,应记录其来源、批号和使用前的处理;用于含量(或效价)测定的,应注明其含量(或效价)和干燥失重(或水分)。



一、化学鉴别法药品检验原始记录检品名称:检验日期:批号:规格:【鉴别】/结果:□呈正反应□不呈正反应结论:□符合规定□不符合规定检验者: 复核者: 第页二、TLC鉴别法药品检验原始记录检品名称:检验日期:批号:规格:[鉴别]供试品溶液的制备:对照品(或对照药材、对照提取物)溶液的制备:对照物质来源:□均为中国药品生物制品检定所提供□其他:No:薄层色谱条件与结果详见附图()。
结论:□符合规定□不符合规定(规定:在供试品色谱中,在与对照品(或对照药材、对照提取物)色谱相应位置上,显相同颜色的斑点。
)检验者: 复核者: 第页三、TLC图薄层色谱检验记录图号:检品名称:检品编号: 检验日期:天气:室温:湿度:薄层板:展开温度:展开剂:显色剂及检视方法:点样量( l):点样顺序: 1 2结论:检验者: 复核者: 第页四、 相对密度药品检验原始记录检品名称: 检品编号: 检验日期: 规格: 批号 室温: 湿度: 相对密度(比重瓶法)照相对密度测定法(中国药典2010年版A V I AV II 二部附录一部附录)测定。
测定方法: □比重瓶法 □韦氏比重称法 (规定测定温度为20℃)。
天平: 实验温度: 空瓶重(W 1): 瓶+供试品重(W 2): 供试品重(W 2-W 1): 瓶+水重(W 3): 水重(W 3-W 1):结果计算:计算公式:相对密度 = 水重量供试品重量结论: (规定 ) 检验者: 复核者: 第 页五、PH值测定法药品检验原始记录检品名称:检品编号: 检验日期:批号:规格:温度:湿度:pH值照pH值测定法(《中国药典》2010年版一部附录VII G)测定。
仪器:校正仪器用标准缓冲液:邻苯二甲酸氢钾标准缓冲液(pH4.00)磷酸盐标准缓冲液(pH6.86)其它:供试品溶液的制备:pH值测定结果:结论:□符合规定□不符合规定(规定: ) 检验者: 复核者: 第页六、重量差异检查之一药品检验原始记录检品名称:检验日期:批号:规格:重量差异按《中国药典》2010年版一部附录I D片剂项下检查法取供试品20片,分别精密称定每片的重量。

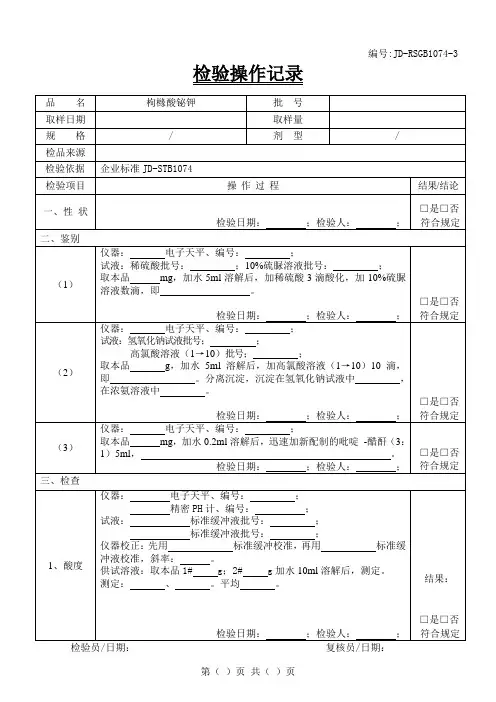


【性状】㈠.外观性状1.检验结果:本品为。
2.标准规定:本品为白色至微黄色的结晶或结晶性粉末;有微臭。
本品在乙醇中略溶,在水或三氯甲烷中微溶,在乙醚中极微溶解。
3.结论:□符合规定□不符合规定检验人/日期:复核人/日期:㈡.熔点1.仪器:熔点仪型号、编号鼓风干燥箱型号、编号2.操作:取供试品适量,研细,置105℃干燥,然后分取供试品粉末适量,置熔点测定用毛细管中,借助长短适宜的洁净玻璃管,垂直放在实验台面上,将毛细管自上口放入使自由落下,反复数次,使粉末紧密集结在毛细管的熔封端直至装入供试品的高度为3mm。
俟熔点仪温度上升至149℃时,将装有供试品的毛细管浸入传温液中部;继续加热,调节升温速率为每分钟上升1.0~1.5℃,记录供试品在初熔至全熔时的温度,重复测定3 次,取其平均值,即得。
3.检验结果:①℃~℃②℃~℃③℃~℃(极差≤0.5℃)平均值= ℃~℃4.标准规定:熔点为159℃~163℃。
5.结论:□符合规定□不符合规定检验人/日期:复核人/日期:㈢.吸收系数1仪器:电子天平型号、编号紫外-可见分光光度计型号、编号2.试剂:盐酸溶液(9→1000)配制批号3.操作:取本品,精密称取约16.3mg,置50ml量瓶中,加盐酸溶液(9→1000)溶解并稀释至刻度,摇匀,精密量取2ml,置50ml量瓶中,加盐酸溶液(9→1000)稀释至刻度,摇匀制成每1ml中约含13μg的溶液,照紫外-可见分光光度法,在277nm的波长处测定吸收度,吸收系数(E%11cm)为365~389。
AV4.计算公式及结果:E%11cm =----------100WW = g A = V(稀释倍数)=E%1= =1cm)为365~389。
5.标准规定:吸收系数(E%11cm6.结论:□符合规定□不符合规定检验人/日期:复核人/日期:【鉴别】㈠ .1.仪器:电子天平型号、编号2.试剂:氢氧化钠试液配制批号稀盐酸配制批号3.操作及结果:取本品 mg(约10mg),加氢氧化钠试液2ml,微温,即得溶液(应为紫红色);滴加稀盐酸使酸性后即变成(应为黄色),再滴加过量氢氧化钠试液则变成(应为橙红色)。
XXX制药厂原辅料检验原始记录检验号:[性状]本品为无色澄明液体。
符合规定。
相对密度:韦氏比重瓶法温度:20。
C结果:0.8022结论:符合规定[鉴别] 取本品1mL, 加水5mL与氢氧化钠试液lmL后, 缓缓滴加碘试液2mL, 即发生碘仿的臭气, 并生成黄色沉淀。
结果:呈正反应[检查]酸度:取本品10.0mL, 加水25mL及酚酞指示液2滴, 摇匀, 滴加氢氧化钠滴定液(0.02mol/L)至显淡红色, 再加本品25.0mL, 摇匀, 加氢氧化钠滴定液(0.02mol/L) 0.50mL, 应显淡红色。
结果:显淡红色结论:符合规定水不溶性物质:取本品, 与同体积的水混合后, 溶液应澄清;在10。
C放置30min, 溶液仍应澄清。
结果:溶液澄清结论:符合规定复核人: 检验人: 第1页XXX制药厂原辅料检验原始记录检验号:杂醇油:取本品10mL, 加水5mL与甘油1mL, 摇匀后, 分次滴加在无臭的滤纸上, 使乙醇自然挥散, 始终不得发生异臭。
结果: 不发生异臭。
结论: 符合标准。
甲醇:取本品5.0mL, 用水稀释至100mL, 摇匀;分取1.0mL, 加磷酸溶液(1(10)0.2mL与5%高锰酸钾溶液0.25mL, 在30~35。
C保温15min, 滴加10%焦亚硫酸钠溶液至无色, 缓缓加入在冰浴中冷却的硫酸溶液(3(4)5mL, 在加入时应保持混合物冷却;再加新制的1%变色酸溶液0.1mL, 置水浴中加热20min, 如显色, 与标准甲醇溶液(精密称取甲醇20mg, 加水使成200mL)1.0mL用同一方法制成的对照液比较, 不得更深(0.20%)。
结果:供试液颜色不超过对照液结论:符合规定易氧化物:取50mL具塞量筒, 依次用盐酸、水与本品洗净后, 加入本品20mL, 放冷至150C, 加高锰酸钾滴定液(0.02mol/L)0.1mL, 密塞摇匀后, 在150C静置10min, 粉红色不得完全消失。
药品检验原始记录的书写规定药品检验记录是出具检验报告书的依据,是进行科学研究和技术总结的原始资料,具有科学性、规范性和可追溯性。
规范检验记录是保证再现实验过程,提高检验工作质量,实现实验室质量方针和质量目标的有效方法,从而提高实验室的核心竞争力,更好地发挥技术支撑和服务社会的功能。
为保证药品检验工作的科学性和规范化,检验记录必须做到:记录原始、真实,标准正确,数据准确,内容完整、齐全,书写清晰、整洁。
1、检验记录的基本要求:1.1 检验人员在检验前,应进行核对。
注意检品与检品卡的内容是否相符,逐一查对检品的编号、名称、规格、产品批号、有效期,生产单位、检验项目、检验目的、检验依据、收检日期、检品数量和包装情况等,并将相关内容记录于检验原始记录纸上。
1.2 检验原始记录应记录在检验原始记录纸上,用统一的文件编号,采用活页记录纸和各类专用检验记录表格,检验过程可采用计算机打印或用蓝黑色钢笔、碳素笔或签字笔书写,试验数据如取样量、溶剂用量等应用钢笔、碳素笔或签字笔书写,各检验项目的记录格式参照各检验科室原始记录模板书写,内容应包括所有与检验有关的信息。
凡用仪器打印的数据与图谱,应注明检品编号、文件编号、检验项目(包括图谱的具体试验名称和数据归属),并有检验者、校对者签名,需要引用的数据要在相关数据前打勾。
仅有数据(如不溶性微粒)的打印纸附于检验原始记录后,或粘贴于原始记录的适宜处,并加盖检验者骑缝章或骑缝签字。
如用热敏纸打印数据,为防止日久褪色难以识别,应以钢笔、碳素笔或签字笔将主要数据记录于原始记录纸上。
1.3 检验依据按国家(中国药典)、部、局颁标准等成册标准检验的,应在检验原始记录中写明标准名称、版本和页数;按单篇标准检验的,应在检验原始记录中写明标准名称并将标准复印件附于检验原始记录最后面;按委托人提供检验资料或有关文献检验的,应在检验原始记录中写明标准名称并将有关资料附于检验原始记录最后面(注册检验资料除外)。