溶液的酸碱性与PH
- 格式:ppt
- 大小:565.50 KB
- 文档页数:28



溶液的酸碱性与pH值溶液的酸碱性是指溶液中酸碱物质所占比例的多少,而pH值是衡量溶液酸碱性的指标。
在化学实验、生物学研究和日常生活中,了解溶液的酸碱性以及pH值的变化对我们有着重要意义。
1. pH值的定义和计算pH值是一种用于表示溶液酸碱程度的无量纲指标,其定义为负对数下10的氢离子(H+)浓度的活度。
pH值的计算公式为:pH = -log[H+]。
在纯水中,H+离子的浓度极小,约为10-7摩尔每升,因此pH值为7。
当溶液的pH小于7时,表示溶液为酸性溶液;当pH大于7时,表示溶液为碱性溶液。
2. 酸性溶液与碱性溶液酸性溶液指的是含有较多H+离子的溶液。
酸性溶液中的氢离子会与水分子中的氧离子(OH-)结合,生成水分子(H2O)。
典型的酸性溶液有盐酸溶液和硫酸溶液。
碱性溶液则是指含有较多OH-离子的溶液。
碱性溶液中的氢离子会与氢氧根离子结合,生成水分子。
典型的碱性溶液有氢氧化钠溶液和氢氧化钙溶液。
3. pH值的影响因素溶液的酸碱性和pH值受多种因素的影响。
(1) 酸碱物质的浓度:溶液中酸碱物质的浓度越高,其酸碱性也越强,因此pH值会相应下降或上升。
(2) 酸碱物质的强度:强酸和强碱的溶液具有较高或较低的pH值,而弱酸和弱碱的溶液则具有较接近中性的pH值。
(3) 温度:溶液的温度升高或降低都会对其pH值产生影响。
温度升高会导致少数酸性物质解离产生更多的H+离子,从而降低pH值;而温度降低则会减少H+离子的生成,使pH值升高。
4. 测定溶液的pH值测定溶液的pH值是一个常见的实验操作。
常用的测定方法包括:(1) 酸碱指示剂:酸碱指示剂可以根据其与溶液的颜色变化来判断溶液的酸碱性。
例如,酸性溶液中溴酚蓝指示剂呈黄色,而碱性溶液中呈蓝色。
(2) pH试纸:pH试纸是另一种常用的溶液酸碱性测定方法,它可以根据试纸颜色的变化来判断溶液的pH值范围。
(3) pH计:pH计是一种准确测定溶液pH值的仪器。
它使用玻璃电极来测量溶液中的氢离子浓度,并将其转换为pH值。

溶液的酸碱性与pH值溶液的酸碱性是指溶液中酸性物质和碱性物质的相对浓度。
酸碱性的强弱可以通过pH值来表示。
pH值是一个表示溶液酸碱性强弱的指标,其数值范围从0到14。
pH值小于7的溶液称为酸性溶液,pH值大于7的溶液称为碱性溶液,pH值等于7的溶液称为中性溶液。
溶液的酸碱性与其中溶解的酸性物质和碱性物质的特性和浓度有关。
在溶液中,酸质子(H+)和碱质子(OH-)是起主要作用的离子。
酸性溶液中质子的浓度高于水,而碱性溶液中质子的浓度低于水。
而中性溶液中酸性物质和碱性物质的浓度相等,质子的浓度与水相等。
酸性溶液的pH值通常小于7,其原因是酸性物质可以释放出质子(H+)离子,增加溶液中质子的浓度。
酸性物质中常见的有硫酸、盐酸、硝酸等。
这些物质会与水分子发生反应,将水分子中的一个氢原子取代,形成H+离子。
碱性溶液的pH值通常大于7,其原因是碱性物质可以释放出氢氧根离子(OH-)或接受质子。
碱性物质中常见的有氢氧化钠、氢氧化钾、氢氧化铵等。
这些物质在水中形成氢氧根离子和金属离子,氢氧根离子会与溶剂中的质子结合,减少溶液中质子的浓度。
酸性和碱性溶液之间可以相互中和。
当酸性溶液和碱性溶液混合时,质子和氢氧根离子会相互结合,生成水分子。
在这个反应过程中,溶液的酸碱性随着质子和氢氧根离子的浓度变化而改变。
pH值的改变取决于酸性和碱性物质的浓度和反应的平衡。
pH值的测量通常使用酸碱指示剂、pH计或电极进行。
酸碱指示剂是一种化学物质,可以通过改变其颜色来指示溶液的酸碱性。
pH计和电极则通过测量溶液中电离质子的浓度来确定pH值。
总之,溶液的酸碱性与其中溶解的酸性物质和碱性物质的浓度有关。
pH值是一种表示溶液酸碱性强弱的指标,其范围从0到14。
酸性溶液的pH值通常小于7,碱性溶液的pH值通常大于7,中性溶液的pH值为7。
通过使用酸碱指示剂、pH计或电极,可以准确测量溶液的pH值,以判断其酸碱性。
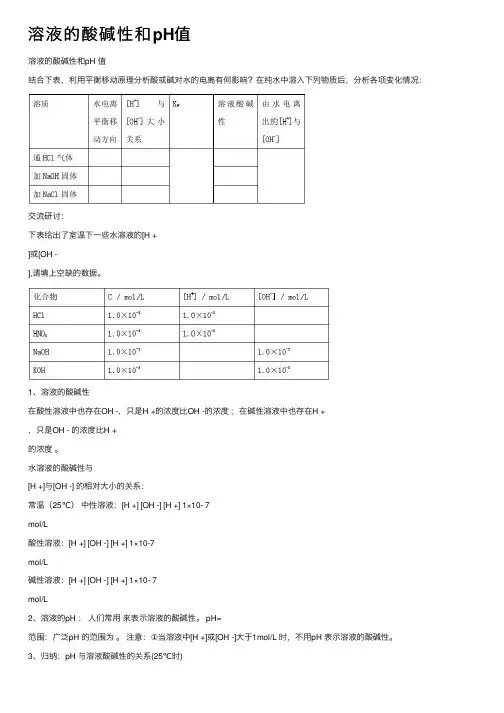
溶液的酸碱性和pH值溶液的酸碱性和pH 值结合下表,利⽤平衡移动原理分析酸或碱对⽔的电离有何影响?在纯⽔中溶⼊下列物质后,分析各项变化情况:交流研讨:下表给出了室温下⼀些⽔溶液的[H +]或[OH -],请填上空缺的数据。
1、溶液的酸碱性在酸性溶液中也存在OH -,只是H +的浓度⽐OH -的浓度;在碱性溶液中也存在H +,只是OH - 的浓度⽐H +的浓度。
⽔溶液的酸碱性与[H +]与[OH -] 的相对⼤⼩的关系:常温(25℃)中性溶液:[H +] [OH -] [H +] 1×10- 7mol/L酸性溶液:[H +] [OH -] [H +] 1×10-7mol/L碱性溶液:[H +] [OH -] [H +] 1×10- 7mol/L2、溶液的pH :⼈们常⽤来表⽰溶液的酸碱性。
pH=范围:⼴泛pH 的范围为。
注意:①当溶液中[H +]或[OH -]⼤于1mol/L 时,不⽤pH 表⽰溶液的酸碱性。
3、归纳:pH 与溶液酸碱性的关系(25℃时)4、溶液pH 的测定⽅法(1)酸碱指⽰剂法说明:常⽤的酸碱指⽰剂有⽯蕊、甲基橙、酚酞试液。
常⽤酸碱指⽰剂的pH变⾊范围(2)pH试纸法使⽤⽅法:(3)pH计法(了解)5、有关pH的简单计算例1、分别求0.05mol/LH2SO4溶液和0.05mol/L Ba(OH)2溶液的PH值。
例2、求PH=2的H2SO4溶液中H2SO4的浓度;求PH=10的NaOH溶液中NaOH的浓度。
[巩固练习]1、pH=2的强酸溶液,加⽔稀释,若溶液体积扩⼤10倍,则C(H+)或C(OH-)的变化()A、C(H+)和C(OH-)都减少B、C(H+)增⼤C、C(OH-)增⼤D、C(H+)减⼩2、向纯⽔中加⼊少量的KHSO4固体(温度不变),则溶液的()A、pH值升⾼B、C(H+)和C(OH-)的乘积增⼤C、酸性增强D、OH-离⼦浓度减⼩3、100℃时,Kw=1×10-12mol-2?L-2,对纯⽔的叙述正确的是()A、pH=6显弱酸性B、C(H+)=10-6mol/L,溶液为中性C、Kw是常温时的10-2倍D、温度不变冲稀10倍pH=74、在pH=1的硫酸溶液中,由⽔电离出来的H+浓度为()A 、0 B、0.1 mol.L-1 C、10-7 mol.L-1 D、10-13 mol.L-15、将pH=5的盐酸溶液稀释1000倍后,溶液的pH为()A、等于8B、等于7C、接近7⼜⼩于7D、⼤于7⽽⼩于86、将纯⽔加热⾄较⾼的温度,下列叙述正确的是()A、⽔的离⼦积变⼤、pH变⼤、呈酸性B、⽔的离⼦积不变、pH不变、呈中性C、⽔的离⼦积变⼩、pH变⼤、呈碱性D、⽔的离⼦积变⼤、pH变⼩、呈中性7、给蒸馏⽔中滴⼊少量盐酸后,下列说法中错误的是()A、[H+ ][OH- ]乘积不变B、pH增⼤了C、[OH- ]降低了D、⽔电离出的[H+ ]增加了8、常温下,下列溶液中酸性最弱的是()A、pH=4B、[H+ ]=1×10-3mol·L-1C、[OH- ]=1×10-11mol·L-1D、[H+] ·[OH- ]= 1×10-14 mol-2?L-29、下列试纸使⽤时, 不宜先⽤⽔润湿的是()。

A、汽水B、自来水C、肥皂水D、食醋4、苯甲酸()可用做食品防腐剂,其酸性比醋酸强。
下列对苯甲酸性质的推测不合理的是()A.苯甲酸溶液的pH小于7B.苯甲酸溶液的pH大于 7C.苯甲酸溶液能使紫色石蕊试液变红色D.苯甲酸溶液不能使无色酚酞试液变色5、例1 一些食物的pH如下,其中碱性最强的是()A.苹果 2.9~3.3 B.牛奶 6.3~6.6C.鸡蛋清 7.6~8.0 D.番茄 4.0~4.46、不用其他试剂,可以鉴别石蕊、盐酸、氢氧化钙、氢氧化钠、碳酸钠五种溶液,第二个被鉴别出来的物质是()A.盐酸B.氢氧化钙C.氢氧化钠D.碳酸钠7、一些食物的近似PH如下表:食物苹果葡萄牛奶玉米粥pH 2.9~3.3 3.5~4.5 6.3~6.6 7.2~8.0人的胃液中含有盐酸,对于胃酸过多的人,空腹时最适宜使用上述食物中的A.苹果 B.葡萄 C.牛奶 D.玉米粥8、下列反应,要借助酸碱指示剂才能判断二者是否发生反应的是A.大理石和稀盐酸 B.石灰水和稀盐酸C.铁锈和稀硫酸D.镁和稀硫酸9、下图是一些物质的pH,酸碱性最接近中性的是A.苹果汁(2.9~3.3)B.番茄汁(4.04~4.4)C.玉米粥(6.88~7.1)D.肥皂水(9.8~10.2)10、下列物质中.pH最小的是;A.食盐水 B.纯净水C.食醋 D.石灰水11、下列数据是常见物质的pH范围,其中酸性最强的是A.瓶装饮用水 (6.5~7.5) B.番茄汁(4.0~4.4)C.柠檬汁(2.0~3.0) D.液体肥皂(9.5~10.5)12、用一种试剂一次就能将澄清石灰水、氢氧化钠溶液、稀盐酸三种无色溶液区分开来的是A.紫色石蕊试液 B.稀硫酸C.氢氧化钡溶液 D.碳酸钠溶液二、多项选择13、一些国家正在试用碳酸水浇灌某些植物,其作用是()A.调节土壤的pH,改良酸性土壤B.调节土壤的pH,改良碱性土壤C.促进植物的光合作用D.在植物上方形成温室三、简答题1.2003年6月某校环保小组监测到一个造纸厂仍在向淮河排放无色碱性污水。

酸碱溶液 pH 计算1.溶液酸碱性与 pH氢离子浓度的负对数被称为 pH。
pH=-lg[H+] 氢氧根离子浓度的负对数被称为 pOH。
pOH=-lg[OH-]pH+pOH=pKw =14.00 295K 时,溶液的酸碱性和 pH 值的关系是:中性溶液 pH=7 酸性溶液 pH<7 碱性溶液 pH>72.酸碱溶液 pH 计算 (1)离子活度离子所表现出来的有效浓度称为离子活度,用α表示。
活度和离子浓度具有如下关系α=fcf 称为活度系数,它反映了离子在溶液中所受到的相互作用力的大小。
一般情况下, f<1,所以α<c。
在极稀的强电解质溶液和不太浓的弱电解质溶液 中, f 值逐渐接近于 1,离子活度与浓度几乎相等。
(2)强酸强碱溶液 pH 计算强酸强碱在溶液中几乎全部离解,因此 H+或 OH-的平衡浓度等于加入的强酸或强 碱的浓度。
(3)一元弱酸弱碱溶液 pH 计算对于一元弱酸,如果同时满足 c/Ka≥500 和 cKa≥10Kw 两个条件,则[H+ ] = c ⋅ Ka对于一元弱碱,如果同时满足 c/Kb≥500 和 cKb≥10Kw 两个条件,则[OH− ] = c ⋅ Kb(4)多元弱酸弱碱溶液 pH 的计算多元弱酸、多元弱碱在水溶液中是分级离解的,一级电离远大于二、三级电离。
在实际计算中,当 c/Ka1>500 时,可按一元弱酸作近似计算,即:[H+ ] = c ⋅ Ka1(5)两性物质溶液 pH 的计算两性物质如 NaHCO3、K2HPO4,浓度较高时,溶液的 H+浓度可按下式作近似计算:[H+ ] = K K⋅ a1 a2又如 NH4Ac 亦是两性物质,以 Ka 表示正离子酸(NH4+)的离解常数, Ka′ 表示负离子碱(Ac-)的共轭酸(HAc)的离解常数,这类两性物质的 H+浓度可按下式计算:[H+ ] = Ka ⋅ Ka′pH=1 2( pKa+pKa′)。



溶液的酸碱度与pH值计算溶液的酸碱度是指溶液中酸性或碱性物质的浓度或活性。
了解溶液的酸碱度对于许多化学和生物学领域的研究非常重要。
pH值是衡量溶液酸碱度的常用指标,它表示溶液中氢离子(H+)的浓度。
本文将介绍溶液酸碱度的概念和计算方法。
溶液的酸碱度可以通过测量溶液中氢离子浓度([H+])或氢离子活性来确定。
氢离子浓度是指溶液中氢离子的实际浓度,而氢离子活性则考虑了溶液中其他因素对氢离子的影响。
在大多数情况下,我们可以使用氢离子浓度来估算溶液的酸碱度。
pH值是以对数形式表示溶液中氢离子浓度的指标。
它的定义为pH = -log[H+],其中[H+]是溶液中氢离子的浓度。
pH值的范围从0到14,中性溶液的pH值为7。
当溶液的pH值小于7时,溶液被认为是酸性的,而当pH值大于7时,溶液被认为是碱性的。
计算溶液的pH值需要知道溶液中氢离子的浓度。
对于强酸或强碱溶液,可以直接通过测量来得到氢离子浓度。
然而,对于弱酸或弱碱溶液,需要使用酸碱离解常数(Ka或Kb)来计算氢离子浓度。
酸碱离解常数是描述酸或碱在溶液中离解的程度的指标。
对于弱酸HA,其离解反应可以表示为HA ⇌ H+ + A-,其中HA是未离解的酸,H+是氢离子,A-是酸的共轭碱。
酸碱离解常数Ka定义为[H+][A-]/[HA],其中[H+]是溶液中氢离子的浓度,[A-]是酸的共轭碱的浓度,[HA]是未离解酸的浓度。
类似地,对于弱碱B,其离解反应可以表示为B + H2O ⇌ BH+ + OH-,碱离解常数Kb定义为[BH+][OH-]/[B],其中[BH+]是碱的共轭酸的浓度,[OH-]是溶液中氢氧根离子的浓度,[B]是未离解碱的浓度。
通过酸碱离解常数,我们可以使用Henderson-Hasselbalch方程计算溶液的pH 值。
对于弱酸溶液,Henderson-Hasselbalch方程为pH = pKa + log([A-]/[HA]),其中pKa是酸的负对数离解常数,[A-]是酸的共轭碱的浓度,[HA]是未离解酸的浓度。
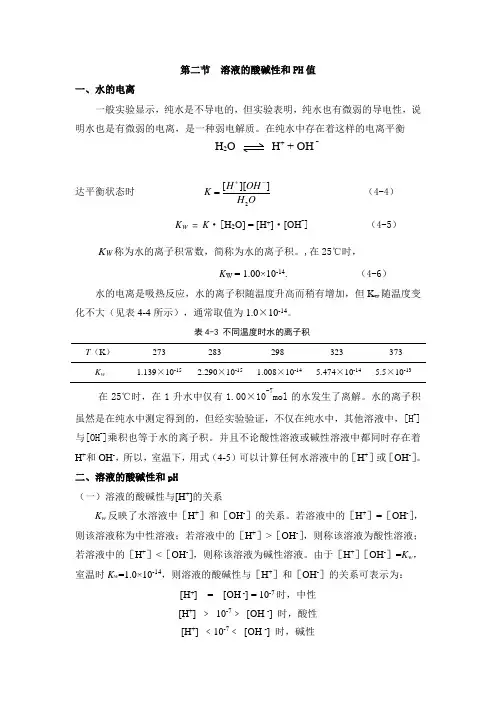
第二节 溶液的酸碱性和PH 值一、水的电离一般实验显示,纯水是不导电的,但实验表明,纯水也有微弱的导电性,说明水也是有微弱的电离,是一种弱电解质。
在纯水中存在着这样的电离平衡H 2O H + + OH -达平衡状态时 2[][]H OH K H O +-=(4-4) K W = K ·[H 2O] = [H +]·[OH -] (4-5) K W 称为水的离子积常数,简称为水的离子积。
,在25℃时,K W = 1.00×10-14. (4-6)水的电离是吸热反应,水的离子积随温度升高而稍有增加,但K w 随温度变化不大(见表4-4所示),通常取值为1.0×10-14。
表4-3 不同温度时水的离子积T (K )273 283 298 323 373 K w 1.139×10-15 2.290×10-15 1.008×10-145.474×10-14 5.5×10-13 在25℃时,在1升水中仅有1.00×10-7mol 的水发生了离解。
水的离子积虽然是在纯水中测定得到的,但经实验验证,不仅在纯水中,其他溶液中,[H +]与[OH -]乘积也等于水的离子积。
并且不论酸性溶液或碱性溶液中都同时存在着H +和OH -,所以,室温下,用式(4-5)可以计算任何水溶液中的[H +]或[OH -]。
二、溶液的酸碱性和pH(一)溶液的酸碱性与[H +]的关系K w 反映了水溶液中[H +]和[OH -]的关系。
若溶液中的[H +]=[OH -],则该溶液称为中性溶液;若溶液中的[H +]>[OH -],则称该溶液为酸性溶液;若溶液中的[H +]<[OH -],则称该溶液为碱性溶液。
由于[H +][OH -]=K w ,室温时K w =1.0×10-14,则溶液的酸碱性与[H +]和[OH -]的关系可表示为:[H +] = [OH -] = 10-7时,中性[H +] ﹥ 10-7﹥ [OH -] 时,酸性[H +] ﹤10-7﹤ [OH -] 时,碱性溶液中[H+]越大,其[OH-]越小,酸性越强,碱性越弱;[H+]越小,其[OH-]越大,酸性越弱,碱性越强。
溶液的酸碱性和pH值溶液的酸碱性和pH值是化学中重要的概念,用于描述溶液中的酸碱程度。
本文将介绍溶液的酸碱性的定义、影响因素以及pH值的计算方法和意义。
一、酸碱性的定义酸碱性是描述溶液中氢离子(H+)和氢氧根离子(OH-)浓度的概念。
当溶液中氢离子浓度高于氢氧根离子浓度时,溶液具有酸性;当氢氧根离子浓度高于氢离子浓度时,溶液具有碱性;当氢离子浓度等于氢氧根离子浓度时,溶液为中性。
二、影响酸碱性的因素1. 酸碱溶液的离子产生:当酸性物质(如盐酸)溶解在水中时,会释放出氢离子(H+);而碱性物质(如氢氧化钠)溶解在水中会释放出氢氧根离子(OH-)。
2. 溶液的离子强度:溶液中离子的浓度越高,酸性或碱性越强。
浓度大的酸性物质或碱性物质在水中溶解后会生成更多的氢离子或氢氧根离子。
3. 酸碱物质的强度:酸性或碱性物质的强度也会影响溶液的酸碱性。
具有较强酸性或碱性的物质在水中溶解后,释放的氢离子或氢氧根离子的浓度会更高。
三、pH值的计算方法pH值是用来表示溶液酸碱性强弱的指标,它的取值范围是0到14。
pH值越低,表明溶液越酸性;pH值越高,表明溶液越碱性;pH值为7则表示溶液为中性。
pH值的计算公式为:pH = -log[H+]其中[H+]为溶液中的氢离子浓度,以“mol/L”表示。
四、pH值的意义pH值的测定对许多领域具有重要意义:1. 生物体内pH值的稳定:生物体内维持适宜的pH值对细胞活动至关重要。
例如,人体血液的pH值维持在7.35至7.45之间,细小的pH值变化都可能引起严重的生理问题。
2. 工业生产的调控:许多工业过程需要控制溶液的pH值,以保证反应的顺利进行。
比如酿造啤酒时,需要控制发酵液的pH值在适宜范围内,以确保酵母菌能够正常进行发酵作用。
3. 环境监测和保护:水体和土壤的pH值对环境生态影响巨大。
pH值的测定可以帮助监测环境的酸碱性,及时采取相应的措施保护生态系统的平衡。
总结:溶液的酸碱性和pH值是描述溶液中酸碱程度的重要概念。
酸碱性与pH值在化学领域中,酸碱性是一项重要的概念。
pH值则是用于衡量溶液酸碱性的指标。
本文将介绍酸碱性的定义及其对生活中的应用,并解释pH值的计算和意义。
酸碱性的定义酸和碱是一对相互对立的化学性质。
酸通常具有酸味、酸性溶液具有导电性以及对金属具有腐蚀性等特点。
而碱则通常呈苦味、碱性溶液具有导电性以及与酸发生中和反应等特点。
酸碱性可以从物质的分子层面来理解。
对于水溶液中的酸来说,它会释放H+离子;而碱则会释放OH-离子。
根据这一理论,酸与碱的反应会产生水和盐。
pH值的计算和意义pH值是用来衡量溶液酸碱性程度的指标,它代表了溶液中氢离子的浓度。
计算pH值的公式为:pH = -log[H+]。
在这个公式中,[H+]代表氢离子的浓度。
pH值的范围从0到14,其中7被定义为中性。
当pH值小于7时,溶液被认为是酸性的,pH值越小表示酸性越强。
当pH值大于7时,溶液则被认为是碱性的,pH值越大表示碱性越强。
生活中的酸碱性与pH值应用酸碱性和pH值在生活中有着广泛的应用。
以下是一些具体例子:1. 食物与饮料:酸碱性对于食物和饮料的口感和保存起到重要作用。
例如,柠檬汁和酸奶呈酸性,这就解释了它们的酸味。
而口渴时喝杯碱性水可以中和胃酸,缓解胃酸对肠胃的刺激。
2. 土壤与农业:不同植物对土壤的酸碱性要求不同。
pH值可以帮助农民了解土壤中的养分含量和理想的植物生长条件。
通过调节土壤的酸碱性,可以改善农作物的产量和质量。
3. 化妆品与洗护品:酸碱性对于化妆品和洗护品的功效起到一定的影响。
例如,洗发水的pH值偏碱性可以帮助深层清洁头皮,而柔顺剂的pH值偏酸性可以使头发更加顺滑。
4. 游泳池水和水处理:在游泳池维护中,控制水的酸碱性非常重要。
pH值过高或过低都会对游泳者的皮肤和眼睛造成刺激。
此外,在水处理过程中,调整水的pH值可以帮助去除杂质和微生物。
总结酸碱性和pH值是化学中至关重要的概念。
了解酸碱性的定义和pH值的计算和意义,可以帮助我们更好地理解和应用这些概念。
溶液的酸碱性及pH1.一个基本不变相同温度下,不论是纯水还是稀溶液,水的离子积常数不变。
应用这一原则时需要注意两个条件:水溶液必须是稀溶液;温度必须相同。
2.两个判断标准(1)任何温度c(H+)>c(OH-),酸性;c(H+)=c(OH-),中性;c(H+)<c(OH-),碱性。
(2)常温(25 ℃)pH>7,碱性;pH=7,中性;pH<7,酸性。
3.三种测量方法(1)pH试纸用pH试纸测定溶液的pH,精确到整数且只能在1~14范围内,其使用方法为取一小块试纸放在干净的玻璃片或表面皿上,用玻璃棒蘸取液体,点在试纸中部,待试纸变色后,与标准比色卡对比,读出pH。
注意①pH试纸不能预先润湿,但润湿之后不一定产生误差。
②pH试纸不能测定氯水的pH。
(2)pH计pH计能精确测定溶液的pH,可精确到0.1。
(3)酸碱指示剂酸碱指示剂能粗略测定溶液的pH范围。
常见酸碱指示剂的变色范围如下表所示:4.(1)正盐溶液强酸强碱盐显中性,强酸弱碱盐(如NH4Cl)显酸性,强碱弱酸盐(如CH3COONa)显碱性。
(2)酸式盐溶液NaHSO 4显酸性(NaHSO 4===Na ++H ++SO 2-4)、NaHSO 3、NaHC 2O 4、NaH 2PO 4水溶液显酸性(酸式根电离程度大于水解程度);NaHCO 3、NaHS 、Na 2HPO 4水溶液显碱性(酸式根水解程度大于电离程度)。
特别提醒 因为浓度相同的CH 3COO -与NH +4的水解程度相同,所以CH 3COONH 4溶液显中性,而NH 4HCO 3溶液略显碱性。
(3)弱酸(或弱碱)及其盐1∶1混合溶液①1∶1的CH 3COOH 和CH 3COONa 混合液呈酸性。
②1∶1的NH 3·H 2O 和NH 4Cl 混合溶液呈碱性。
(对于等浓度的CH 3COOH 与CH 3COO -,CH 3COOH 的电离程度大于CH 3COO -的水解程度) (4)酸碱pH 之和等于14等体积混合溶液pH 和等于14的意义:酸溶液中的氢离子浓度等于碱溶液中的氢氧根离子的浓度。