化学基本概念和理论
- 格式:ppt
- 大小:130.50 KB
- 文档页数:52


基本概念和基本理论(一)物质的变化和性质1.物质的变化:物理变化:没有生成其他物质的变化。
化学变化:生成了其他物质的变化。
化学变化和物理变化常常同时发生。
物质发生化学变化时一定伴随物理变化;而发生物理变化,不一定同时发生化学变化。
物质的三态变化(固、液、气)是物理变化。
物质发生物理变化时,只是分子间的间隔发生变化,而分子本身没有发生变化;发生化学变化时,分子被破坏,分子本身发生变化。
化学变化的特征:生成了其他物质的变化。
2.物质的性质 (描述性质的语句中常有“能……”“可以……”等字)物理性质:颜色、状态、气味、熔点、沸点、硬度、密度、溶解性。
化学性质:通过化学变化表现出的性质。
如还原性、氧化性、酸性、碱性、可燃性、热稳定性。
元素的化学性质跟原子的最外层电子数关系最密切。
原子的最外层电子数决定元素的化学性质。
(二)物质的分类3.混合物:是由两种或两种以上的物质混合而成(或由不同种物质组成) 例如,空气,溶液(盐酸、澄清的石灰水、碘酒、矿泉水)矿物(煤、石油、天然气、铁矿石、石灰石),合金(生铁、钢)注意:氧气和臭氧混合而成的物质是混合物,红磷和白磷混合也是混合物。
纯净物、混合物与组成元素的种类无关。
即一种元素组成的物质可能是纯净物也可能是混合物,多种元素组成的物质可能是纯净或混合物。
4.纯净物:由一种物质组成的。
例如:水、水银、蓝矾(CuSO4 ?5H2 O)都是纯净物,冰与水混合是纯净物。
名称中有“某化某”“某酸某”的都是纯净物,是化合物。
5.单质:由同种(或一种)元素组成的纯净物。
例如:铁氧气(液氧)、氢气、水银。
6.化合物:由不同种(两种或两种以上)元素组成的纯净物。
名称中有“某化某”“某酸某”的是化合物。
7.有机物(有机化合物):含碳元素外的化合物(除CO、CO2和含碳酸根化合物外),无机物(无机化合物):不含碳元素的化合物以及CO、CO2 和含碳酸根的化合物8. 氧化物:由两种元素组成,其中一种是氧元素的化合物。

初中化学基本概念和基本理论一、物质的宏观组成——元素※1、元素的概念:具有相同和核电荷数(即质子数)的同一类原子的总称。
2、元素的特征:只论种类,不论个数。
3、决定元素种类的是核电荷数即质子数。
如:Na和Na+属于同一种元素——钠元素二、物质的微观构成——分子、原子、离子1、分子※(1)定义:分子是保持物质化学性质的一种微粒(2)性质:①分子永不停息地做无规则运动。
如:蒸发、溶解、扩散是分子运动。
②分子之间有间隔。
如物质三态变化,热胀冷缩。
③同种物质分子,性质相同,不同种物质分子,性质不同。
④在物理变化中,分子本身没变,在化学变化中,分子本身变成了新的分子。
(3)由分子构成的物质:①一些非金属单质(H2 、O2、N2、Cl2、I2等)②共价化合物(HCl 、H2O、CO2、H2SO4等)(4)提出分子学说的科学家是意大利的阿伏加德罗。
2、原子:※⑴定义:原子是化学变化中的最小微粒,⑵性质:①原子在不停地运动。
②原子在化学变化中不能再分,只是重新组合,形成其它物质的分子。
⑶由原子构成的物质:金刚石、石墨、单质硅、金属、稀有气体。
⑷提出原子学说的科学家是英国的道尔顿。
3、离子:⑴定义:离子是带电的原子或原子团阴离子原子阳离子⑵分类:阳离子:带正电荷的离子,质子数>电子数。
例Na+ NH4+阴离子:带负电荷的离子,质子数<电子数。
例Cl-、OH-、CO32-⑶离子化合物由离子构成。
例如:NaCl、K2SO4、NH4NO34、元素的化学性质主要决定于原子的最外层的电子数三、物质的分类1、物质分为纯净物和混合物。
纯净物:由一种物质组织的物质。
混合物:由两种或两种以上物质组成的物质。
2、纯净物分为单质和化合物※单质:由一种元素组成的纯净物。
※化合物:由不同种元素组成的纯净物。
3、化合物分为氧化物、酸、碱、盐⑴氧化物:由两种元素组成其中一种是氧元素的化合物。
⑵酸:电离时生成的阳离子全部是H-的化合物,如:HCl H2SO4 HNO2⑶碱:电离时生成的阴离子全部是OH-的化合物,如:NaOH Ca(OH)2⑷盐:电离时生成的金属离子和酸根离子的化合物,如:NaCl K2CO3 NH4NO3⑴酸性氧化物:与碱反应生成盐和水氧化物,如:CO2 SO2 SO3⑵碱性氧化物:与酸反应生成盐和水氧化物,如:CaO Fe2O3 Cao化合物:⑴离子化合物:阴、阳离子相互作用构成的化合物叫离子化合物。

基本概念和基本理论首先在初中化学学习中里面我们把它分为四大部分,这样清楚并且条理性强!一、物质的组成和结构(包括化学用语)二、物质的分类三、物质的性质和变化、质量守恒定律四、溶液基本概念和基本理论(一)物质的组成和结构(一)分子、原子、离子的关系1.2.3.三种粒子在化学变化中的关系:(二)几个决定和几个等式1.决定(市常考!)(1)质子数(或核电荷数)决定元素的种类。
(2)最外层电子数决定元素的化学性质2.等式(1)质子数=核电荷数=电子数(在原子中)(2)相对原子质量=质子数+中子数(3)离子所带电荷数=其化合价数值(三)化学变化和物理变化的本质区别物理变化中分子本身不改变,只是分子间的间隔等发生变化;而化学变化中分子破裂为原子,原子重新组合成新物质的分子。
(四)物质的微观构成与宏观组成(注意化学用语的规X使用)典型例题例1.下列关于分子的说法正确的是()A.一切物质都是由分子构成的B.分子是化学变化中的最小粒子C.分子是不能再分的粒子D.分子是保持物质化学性质的最小粒子答案为D。
例2.根据《生活报》报道,目前小学生喜欢使用的涂改液中,含有许多挥发性的有害物质,长期使用易引起慢性中毒而头晕、头疼,二氯甲烷就是其中的一种。
下列关于二氯甲烷(CH2Cl2)的叙述正确的是()A.二氯甲烷是由碳、氢气、氯气组成的B.二氯甲烷是由碳、氢、氯三种元素组成的C.二氯甲烷是由一个碳元素、二个氢元素、两个氯元素组成的D.二氯甲烷是由一个碳原子、二个氢原子、二个氯原子构成的答案为:B。
例3.根据下图所示的粒子结构示意图,回答问题:(1)表示相对稳定结构的粒子是(填序号,下同)____。
(2)表示同一种元素的粒子是____。
(3)在化学反应中,易失去电子的粒子是____,易获得电子的粒子是____。
答案为:(1)BDF (2)EF (3)CE例4.将元素、分子、原子、离子、质子、中子或电子分别填入下列有关空格内。


化学概论知识点总结化学概论是化学的基础知识,它包括了化学的基本概念、化学反应、化学原理、理论和实验基础等内容。
化学概论是学习化学的入门课程,通过学习化学概论可以了解化学的基本原理和规律,为深入学习更高级的化学学科奠定了基础。
本文将对化学概论的各个知识点进行总结,帮助大家更好地掌握化学知识。
一、化学的基本概念1. 物质和能量物质是构成世界的基本元素,它可以通过化学反应进行转化。
能量是物质运动的动力,化学反应过程中常常伴随着能量的转化。
物质和能量是化学研究的核心概念。
2. 原子和分子原子是构成物质的最小单位,分子是由原子组成的。
化学反应就是原子和分子之间的转化过程。
了解原子和分子的结构对于理解化学反应及其规律至关重要。
3. 元素和化合物元素是由同一种原子组成的物质,化合物是由不同元素组成的。
化学反应常常涉及元素之间的组合和分解。
熟悉元素和化合物的性质对于化学学习具有重要意义。
二、化学反应1. 化学反应的基本概念化学反应是指原子和分子之间的转化过程,它包括了化学方程式、化学反应速率、化学平衡等概念。
了解化学反应的基本概念有助于理解反应机制及其动力学特性。
2. 化学反应的热力学热力学是研究物质能量转化和热力学规律的科学,它对于理解化学反应的能量变化和热力学特性起到了至关重要的作用。
了解热力学对于深入理解化学反应过程至关重要。
3. 化学反应的速率和平衡化学反应速率是指单位时间内反应物消耗或生成的量,化学平衡是指反应物和生成物浓度达到一定比例的状态。
了解反应速率和平衡对于控制和调控化学反应过程具有重要意义。
三、化学原理1. 原子结构原子由核和电子组成,核内有质子和中子,电子围绕核旋转。
熟悉原子结构对于理解元素的性质和化学反应过程有重要意义。
2. 元素周期律元素周期律是根据元素的周期性和规律性排列起来的一张表格,它可以帮助我们了解元素的性质及其规律。
掌握元素周期律对于预测元素的化学性质和性能至关重要。
3. 化学键和分子结构化学键是原子之间的连接力,分子是由原子通过化学键结合而成的。

高三化学第一部分基本概念和基础理论[教材分析]化学基本概念和基础理论是化学知识的基础,是从大量的化学现象和化学事实中抽象概括出来的,是化学现象的本质,它对学习元素及化合物知识有重要的指导意义。
能否准确、深刻地理解基本概念和基础理论,注意分析这些内容之间的联系和区别,形成体系,并能灵活运用这些知识,是学好化学的一个重要标志。
一、基本概念和基本理论1. 物质的组成、性质和分类(1) 物质的分子、原子、离子、元素等概念的涵义;了解原子团的定义。
(2) 理解物理变化与化学变化的区别与联系。
(3) 理解混合物和纯净物、单质和化合物、金属和非金属的概念。
(4) 以白磷、红磷为例,了解同素异形体的概念。
(5) 理解酸、碱、盐、氧化物的概念及其相互联系。
2. 化学用语(1) 熟记并正确书写常见元素的名称、符号、离子符号。
(2) 理解化合价的涵义。
能根据化合价正确书写化学式(分子式),并能根据化学式判断化合价。
(3) 掌握电子式、原子结构示意图、分子式、结构式和结构简式的表示方法。
(4) 理解质量守衡定律的涵义。
能正确书写化学方程式、热化学方程式、离子方程式、电离方程式、电极反应式。
3.化学中常用计量(1) 理解原子量、分子量的涵义。
(2) 掌握物质的量及其单位——摩尔、摩尔质量、气体摩尔体积的涵义。
理解阿伏加德罗常数的涵义。
掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系。
4. 化学反应基本类型(1) 掌握化学反应的四种基本类型:化合、分解、置换、复分解。
(2) 理解氧化和还原、氧化性和还原性、氧化剂和还原剂等概念。
能判断氧化还原反应中电子转移的方向和数目,并能配平反应方程式。
5. 溶液了解溶液、悬浊液、乳浊液的涵义。
(1) 了解溶液的组成和形成过程,溶解时的吸热或放热现象。
(2) 了解饱和溶液、不饱和溶液的概念。
理解溶解度的概念。
理解温度对溶解度的影响及溶解度曲线。
(3) 了解结晶、结晶水、结晶水合物、风化、潮解的概念。

高中化学与生活常考知识点总结高中化学与生活相关的知识点主要包括以下几个方面:1. 化学基本概念和基础理论:- 阿伏加德罗定律:在同温同压下,同体积的气体含有相同的分子数,即三同”定一同”。
- 推论:同温同压下,V1V2n1n2;同温同体积时,p1p2n1n2N1N2;同温同压等质量时,V1V2M2M1;同温同压同体积时,M1M2。
- 气体摩尔体积:气体摩尔体积是指在标准状态下,1 摩尔气体所占的体积。
- 离子共存:由于发生复分解反应,离子不能大量共存。
2. 食品营养与化学:- 碳水化合物、脂肪、蛋白质是常见的食品营养成分。
- 食品加工与保存:常见的食品加工有脱水、腌渍、熏制、烘焙等。
常见的食品保存方法有低温保存、罐装保存、干燥保存等。
- 食品安全与保护:常见的食品安全问题有污染、变质、过期、添加违禁品等。
保护食品安全的方法有保持食品的新鲜度、储存食品的温度和时间、避免食品交叉污染等。
3. 环境保护与化学:- 空气污染:来源有汽车尾气、工厂废气、燃烧废气等,危害有造成眼睛、鼻子和喉咙刺激,导致呼吸道疾病等。
- 水污染:来源有工业废水、农业废水、城市污水等,危害有水质优不起来,导致鱼类死亡,甚至危害人类健康等。
- 固体废弃物:分类有废金属、废塑料、废纸等,危害有占用土地、污染土壤和水源等。
4. 医疗保健与化学:- 药物分类:有抗生素、非抗生素、激素等。
- 药物的作用:有抗炎、抗毒、抗癌等。
- 药物的禁忌:有药物相互抵消、与食物的相互作用等。
以上是高中化学与生活常考的知识点总结,这些内容都需要学生在学习过程中认真掌握,并在生活中积极应用。

初中化学第⼀章复习基本概念和基本理论初中化学第⼀章复习第⼀部分基本概念和基本理论⼀、物质的变化和性质物理变化—物质在变化过程中,没有⽣成其他物质的变化。
物质的变化化学变化—物质在变化过程中,⽣成其他物质的变化。
物理变化例⼦如:空⽓分离法制氧⽓,⽯油分馏,固体NaOH潮解,浓硫酸吸⽔,浓盐酸挥发,活性炭吸附⽓体,物质的三态变化,物质的形状变化。
化学变化例⼦如:晶体失去结晶⽔,风化,⽆⽔硫酸铜变成蓝⾊晶体,⽣⽯灰吸⽔,NaOH吸收⼆氧化碳变质,煤的⼲馏,物质分解,燃烧,物质之间相互反应,钢铁⽣锈、⾷物腐败、酸碱指⽰剂变⾊等。
物理性质—物质不需要发⽣化学变化就能表现出来的性质。
物质的性质化学性质—物质在化学变化中表现出来的性质。
物理性质例⼦如:状态,⽓味,溶解性,挥发性,吸附性,延展性,熔点,沸点,硬度,颜⾊、密度。
化学性质例⼦如;不稳定性,稳定性,酸性,碱性,中性,脱⽔性,可燃性,腐蚀性,活泼性,不活泼性,氧化性,还原性,助燃性,毒性。
⼆、化学反应的类型化合反应—由⼆种或⼆种以上的物质⽣成另⼀种物质的反应。
分解反应—由⼀种物质⽣成两种或两种以上其他物质的反应。
化学反应的类型置换反应—由⼀种单质跟⼀种化合物反应,⽣成另⼀种单质和另⼀种化合物的反应。
复分解反应—由两种化合物互相交换成分,⽣成另外两种化合物的反应。
化合反应(⼏合⼀或多变⼀)(A+B→AB)分解反应(⼀分⼏或⼀变多)(AB→A+B)常见能分解的物质如:H2O ,H2CO3,C u(O H)2,F e(O H)3,CaCO3,KClO,3NH4HCO3,C u2(O H)2C O3置换反应(单+化→单+化)(A+BC→AC+B);注意:根据⾦属活动性顺序排在前⾯的⾦属能把排在后⾯的⾦属从盐溶液中置换出来或置换酸中的氢,铁在置换反应中⽣成亚铁盐。
复分解反应(化+化→化+化)(AB+CD→AD+CB)注意:复分解反应发⽣在酸,碱,盐之间。
⽣成物中必须有沉淀、⽓体、⽔⽣成。
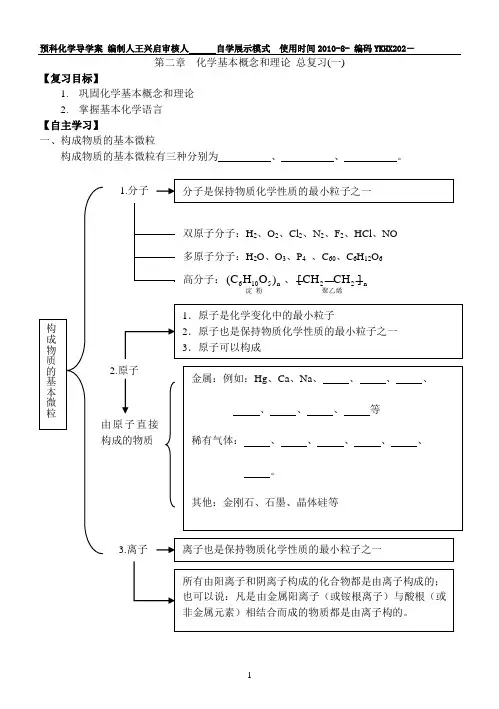
第二章化学基本概念和理论总复习(一)【复习目标】1.巩固化学基本概念和理论2.掌握基本化学语言【自主学习】一、构成物质的基本微粒构成物质的基本微粒有三种分别为、、。
【合作探究】三、基本理论的应用1. 原子可以构成分子:如1个水分子由 构成;1个二氧化碳分子由构成。
2. 由分子构成的物质,在发生物理变化时,分子本身(填“改变”或“不变”,下同),在发生化学变化时,分子本身。
3. 由分子构成的物质发生化学变化的实质是:反应物分子被破坏重新组合聚集−−−→−−−−→−−−→被破坏重新组合聚集反应物分子 新物质四、分子与原子的特点分子与原子都具有以下三个特点:1. 质量、体积都 ;2. 分子和原子都在 ;3. 分子和原子之间都有。
五、原子的结构⎧⎪⎧⎨⎨⎪⎩⎩核外电子(带负电)原子质子(带正电)原子核中子(不带电)六、原子结构示意图第二层(K 层)最多排8个最外层最多排8个决定元素的化学性质元素的化合价元素的分类元素的种类决定六、物质的分类⎧⎪−−−→⎨⎪⎩−−−→⎧−−−→−−→⎨⎩根据元素的性质根据组成根据组成组成物质的种类物质的种类混合物(多种物质),如:空气,糖水 金属单质,如:铁,铜单质非金属单质,如:硫,磷 (同种元素)稀有气体单质,如:氦气物质金属氧化物纯净物(一种物质)氧化物非金属氧化物化合物酸 (不同种元素)⎧⎪⎧⎪⎪⎪⎪⎪⎪⎪⎪⎪⎨⎪⎧⎨⎪⎪⎪⎪⎪⎪⎪⎪⎨⎪⎪⎪⎪⎪⎪⎪⎪⎪⎩⎩⎩碱 盐【质量检测】1. 保持水化学性质的最小微粒是( )A .水分子B .氢分子C .氢原子和氧原子D .氢离子和氧离子2. 下列关于分子和原子的主要区别的叙述,正确的是( )A .原子质量小,分子质量大B .原子体积小,分子体积大C .在化学变化中,分子能分,而原子不能再分D .分子能保持物质的化学性质,而原子不能3. 下列各组物质,全都由原子直接构成的一组是( )A.金刚石、干冰、氯化钠B.汞、氢气、氩气C.生石灰、硫磺、二氧化硫D.石墨、钨、氦气4.下列现象中,不能用分子运动解释的是()A.把两块表面平滑的铅压紧,就不容易将它们拉开B.在室内。

化学第一单元化学是一门研究物质的组成、性质、变化以及它们之间的相互关系的科学。
作为自然科学的一部分,化学涉及到我们日常生活中几乎所有的物质和现象。
本文将介绍化学的基本概念、研究方法和一些重要的化学原理。
一、化学基本概念1. 原子与元素原子是物质的基本单位,由质子、中子和电子组成。
元素是由具有相同原子序数的原子组成的纯物质。
目前已知的元素有118种,其中92种是自然元素,其余的元素则是人工合成。
2. 化合物与化学式当两种或更多种元素结合在一起时,形成了化合物。
化合物的组成由化学式表示,化学式可以告诉我们化合物中各种元素的种类和相对比例。
3. 反应和方程式化学反应是物质之间的转化过程。
化学方程式用化学符号和化学式表示化学反应,包括反应物和产物。
在化学方程式中,反应物在箭头的左侧,产物在箭头的右侧,而箭头表示反应的方向。
二、化学研究方法1. 实验与观察化学研究通常依赖于实验和观察。
通过设计实验并进行观察,科学家们可以收集数据和提取信息。
实验可以通过控制变量来研究某一特定因素对化学反应的影响。
2. 数据分析和统计在化学研究中,收集到的数据需要进行分析和统计。
通过计算平均值、标准差和相关系数等统计参数,可以得出实验结果的科学依据,并进行科学推理和结论。
三、化学的重要原理1. 物质的组成与结构化学研究关注物质的组成和结构。
通过研究物质的原子和分子组成,可以了解物质的性质和行为。
例如,水分子由两个氢原子和一个氧原子组成,这种组成决定了水的化学和物理性质。
2. 元素周期表元素周期表是化学家们组织元素的工具。
元素周期表根据元素的原子序数和元素的性质将元素分类和排列。
周期表的排列方式揭示了元素的周期性规律,并可以预测元素的性质。
3. 反应速率与平衡化学反应的速率和平衡是化学中重要的概念。
反应速率表示单位时间内反应物消耗或产物形成的量。
反应平衡表示在反应达到某一状态后,反应物和产物的浓度保持稳定。
4. 化学键与分子间力化学键是原子之间的连接,分子间力是分子之间相互作用的力。
一、化学基本概念和基础理论物质的组成世界上的一切物质都是由元素组成的。
科学家已经发现109种元素(含自然界存在的元素及人造元素)。
元素可分为金属元素和非金属元素。
元素呈游离态时为单质,呈化合态时则形成化合物。
分子、原子、离子是构成物质最基本的微粒。
分子能独立存在,是保持物质化学性质的一种微粒,由分子构成的物质,有非金属单质如O2、白磷等;稀有气体如Ar,是单原子分子;非金属元素的化合物如氢化物、氧化物、含氧酸、大多数有机物等,它们在固态时均为分子晶体。
原子是化学变化中的最小微粒,在化学反应中,原子核外的价电子发生改变,原子重新组合形成新物质。
原子可结合成分子,例如CO2分子,干冰是由CO2分子构成的;原子也可直接构成原子晶体的物质,例如SiO2是由Si原子和O原子按1∶2直接连接构成的。
金属单质也可视作是由金属原子构成的物质。
离子是带电的原子或原子团,例如Na+、OH-、等,由阳、阴离子结合构成的物质,例如NaCl、NH4Cl、MgO等,它们都是离子晶体。
大多数盐、强碱、低价金属氧化物都是离子化合物。
物质的分类世界上的物质有千千万万种,根据组成和性质可将物质大致分为以下几类:①混合物和纯净物混合物是由不同种物质的分子混合而成,没有固定的组成和熔、沸点,例如空气、天然气是气态混合物,石油,一切溶液是液态混合物,玻璃、铁合金是固态混合物。
同种元素组成的同素异形体如O2和O3混合也是混合物。
纯淀粉因分子大小不同,没有固定熔点,可以视作混合物。
纯净物由同种分子组成,有固定的组成和熔、沸点,例如结晶水合物(CuSO4·5H2O)、复盐(KAl(SO4)2·12H2O)、络合物(Na3AlF6),它们都是纯净物。
②单质由同种元素组成的物质。
金属单质如Mg、Cu、Fe等都是金属晶体,常温下除Hg为液体外均为固体。
金属具有金属光泽,有良好的导电、导热、延展性,金属在化学反应中作还原剂。
非金属单质除金刚石、硅晶体、硼晶体是原子晶体,石墨是碳原子组成的过渡型晶体外,大多数是分子晶体。
化学专业课题一、化学基础理论化学基础理论是化学学科的核心,包括原子、分子、化学键、化学反应等方面的基本概念和原理。
它涉及到物质的结构、性质、变化和反应机制等方面,为化学实验和技术提供了理论基础。
二、化学分析方法化学分析方法是对物质进行定性和定量分析的方法,包括化学分析、光谱分析、色谱分析、质谱分析等。
这些方法可以用来确定物质的成分、结构和性质,以及研究物质的反应过程和机理。
三、化学合成技术化学合成技术是利用化学反应合成新物质的技术,包括有机合成、无机合成、高分子合成等。
这些技术可以用来制备具有特定结构和性质的化合物,为材料科学、医药、农业等领域提供重要的物质基础。
四、化学实验技术化学实验技术是进行化学实验所需要掌握的技术和方法,包括实验设计、实验操作、实验数据处理等方面的技能。
这些技术可以用来验证化学理论,探索新的化学反应和合成方法,以及解决实际问题。
五、化学反应原理化学反应原理是研究化学反应的机制和规律的科学,包括反应动力学、反应机理等方面的研究。
这些研究可以用来预测和控制化学反应的过程和结果,为新物质的合成和开发提供理论支持。
六、分子结构与性质分子结构与性质是研究分子结构和性质关系的科学,包括分子光谱学、分子力学、分子电子学等方面的研究。
这些研究可以用来了解分子的结构和性质,以及预测分子的行为和反应。
七、材料化学材料化学是研究材料组成、结构、性质和制备的科学,包括金属材料、非金属材料、复合材料等方面的研究。
这些研究可以用来开发新的材料和制备技术,提高材料的性能和应用范围。
八、环境化学环境化学是研究环境中有害物质的形成、转化和归宿的科学,包括大气污染、水污染、土壤污染等方面的研究。
这些研究可以用来评估环境污染的程度和影响,提出治理和保护环境的措施和建议。
九、生物化学生物化学是研究生物体内物质的合成、分解和代谢的科学,包括蛋白质结构与功能、基因表达调控等方面的研究。
这些研究可以用来了解生物体的生命活动过程和机制,为医学、农业等领域提供重要的理论基础和技术支持。
一、物质的变化与性质物理变化化学变化 定义 没有其他物质生成的变化 有其他物质生成的变化特征 物质形状或状态的变化 有新物质生成示例工业制氧、干冰升华、矿石粉碎物质变质、物质燃烧、指示剂变色联系 化学变化过程中一定伴随有物理变化 物理变化过程中不一定发生化学变化物理性质化学性质含义不需要发生化学变化就能体现出来的性质物质在化学变化时表现出来的性质示例 颜色、状态、气味、熔点、沸点、硬度、密度、溶解性、挥发性、导电性……可燃性、助燃性、酸碱性、氧化性、还原性、热稳定性、金属活动性、使指示剂变色……1.在判断物质的变化类型时(1)要抓住“是否有其他物质生成”的本质特征来区别化学变化和物理变化。
(2)要理解化学变化的实质是原子的重新组合,所谓“生成其他物质”是指原物质中的原子经重新组合而生成了新物质。
所以同素异形体之间的转化也属于生成新物质的化学变化。
2.在判断物质的性质类型时(1)要抓住“是否需要通过化学变化就能表现”的依据来区别化学性质和物理性质,如颜色、状态、气味、熔点、沸点、硬度、密度、导电性、溶解性、挥发性等属于物理性质,如可燃性、氧化性、还原性、稳定性、酸碱性等属于化学性质。
(2)字眼:可、能、易、会。
(“什么能使什么怎么样”,“什么物质能够怎么样,有什么性”)基本概念与基本理论部分模块一:物质的变化、性质和用途知识精讲3.物质的性质与物质的变化的区别与联系(1)物质的性质,是物质固有的属性,它决定了物质在一定条件下能否发生某种变化; (2)物质的变化,是物质的运动形式,是物质的性质的具体表现。
易错点:(1)金刚石转变为石墨的过程是________变化; (2)活性炭净化的过程是________变化; (3)溶解、蒸发、过滤等过程都是________变化; 4.变化、性质与用途之间的关系题型1:物质变化的类型 【例1】属于物理变化的是 ()A .食物腐败B .大米酿酒C .铁钉生锈D .干冰升华【例2】(2014年中考)属于化学变化的是 ()A .酒精挥发B .西瓜榨汁C .木炭燃燃D .糯米磨粉 【例3】下列有关物质的变化:①酒精挥发②保险丝的熔断 ③植物的光合作用 ④石墨转化为金刚石⑤轮胎爆炸⑥液化空气制氧其中属于化学变化的正确组合是____________________________。
化学详细基础知识一、基本概念1. 物质的变化及性质(1)物理变化:没有新物质生成的变化。
①宏观上没有新物质生成,微观上没有新分子生成。
②常指物质状态的变化、形状的改变、位置的移动等。
例如:水的三态变化、汽油挥发、干冰的升华、木材做成桌椅、玻璃碎了等等。
(2)化学变化:有新物质生成的变化,也叫化学反应。
①宏观上有新物质生成,微观上有新分子生成。
②化学变化常常伴随一些反应现象,例如:发光、发热、产生气体、改变颜色、生成沉淀等。
有时可通过反应现象来判断是否发生了化学变化或者产物是什么物质。
(3)物理性质:物质不需要发生化学变化就能表现出来的性质。
①物理性质也并不是只有物质发生物理变化时才表现出来的性质;例如:木材具有密度的性质,并不要求其改变形状时才表现出来。
②由感官感知的物理性质主要有:颜色、状态、气味等。
③需要借助仪器测定的物理性质有:熔点、沸点、密度、硬度、溶解性、导电性等。
(4)化学性质:物质只有在化学变化中才能表现出来的性质。
例如:物质的金属性、非金属性、氧化性、还原性、酸碱性、热稳定性等。
2. 物质的组成原子团:在许多化学反应里,作为一个整体参加反应,好像一个原子一样的原子集团。
离子:带电荷的原子或原子团。
元素:具有相同核电荷数(即质子数)的一类原子的总称。
3. 物质的分类(1)混合物和纯净物混合物:组成中有两种或多种物质。
常见的混合物有:空气、海水、自来水、土壤、煤、石油、天然气、爆鸣气及各种溶液。
纯净物:组成中只有一种物质。
①宏观上看有一种成分,微观上看只有一种分子;②纯净物具有固定的组成和特有的化学性质,能用化学式表示;③纯净物可以是一种元素组成的(单质),也可以是多种元素组成的(化合物)。
(2)单质和化合物单质:只由一种元素组成的纯净物。
可分为金属单质、非金属单质及稀有气体。
化合物:由两种或两种以上的元素组成的纯净物。
(3)氧化物、酸、碱和盐氧化物:由两种元素组成的,其中有一种元素为氧元素的化合物。
一、化学基本概念和基础理论物质的组成世界上的一切物质都是由元素组成的。
科学家已经发现109种元素(含自然界存在的元素及人造元素)。
元素可分为金属元素和非金属元素。
元素呈游离态时为单质,呈化合态时则形成化合物。
分子、原子、离子是构成物质最基本的微粒。
分子能独立存在,是保持物质化学性质的一种微粒,由分子构成的物质,有非金属单质如O、白磷等;稀有气体如Ar,是单原子分子;非金属元素的化合物如氢化物、氧化物、含氧酸、大多数有机物等,它们在固态时均为分子晶体。
原子是化学变化中的最小微粒,在化学反应中,原子核外的价电子发生改变,原子重新组合形成新物质。
原子可结合成分子,例如CO分子,干冰是由CO分子构成的;原子也可直接构成原子晶体的物质,例如SiO是由Si原子和O原子按1∶2直接连接构成的。
金属单质也可视作是由金属原子构成的物质。
离子是带电的原2222子或原子团,例如Na、OH、+-4等,由阳、阴离子结合构成的物质,例如NaCl、NHCl、MgO等,它们都是离子晶体。
大多数盐、强碱、低价金属氧化物都是离子化合物。
物质的分类世界上的物质有千千万万种,根据组成和性质可将物质大致分为以下几类:①混合物和纯净物混合物是由不同种物质的分子混合而成,没有固定的组成和熔、沸点,例如空气、天然气是气态混合物,石油,一切溶液是液态混合物,玻璃、铁合金是固态混合物。
同种元素组成的同素异形体如O和O混合也是混合物。
纯淀粉因分子大小不同,没有固定熔点,可以视作混合物。
纯净物由同种分子组成,有固定的组成和熔、沸点,例如结晶水合物(CuSO・5HO)、复盐(KAl(SO)・12HO)、络合物(NaAlF),它们都是纯净物。
②单质由同种元素组成234242236的物质。
金属单质如Mg、Cu、Fe等都是金属晶体,常温下除Hg为液体外均为固体。
金属具有金属光泽,有良好的导电、导热、延展性,金属在化学反应中作还原剂。
非金属单质除金刚石、硅晶体、硼晶体是原子晶体,石墨是碳原子组成的过渡型晶体外,大多数是分子晶体。