临床试验启动会会议记录
- 格式:doc
- 大小:40.00 KB
- 文档页数:1

召开项目启动会SOP1.准备阶段1.1 临床试验合同/协议签订后,申办者/CRO按照《项目正式启动提交资料目录》要求提交研究文件资料至机构办公室保存。
临床试验用药物及相关物资按照《临床试验药物的接收、贮存、分发、使用、回收、退还、销毁SOP》递送至GCP中心药房,交接并记录。
1.2 资料、药物及物品交接完毕后,由研究者负责召集、PI主持本项目临床试验启动会的召开。
1.3 本医院为组长单位时,依临床试验中心的地域分布,征求参加单位意见和建议,确定试验启动会议地点、时间。
2.进行阶段2.1 与会人员:2.1.1 机构:秘书、质量管理员;2.1.2 专业组:主要研究者、研究者、药物管理员、资料管理员、质量管理员、仪器管理员、研究护士、专业组秘书;2.1.3 检验科、影像科等辅助科室人员;2.1.4 申办者/CRO:监查员。
3. 所有到场人员须在《临床试验启动会签到表》签名,专业组秘书在会议过程中做好会议记录。
4. 主要研究者主持会议;5. 申办者/ CRO指定的人员对研究人员介绍药物临床研究背景、方案,包括受试者入选标准/排除标准、研究流程、观察指标、安全性评估;获取和签署知情同意书的程序;试验药物的用法、贮存方法及药物管理流程;预期的不良事件以及记录、处理不良事件和报告严重不良事件的流程;研究者如何填写研究病历、CRF和(或)日记卡;试验期间监查计划等。
6. 机构质量管理员提出机构检查要求,要求研究者在研究期间:6.1 遵守GCP原则,承担相应的责任;6.2 确保严格按照试验方案进行;6.3 熟知机构试验药品管理流程;6.4 确保受试者在试验前签署知情同意书;6.5 严格筛选、入选受试者;6.6 试验过程的质控;6.7 试验期间积极配合监查、稽查、视察工作;7. 研究人员针对试验方案提出疑问,申办者/CRO指定的人员对提出的问题进行解答。
8. 研究人员针对试验实施过程提出需要协调的问题,机构办公室负责进行协调。

临床试验启动会新闻稿
良好的开端是成功的一半,项目启动会是项目的开始,是项目实施方法论中的重要一环。
广州xxx公司为优化临床试验项目的启动,顺利推动项目的进程,使流程达到启动会后项目即可入组的状态,于x月x 日召集具有丰富经验的项目经理及商务总监针对目前项目启动会召开
的情况与各项目项目经理进行经验分享。
本次会议首邀具有丰富会议举办经验的市场部xxx总监从商务角度对会议召开准备内容、准备过程中的注意事项及客情维护的重点内容进行了分享,会议召开的成功离不开各环节的分工及配合,xxx总监针对目前参加过的启动会会议从商务角度提出的一些整改意见。
项目经理作为启动会召开的领导者起着举足轻重的作用,项目经理xxx针对常规启动会过程资料准备、工作流程安排等环节内容进行了分享。
项目经理xxx针对线上启动会需要注意到的沟通、设备准备及调试等方面需要注意的相关内容进行了分享。
针对以上同事在启动会过程中的心得体验,质量管理中心xxx总监在对临床试验项目开展过程中需要召开的顶层设计会、协调会、启动会、总结会等会议的标准操作流程进行了针对性讲解。
临床二部、临床三部部门负责人也再次强调需要注意的一些细节内容,同时对如何做到掌握好时间分配及重点内容进行了讲解,使得启动
会召开后各研究者能够对项目入组流程有清晰的认识。
xxx有完整的临床试验整体流程,各环节均配置有标准操作流程,在多年的项目运行中持续优化改进,使得各环节的操作流程更具有可操作性。

临床试验项目启动会SOP
I目的规范临床试验项目启动会规程,保证启动会议的效果,落实项目启动的质量控制
II范围适用于我院开展的所有申办方发起的临床试验
III规程
1各专业组需至少提前一周邮件发送至机构办邮箱shiyigcp@递交项目启动申请,同时附授权分工表(可参见机构网页样表)、启动会参会人员名单及启动会日程(可参见附件1)
2所有授权研究团队人员必须都参加启动会培训,特殊情况需本人向机构办主任请假
3项目组需根据方案及CFDA相关临床试验的指导原则及法规要求(如:现场核查要点),在启动前准备好所有工作表单后方可申请启动
4授权的研究团队必须具备相应的资质(本院执业医师证)及GCP培训证书,第三方CRC授权必须已签署协议并完成机构办备案
5机构办在接到专业组项目启动申请后必须一周内回复,明确启动会议召开的场地及具体时间
6机构办人员必须参加启动会,熟悉了解临床试验方案和实施要求,并完成对项目启动会的质控,填写《临床试验启动会记录表》(附件2)
7启动会议结束后,专业组/CRA需保留好启动会培训记录、会议纪要、培训材料、启动会签到表、完成的授权分工表等资料
IV参考依据现行GCP第十一章“质量保证”
V附件
1启动会日程
2临床试验启动会记录表
启动会议议程
临床试验启动会记录表(机构)
机构参会人员
年月日。

临床试验启动会议纪要Initiation Meeting MinutesSubject:临床试验启动会主题Date:日期Venue:地点Participants:见会议签到表Meeting Attendance Record 出席人员Prepared by:记录员启动会主要内容记录(请根据试验项目要求进行记录,可附页)附件:1、会议签到表2、方案签字页(研究者签名样张)3、任务授权表会议签到表Meeting Attendance Record方案签字页(签名样张)I have thoroughly read and reviewed the study protocol. Having read and understood the requirements and conditions of the study protocol. I agree to conduct or instruct this project and follow the time schedule indicated in protocol. I understand that it is protocol violation if revise the protocol without approval from Ethic committee. 我已完全阅读了研究方案,并明白了方案的要求。
我同意遵循方案及时间规程来执导该项临床研究。
我亦知道没有伦理委员会的批准就修改方案是违反方案的。
I agree to perform the clinical study according to the Chinese Good Clinical Practice principles and regulatory authority requirements for source document verification and auditing/inspection of the study.我同意按中国GCP原则进行临床试验,并接受法规部门对原始资料的核查和对临床试验的稽查/视察。

药物临床试验临床会议标准操作规程Ⅰ.目的:建立临床试验临床会议管理制度,实现会议组织、召开标准化管理。
Ⅱ.范围:适用所有临床试验特别强调:1、所有未参加会议的人员劳务费,一律不允许委托其他人带,待下次项目负责人亲自送给本人手里。
2、凡北京召开的会议,从北京站到会场的,一律安排车接,从机场往返的,原则上不接送,特别重要的人物或参会人员本人特别要求接送的再另行安排。
Ⅲ.规程:1. 在会议召开前两周以前提交会议申请表,注明召开会议原因,会议涉及内容、拟定召开时间,常规会议直接由部门负责人审核安排,非常规会议需部门负责人审批后提交公司审批。
2. 会议召开目的:2.1讨论和确定临床试验方案、研究病历等试验文件,就方案、研究病历的设计、执行等相关问题统一认识,以更好地保证临床试验的同步性和一致性;2.2加强各研究单位机构、科室人员之间,申办者、CRO与研究单位、统计学家之间的多方交流及了解,以便保证各研究单位对于临床试验的有力开展以及对于监查工作的积极配合与帮助,从而确保临床试验的顺利实施。
3. 会议筹备阶段:细致周详的会议筹备是会议召开成功与否的关键,筹备药物临床启动会,包括以下内容:3.1沟通在会议召开前一周以前完成以下沟通:就方案中的重点问题与组长单位(临床PI及机构项目负责人)、各参加单位的PI、统计单位、申办单位、研发者、CDE审评人员及特邀专家尽早进行充分沟通,以尽早协商解决或提前咨询相关专家,以促进会议预期目标的一致性;●如果是组长单位设计的方案,其中相关统计内容必须由统计学家认可,并将所提意见或建议反馈组长单位认可修改;●与各研究单位的有效沟通须贯穿于启动会议的全过程,尤其注意预先与组长单位PI和机构项目负责人确定会议流程,会议主持人。
会议流程中必须包括申办单位领导发言安排,需要发言人员必须提前通知发言人做好发言准备。
●与各研究单位及申办方会前按照会议议程确认各单位在会中的职责,提前做准备工作,如PI组织会议的会议流程、各环节需要控制的时间,如果要求进行临床前介绍,提前确定介绍的人员以及介绍的内容和控制时间等。
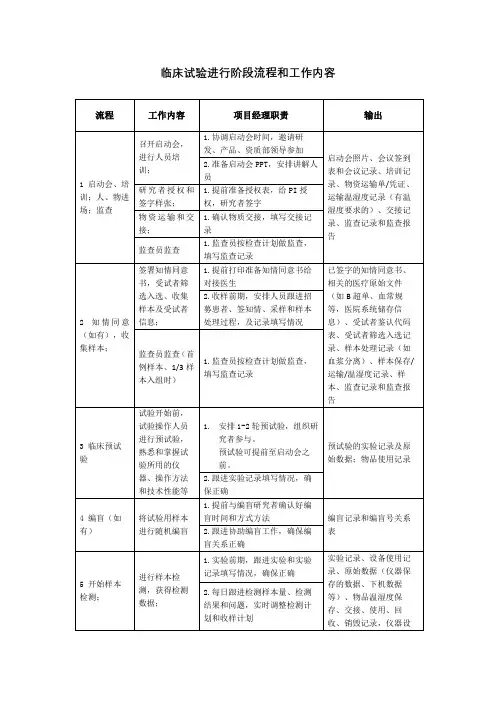

药物临床试验启动会确认表项目启动前准备工作:1.是否有临床试验批件且在有效期内:□是,口否2.临床试验合同和CrC协议是否已经签署完成:口是,□否3.项目首款是否己汇至医院指定账户:口是,口否4.是否己提交遗传办批件/公示:□是,口否,口不适用4.1EDC单位名称:,EDC单位资质是否提交机构:口是,口否是否为外资:口是,□否4.2行政审批类型:采集口保藏□国合审批口出境口国合备案口信息对外提供和开放使用备案口其他:______________________5.是否己将本中心在药物临床试验登记与信息公示平台登记:口是,登记号;口否,□不适用6.是否己提供启动会PPT:口是,口否7.是否己提供CRC/CRA委派函:□是,□否8.CRC是否己通过机构面试:口是,□否9.项目记录表(如评分表)是否已加盖机构受控章:口是,口否10.是否所有检验检查项目都能在本院开展:口是,□否,口不适用,其他:I1P1是否已确认团队分工,并提前告知对应人员:口是,口否12.其他: ______________________________________________________________________项目实施流程评估:1.试验药物管理:保存在GCP药房口科室GCP专用药柜□(请说明理由:)1.1试验用药物已按要求运送至中心,且保存了运输途中温湿度记录,运输温度计的校准证明,经清点无误后入库:□是,口否,口不适用,其他:1.2药物发放、回收记录表、温湿度记录表(如有)、处方模版、库存登记表、药检报告或相关说明是否齐全:口是,□否,口不适用,其他:1.3是否需要在静配中心统一配置再运送到科室:是口,否口1.4是否有符合要求的转运箱:口是,口否,口不适用1.5转运箱是否有可导出的温度记录:口是,□否,口不适用1.6是否要将药盒或者空瓶回收至中心药房:口是,□否1.7试验药物的处置记录表:口是,口否1.8剩余药物/药瓶是否授权本中心销毁:口是(请提供委托销毁的说明),□否2.试验物资提供2.1是否提供物资交接记录表:口是,口否2.2所提供的的物资有无相关校准证明或者合格证:□有,口无,口不适用3.生物样本管理:口是,□否3.1样本是否需运送至第三方实验室检测:口是,□否(1)科室是否满足生物样本处理及储存的要求:□是,口否(2)外送样本的类型:口血样,口组织,口其他(3)外送样本的检测内容:□PK,□ADA,口凝血功能,口其他(4)是否提供了第三方实验室资质:口是,口否(5)是否提供了样本管理手册:口是,□否(6)是否提供了样本采集、处理、保存、运送记录表:口是,□否(7)是否提供冰箱/柜温度记录表:口是,口否3.2样本是否需要由本院委托送至外院检测:口是,□否(1)是否已签署三方委托协议:□是,口否4.试验记录4.1科室能否独立记录病程并打印病历:口是,□否4.2知情同意过程、病程记录模板是否经机构确认:口是,口否4.3知情同意过程记录形式:口门诊电子病历口住院病程记录□纸质门诊病历□其他_4.4是否针对疗效指标的判定标准(如评分量表)等对研究者进行了重点培训授权:口是,口否4.5是否针对疗效指标的判定(如拍照、评分)提供操作规程,明确并收集评估者资质:□是,口否4.6是否提供生活质量等评分量表等并单独打印并受控:口是,口否5.试验开展流程其他相关问题及回复是否同意开展:是口,否口如否,建议:______________________________________________________________签字:日期:备注:1、试验药物请于启动会当天或启动会后及时运送药物至机构药房;2、质控频率:入组第1例,入组1/2,入组结束。

项目启动的标准操作规程
一、目的
参加临床研究项目会议的标准操作规程,熟悉试验内容和注意点,提出机构质量管理要求。
确保临床试验项目实施的规范性。
二、范围
所有计划在本机构进行的临床试验项目的启动会议。
三、内容
1.本院伦理委员会已批准开展该项临床试验,伦理委员会批件已递交机构办公室存档。
2.完成签订的临床试验合同已递交机构办公室存档。
3.申办方或CRO已按临床试验合同约定支付临床试验启动经费。
4.国家人类遗传办批件或备案证明已递交机构办公室存档(仅限外资/合资背景的申办方发起的临床研究)。
5.申办方已与机构完成试验用药品的交接。
6.首例受试者签署知情同意书之前应召开项目启动会。
7.机构办人员出席参加项目启动会,出席会议人员包括但不仅限于机构办主任、机构秘书、机构质量管理员、药品管理员;
8.机构办人员在培训结束后提出机构质量管理要求,要求研究者在研究期间遵守GCP原则,承担相应的责任;确保严格按照试验方案进行;熟知机构试验药品管理流程;确保受试者在试验前签署知情同意书;严格筛选、入选受试者;试验过程的质控;试验期间积极配合监查、稽查、检查工作;
9.要求申办方在会后10个工作日内将会议记录及会议相关资料提交
机构存档。


药物临床试验临床会议标准操作规程Ⅰ.目的:建立临床试验临床会议管理制度,实现会议组织、召开标准化管理。
Ⅱ.范围:适用所有临床试验特别强调:1、所有未参加会议的人员劳务费,一律不允许委托其他人带,待下次项目负责人亲自送给本人手里。
2、凡北京召开的会议,从北京站到会场的,一律安排车接,从机场往返的,原则上不接送,特别重要的人物或参会人员本人特别要求接送的再另行安排。
Ⅲ.规程:1. 在会议召开前两周以前提交会议申请表,注明召开会议原因,会议涉及内容、拟定召开时间,常规会议直接由部门负责人审核安排,非常规会议需部门负责人审批后提交公司审批。
2. 会议召开目的:2.1讨论和确定临床试验方案、研究病历等试验文件,就方案、研究病历的设计、执行等相关问题统一认识,以更好地保证临床试验的同步性和一致性;2.2加强各研究单位机构、科室人员之间,申办者、CRO与研究单位、统计学家之间的多方交流及了解,以便保证各研究单位对于临床试验的有力开展以及对于监查工作的积极配合与帮助,从而确保临床试验的顺利实施。
3. 会议筹备阶段:细致周详的会议筹备是会议召开成功与否的关键,筹备药物临床启动会,包括以下内容:3.1沟通在会议召开前一周以前完成以下沟通:就方案中的重点问题与组长单位(临床PI及机构项目负责人)、各参加单位的PI、统计单位、申办单位、研发者、CDE审评人员及特邀专家尽早进行充分沟通,以尽早协商解决或提前咨询相关专家,以促进会议预期目标的一致性;●如果是组长单位设计的方案,其中相关统计内容必须由统计学家认可,并将所提意见或建议反馈组长单位认可修改;●与各研究单位的有效沟通须贯穿于启动会议的全过程,尤其注意预先与组长单位PI和机构项目负责人确定会议流程,会议主持人。
会议流程中必须包括申办单位领导发言安排,需要发言人员必须提前通知发言人做好发言准备。
●与各研究单位及申办方会前按照会议议程确认各单位在会中的职责,提前做准备工作,如PI组织会议的会议流程、各环节需要控制的时间,如果要求进行临床前介绍,提前确定介绍的人员以及介绍的内容和控制时间等。

药物临床试验项目启动会的标准操作规程
目的
用于药物临床试验前商定试验的具体事宜,并对相关研究人员进行培训。
适用范围
适用于本机构所有药物临床试验项目。
操作规程
1.临床试验项目协议签订后,筛选入组受试者前,必须在科室召开试验启动会。
2.启动会的具体时间和地点由项目PI、机构办公室和申办方商议决定。
3.参加会议的人员包括科室研究团队成员(主要研究者、参与试验的临床医生、护士、药物管理员、资料管理员、质量管理员、CRC)、机构办公室人员、相关辅助科室人员、申办方负责人、监查员等。
4.会议内容包括项目方案、项目实施SOP和GCP的培训,研究小组人员的分工。
5.由申办方人员或研究机构试验负责人介绍研究方案、试验流程、试验注意事项、试验总进度、药物的管理、病例报告表的填写、不良事件的记录等。
6.机构办公室人员负责对项目在院内实施的具体流程进行梳理,检查试验中将产生的各类表格设计是否完整、合理,使项目的SOP与
机构管理的SOP进行很好的对接,从源头上保证项目研究质量。
临床试验启动会前基本流程嘿,朋友们!咱今天就来讲讲临床试验启动会前的那些基本流程。
这可真是个重要的事儿啊,就好比要建一座大楼,得先把根基打好不是?咱先来说说准备工作吧,这就像做饭前得先把食材准备齐全呀。
要把相关的文件啊、资料啊都整理得妥妥当当的。
你想想,要是到时候缺这少那的,那不就乱套啦?就像做菜做到一半发现没盐了,那多尴尬呀!然后呢,就是研究者的培训啦。
这可太关键啦!研究者们得对试验方案、流程啥的都清清楚楚,明明白白的,不然怎么能保证试验顺利进行呢?这就好比是战士上战场前,得把战术都摸透了呀,不然怎么打胜仗呢?接着就是伦理审查啦,这可是为了保障参与者的权益和安全呢。
伦理委员会得好好把关,就像个严格的守门员,不能让任何不合适的东西溜进来。
要是伦理这关过不了,那后面的事儿可就没法开展啦,这可不是闹着玩的!还有啊,试验物资的准备也不能马虎。
药品啦、器械啦,都得准备到位。
这就像是汽车要跑长途,油得加满,零件都得没问题呀。
要是物资没准备好,那不就跟汽车没油了一样,跑不起来啦!再说说知情同意书吧,这可是要让参与者清楚地知道他们要参与的是什么,有啥风险和好处。
这就像给人一张地图,让人知道自己要走的路是咋样的,能不能走得安心。
要是没把这事儿做好,那不是坑人嘛!最后,启动会前的沟通协调也很重要呀。
各方人员都得通气,不能各干各的呀。
这就像一场音乐会,大家得配合好,才能奏出美妙的乐章。
总之啊,临床试验启动会前的这些基本流程,一个都不能少,一个都不能马虎。
只有把这些都做好了,临床试验才能顺顺利利地开展呀。
大家说是不是这个理儿呢?咱可不能在这些关键地方掉链子呀!。
临床试验启动会前的基本流程
嘿,咱来说说临床试验启动会前的那些事儿哈!这就好比一场大戏要开场啦,可得把方方面面都准备得妥妥当当的。
你想啊,临床试验可不是闹着玩儿的,那关系到好多人的健康呢!那启动会前都要干啥呢?首先得把研究方案整明白呀,就像出门得知道往哪儿走一样,这方案就是咱的路线图。
得仔细研究,每个细节都不能放过,这要是弄错了,那不就像在大雾里瞎转悠嘛!
然后呢,伦理审查可不能少。
这就好比给咱这个试验盖上一个“合格章”,要是伦理这关过不了,那可不行呀!得确保咱这个试验不会伤害到参与者,得对他们负责呀,这可是大事儿!
还有人员的培训也很重要哦!研究者们得清楚知道自己要干啥,怎么做。
就跟士兵上战场前得知道怎么打仗一样,不能稀里糊涂的呀!要是研究者都不明白,那还怎么搞试验呢?
再说说试验物资的准备吧。
这就像做饭得有食材一样,啥都没有怎么干活呀?药品啦、器械啦,都得准备齐全,而且质量得有保证,可不能弄些不靠谱的东西来。
招募受试者也是个关键环节呢!得找到合适的人来参加试验,这可不是随便拉几个人就行的。
得好好宣传,让人家了解这个试验,还得让人家愿意来。
这就跟找朋友似的,得看对眼了才行呀!
场地的准备也不能马虎。
得有个舒适、安全的环境让大家工作和参与试验,总不能在一个乱糟糟的地方搞吧?那多影响心情和效率呀!
临床试验启动会前的这些基本流程,每个都很重要,就像一个链条上的各个环节,一个都不能松呀!要是有一个环节出了问题,那可能整个试验都得受影响呢!咱可不能掉以轻心,得认真对待每一个步骤。
只有这样,才能让临床试验顺利进行,为医学的进步做出贡献呀!大家说是不是这个理儿呢?。
临床试验启动流程
一、启动会召开条件
1)伦理委员会批件:书面审查意见为同意
2)临床试验合同:签署完成
3)人类遗传资源批件(如适用):已获得批准
4)药物临床试验登记与信息公示平台(如适用):需打印登记信息,并存档于研究者文件夹。
5)临床试验申请相关通知或提醒(如适用):若执行《国家药品监督管理局关于调整药物临床试验审评审批程序的公告(2018年第50号)》,需在受理缴费后60日(以工作日计算)后通过药审中心门户网站下载临床试验申请相关通知或提醒,递交伦理委员会备案并存档于研究者文件夹。
6)医疗器械省局备案函(如适用):已递交伦理委员会备案
具备以上文件,申办方/受委托的CRO方可与研究者协商召开启动会的日期。
二、申办方/受委托的CRO与研究者确定启动会召开时间后,需告知药物临床试验机构办公室。
三、启动会时,机构办公室相关人员参加启动会。
四、机构办公室质量控制员对试验用相关表格进行质量控制、对试验流程进行梳理,并出具《质量活动记录表》。
GCP中心药房药品管理人员讲解试验用药物接收、发放、回收及退回流程。
五、申办方/受委托的CRO与研究者针对启动会上发现的问题,回复并解决后,提交《质量活动记录表》至机构办公室,所有问题解决后方可正式筛选受试者。
临床试验总结会的议程临床试验总结会议程一、会议开场1. 主持人致辞:欢迎与会嘉宾,介绍会议目的和议程安排。
二、临床试验背景介绍1. 临床试验概述:定义、目的、重要性。
2. 临床试验的分类:按照研究目的、设计类型、试验阶段等分类介绍。
三、试验设计与方案1. 研究问题和目标:阐述试验的科学问题和研究目标。
2. 试验设计:介绍采用的试验设计类型,如随机对照试验、开放试验等。
3. 试验方案:详细描述试验的研究设计、入选标准、分组方法、干预措施等。
四、试验方法与实施1. 受试者招募与入组:说明招募渠道、入选标准和过程。
2. 干预措施与操作:描述试验组和对照组的干预措施和操作过程。
3. 数据收集和监测:介绍试验数据的收集方法、监测措施以及质量控制。
4. 试验时间安排:说明试验的时间周期和各阶段的任务安排。
五、数据分析与结果1. 数据清理与处理:阐述试验数据的清理和处理方法。
2. 数据分析方法:介绍试验数据分析所采用的统计方法和软件工具。
3. 实验结果呈现:展示试验结果的主要指标、图表和统计数据。
六、讨论与结论1. 结果解读与分析:对试验结果进行解读、分析和讨论。
2. 结论与启示:总结试验结果,得出科学结论,并提出临床意义和启示。
七、试验局限与展望1. 试验局限性:分析试验设计、方法、样本等方面的局限性。
2. 下一步工作:对试验结果的应用和未来研究的建议。
八、经验分享与问题解答1. 临床试验经验分享:邀请相关专家分享临床试验的经验和教训。
2. 问题解答环节:回答与会人员提出的问题,解决疑惑。
九、会议总结与闭幕1. 主持人总结发言:对会议内容进行概括和总结。
2. 会议闭幕:感谢与会嘉宾的参与,宣布会议结束。
以上是本次临床试验总结会议程的基本内容,希望能够使与会人员对临床试验的背景、设计、实施、数据分析和结论等方面有一个全面的了解,促进临床试验的科学性和规范性。
同时,通过经验分享和问题解答环节,进一步提高与会人员的专业能力和解决问题的能力,为未来的临床试验研究提供参考和指导。