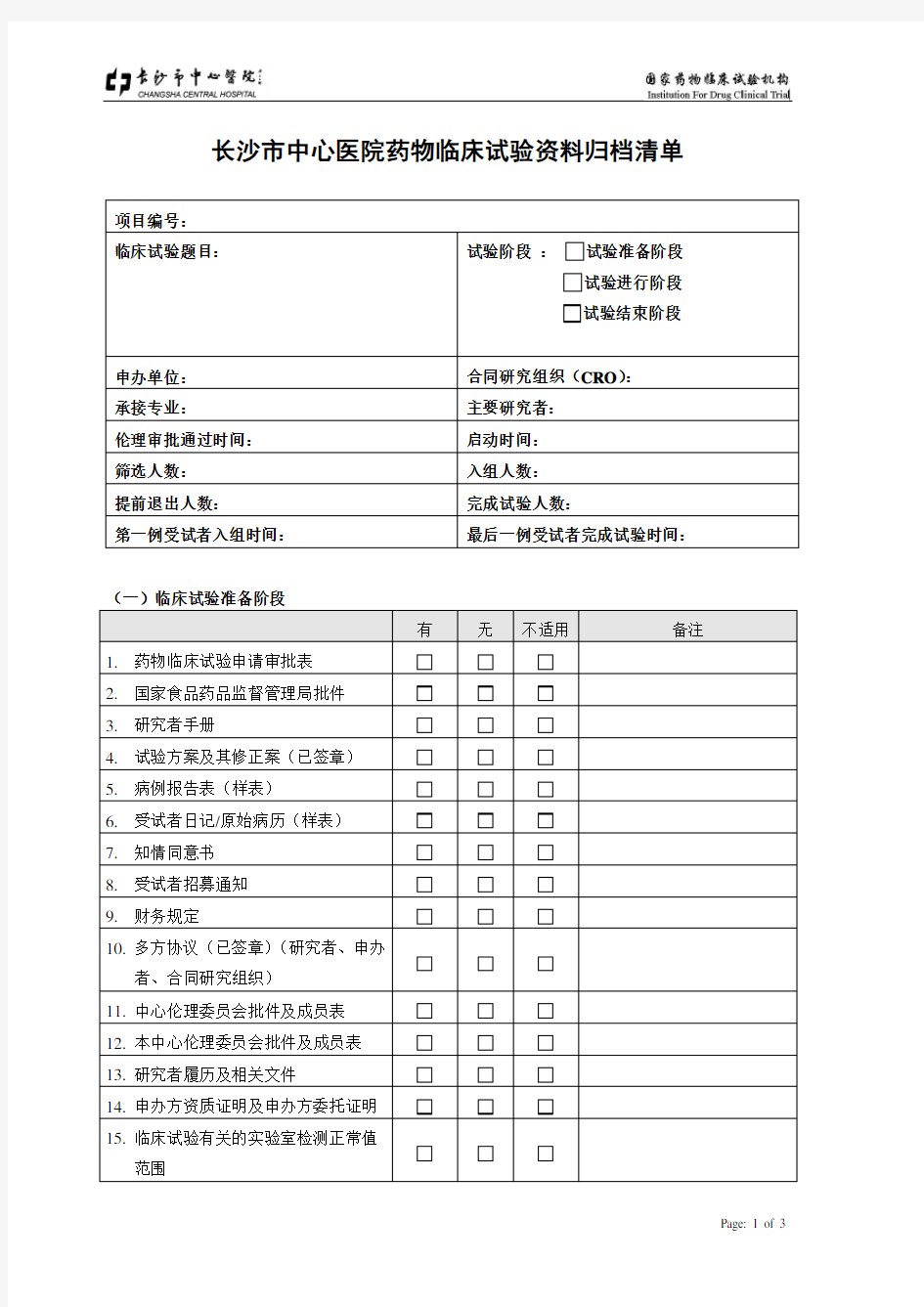

长沙市中心医院药物临床试验资料归档清单
项目编号:
临床试验题目:试验阶段:试验准备阶段
试验进行阶段
试验结束阶段
申办单位:合同研究组织(CRO):
承接专业:主要研究者:
伦理审批通过时间:启动时间:
筛选人数:入组人数:
提前退出人数:完成试验人数:
第一例受试者入组时间:最后一例受试者完成试验时间:
(一)临床试验准备阶段
有无不适用备注
1.药物临床试验申请审批表
2.国家食品药品监督管理局批件
3.研究者手册
4.试验方案及其修正案(已签章)
5.病例报告表(样表)
6.受试者日记/原始病历(样表)
7.知情同意书
8.受试者招募通知
9.财务规定
10.多方协议(已签章)(研究者、申办
者、合同研究组织)
11.中心伦理委员会批件及成员表
12.本中心伦理委员会批件及成员表
13.研究者履历及相关文件
14.申办方资质证明及申办方委托证明
15.临床试验有关的实验室检测正常值
范围
16.医学或实验室操作的质控证明
17.试验用药品与试验相关物资的运货
单(供应交接单、快递单、试验药
物接收记录表)
18.试验药物的药检证明
19.任务授权记录(任务分工记录及研
究者签名样张)
20.研究者培训记录
21.湖南省食品药品监督管理局备案表
(二)临床试验进行阶段
有无不适用备注
22.研究者手册更新件
23.其他文件(方案、病例报告表、知
情同意书、书面情况通知)的更新
24.新研究者的履历
25.医学、实验室检查的正常值范围更
新
26.试验用药品与试验相关物资的运货
单(供应交接单、快递单、试验药
物接收记录表)
27.新批号试验药物的药检证明
28.监查员访视报告
29.已签章的知情同意书份
30.原始医疗文件份
31.病例报告表(已填写,签章,注明
份日期)
32.研究者致申办者的严重不良事件报
告(原件)
33.申办者致药品监督管理局、伦理委
员会的严重不良事件报告
34.中期或年度报告
35.受试者筛选、入选表
36.受试者鉴认代码表(原件)
37.受试者退出表
38.试验药物库存表
39.试验用药品发放、回收记录表
40.试验药物归还表(剩余试验药物退
回记录及相关快递单)
41.方案违反记录表
42.试验药物保存温度记录表
43.生物样本保存温度记录表
44.生物样本运送记录
有无不适用备注
45.试验药物销毁证明
46.完成试验受试者编码目录
47.稽查证明件
48.最终监查报告
49.治疗分配与破盲证明
50.受试者补偿费用发放记录
51.试验完成报告(致伦理委员会国家
食品药品监督管理局)
52.研究分中心报告
53.总结报告
54.其他资料
资料补充说明:
签名:日期:
主要研究者签名:日期:
研究者签名:日期:
机构审核接收者签名:日期: