必修二1.1 元素周期表课件(第4课时)
- 格式:ppt
- 大小:573.00 KB
- 文档页数:11




核素同位素1.了解质量数的定义。
2.了解原子的表示方法。
3.了解核素和同位素的概念。
4.能识别不同概念间的相互关系。
要点一 原子的组成 1.原子的构成。
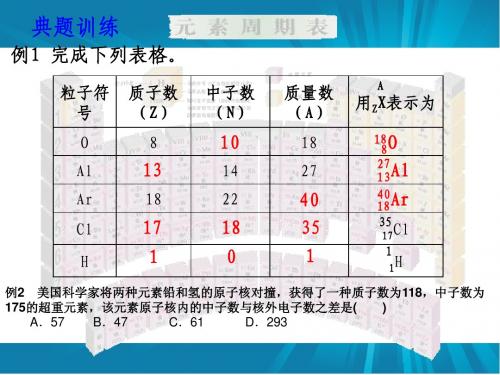
原子(AZ X)⎩⎪⎨⎪⎧原子核⎩⎪⎨⎪⎧质子(带正电)中子(不带电)核外电子(带负电)2.数值关系。
(1)质量数:忽略电子的质量,将核内所有质子和中子的相对质量取近似整数值相加所得的数值。
(2)数值关系。
质量关系:质量数(A )=质子数(Z)+中子数(N)。
数量关系:原子序数=核电荷数=质子数=核外电子数。
3.表示方法。
AZ X 中X 表示某元素的原子,Z 表示质子数,A 表示质量数。
核素、同位素 1.核素。
把具有一定数目的质子和一定数目的中子的一种原子叫做核素。
2.同位素。
(1)定义。
质子数相同而中子数不同的同一元素的不同原子互称为同位素,即同一元素的不同核素互称为同位素。
(2)特点。
天然存在的同位素,相互间保持一定的比率。
(3)核素与元素之间的关系:有的元素有多种核素,有的元素只有一种核素,所以元素分单核素元素和多核素元素。
(4)同位素的用途。
同位素在日常生活、工农业生产和科学研究中有着重要的用途。
如:①146C在考古工作中用于测定一些文物的年代;②23592U用于制造原子弹、核电站发电;③21H、31H用于制造氢弹;④放射性同位素释放的射线可用于育种、治疗癌症和肿瘤等。
【应用思考】1.所有原子的原子核都有质子和中子吗?提示:不一定。
原子核中一定含质子,但不一定有中子,如11H中只有质子而没有中子。
2.质子数相同而中子数不同的微粒一定互为同位素吗?提示:不一定。
例如:OH-与F-,它们质子数均为9,核外电子数均为10,但不能说它们互为同位素,因为它们不是同一种元素构成的。
3.结合核外电子排布讨论:互称同位素的不同核素为什么具有几乎完全相同的化学性质?提示:同种元素的不同核素核内质子数相同,具有完全相同的核外电子排布,因此化学性质几乎完全相同。