高中化学教材实验总结.ppt
- 格式:ppt
- 大小:365.00 KB
- 文档页数:24

高中化学所有课本实验总结_图文化学实验(必修1)一、化学实验基本方法1.粗盐提纯(实验1-1、1-2)食盐主要来源于__________、___________、___________。
粗盐中含杂质主要分为两类,第一是不溶性杂质,如_________;第二是_________,如___________________。
除去不溶性杂质,主要步骤是:(1)_____________,方法是______________________________________________。
(2)_____________,方法是______________________________________________。
(3)_____________,方法是______________________________________________。
除去有Ca2+、Mg2+、SO42-等可溶性杂质的操作中,除确定药品外,还要考虑所加试剂的________________、试剂用量,以及__________如何处理。
所涉及的方案不能引入_______________。
根据这些原则,你所确定的提纯食盐所用试剂依次是______、_________、__________。
检验食盐中是否有硫酸根离子的检验方法是_________________________________。
(2)蒸发2、以自来水为原料制备蒸馏水(实验1-3)本实验所用到的玻璃仪器主要有(1)__________,(2)__________,(3)__________,(4)__________,(5)__________,(6)__________。
如何证明这一操作确实将自来水中的Cl-出去了_____________________________。
3、碘水中碘单质的提取(实验1-4)实验中所用主要仪器是分液漏斗,接收器一般可用____________。




高中化学必修一实验超细总结1.镁条在空气中燃烧:发出耀眼强光,放出大量的热,生成白烟同时生成一种白色物质。
2.木炭在氧气中燃烧:发出白光,放出热量。
3.硫在氧气中燃烧:发出明亮的蓝紫色火焰,放出热量,生成一种有刺激性气味的气体。
4.铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出热量,生成黑色固体物质。
5.加热试管中碳酸氢铵:有刺激性气味气体生成,试管上有液滴生成。
6.氢气在空气中燃烧:火焰呈现淡蓝色。
7.氢气在氯气中燃烧:发出苍白色火焰,产生大量的热。
8.在试管中用氢气还原氧化铜:黑色氧化铜变为红色物质,试管口有液滴生成。
9.用木炭粉还原氧化铜粉末,使生成气体通入澄清石灰水,黑色氧化铜变为有光泽的金属颗粒,石灰水变浑浊。
10.一氧化碳在空气中燃烧:发出蓝色的火焰,放出热量。
11. 向盛有少量碳酸钾固体的试管中滴加盐酸:有气体生成。
12.加热试管中的硫酸铜晶体:蓝色晶体逐渐变为白色粉末,且试管口有液滴生成。
13.钠在氯气中燃烧:剧烈燃烧,生成白色固体。
14.点燃纯净的氯气,用干冷烧杯罩在火焰上:发出淡蓝色火焰,烧杯内壁有液滴生成。
15.向含有C1-的溶液中滴加用硝酸酸化的硝酸银溶液,有白色沉淀生成。
16.向含有SO42-的溶液中滴加用硝酸酸化的氯化钡溶液,有白色沉淀生成。
17.一带锈铁钉投入盛稀硫酸的试管中并加热:铁锈逐渐溶解,溶液呈浅黄色,并有气体生成。
18.在硫酸铜溶液中滴加氢氧化钠溶液:有蓝色絮状沉淀生成。
19.将Cl2通入无色KI溶液中,溶液中有褐色的物质产生。
20.在三氯化铁溶液中滴加氢氧化钠溶液:有红褐色沉淀生成。
21.盛有生石灰的试管里加少量水:反应剧烈,发出大量热。
22.将一洁净铁钉浸入硫酸铜溶液中:铁钉表面有红色物质附着,溶液颜色逐渐变浅。
23.将铜片插入硝酸汞溶液中:铜片表面有银白色物质附着。
24.向盛有石灰水的试管里,注入浓的碳酸钠溶液:有白色沉淀生成。
25.细铜丝在氯气中燃烧后加入水:有棕色的烟生成,加水后生成绿色的溶液。

高中化学实验总结 Revised at 2 pm on December 25, 2020.高中化学1实验总结实验一【实验名称】粗盐的提纯【实验目的】1.掌握、、等实验的操作技能。
2.理解过滤法分离混合物的化学原理。
3.体会过滤的原理在生活生产等社会实际中的应用。
【实验原理】粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如:Ca2+,Mg2+,SO42-,K+等。
不溶性杂质可以用溶解过滤的方法除去,可溶性杂质中的Ca2+,Mg2+,SO42-则可通过加入BaCl2、NaOH和饱和Na2CO3溶液,生成沉淀而除去,也可加入固体和NaOH溶液来除去。
然后蒸发水分得到较纯净的精盐。
BaCO3【药品和仪器】粗盐、烧杯、玻璃棒、漏斗、铁架台、滤纸、蒸发皿、三脚架、酒精灯、石棉网、试管、滴管【实验步骤及记录】1.溶解:称取4g粗盐加到盛有12mL水的烧杯中,边加边用玻璃棒搅拌,直至粗盐不再溶解为止。
固体食盐逐渐溶解而减少,食盐水略带浑浊。
2.过滤:将烧杯中的液体沿着玻璃棒倒入过滤器中,过滤器中的液面不要超过滤纸边缘,若滤液浑浊,再过滤一次不溶物留在滤纸上,液体渗过滤纸,沿漏斗颈流入另一个烧杯中3.蒸发:将滤液倒入蒸发皿中,然后用酒精灯加热,同时用玻璃棒不断搅拌溶液,待出现较多固体时停止加热。
水分蒸发,逐渐析出固体粗盐中除含有不溶于水的泥沙等杂质外,还含有可溶性的CaCl2、MgCl2及一些硫酸盐,这些杂质也被溶解,且过滤时进入滤液。
检验这些离子存在的方法,可从分析它们盐在水中的溶解性得出。
大多数硫酸盐都溶于水,而硫酸钡不溶于水,所以可用BaCl2溶液来检验硫酸盐。
但钡盐除BaSO4外,还有BaCO3等,BaSO4不溶于稀盐酸,BaCO3等溶于稀盐酸。
所以,检验硫酸盐时应先加入稀盐酸,再加入BaCl2溶液,若产生的沉淀不溶于稀盐酸,则存在硫酸盐。
同理,可用Na2CO3溶液检验CaCl2,用NaOH溶液检验MgCl2。

实验一:粗盐提纯一、实验仪器与用品仪器:烧杯、玻璃棒、蒸发皿、酒精灯、漏斗、药匙、量筒(10mL)、铁架台(带铁圈)、滤纸、火柴、托盘天平(带砝码)用品:粗盐,蒸馏水二、实验步骤①溶解:用量筒量取约10mL水倒入烧杯中。
用托盘天平称量越4g。
将称取烦人粗盐逐渐加入水中,并用玻璃棒不断搅拌,直至粗盐不再溶解为止现象:固体Nacl逐渐溶解而减少,食盐水略显浑浊②过滤:用滤纸和漏斗制作一个过滤器。
将烧杯中的液体沿玻璃棒倒入过滤器中(引流),进行过滤,若滤液仍浑浊,应再过滤一次。
现象:不溶物残留在滤纸上,液体透过滤纸到入烧杯中③蒸发:把得到的澄清滤液导入蒸发皿中。
把蒸发皿放在铁架台的铁圈上,用酒精灯加热,同时用玻璃杯不断搅拌滤液。
等到蒸发皿中出现较多的固体时,停止加热,利用蒸发皿的余热使滤液蒸干。
现象:水分蒸发,逐渐出现固体三.注意事项滤纸与漏斗的使用:一贴二低三靠“一贴”是指滤纸折叠角度要与漏斗内壁口径吻合,使湿润的滤纸紧贴漏斗内壁而无气泡,因为如果有气泡会影响过滤速度.“二低”是指滤纸的边缘要稍低于漏斗的边缘,二是在整个过滤过程中还要始终注意到滤液的液面要低于滤纸的边缘。
这样可以防止杂质未经过滤而直接流到烧杯中,这样未经过滤的液体与滤液混在一起,而使滤液浑浊,没有达到过滤的目的。
“三靠”一是指待过滤的液体倒入漏斗中时,盛有待过滤液体的烧杯的烧杯嘴要靠在倾斜的玻璃棒上(玻璃棒引流),防止液体飞溅和带过滤液体冲破滤纸;二是指玻璃棒下端要轻靠在三层滤纸处以防碰破滤纸(三层滤纸一边比一层滤纸那边厚,三层滤纸那边不易被弄破);三是指漏斗的颈部要紧靠接收滤液的接受器的内壁,以防液体溅出实验二:制作蒸馏水一、实验仪器仪器:酒精灯、石棉网、蒸馏烧瓶、冷凝管、牛角管、锥形瓶、铁架台(带铁圈)其他:火柴、自来水、碎瓷片、温度计二、注意事项加入碎瓷片可防止液体暴沸而冲进导管。
导管要适当长些兼作冷凝管用。
试管中液体不能太多,以防沸腾时沿导管流入接收器中。
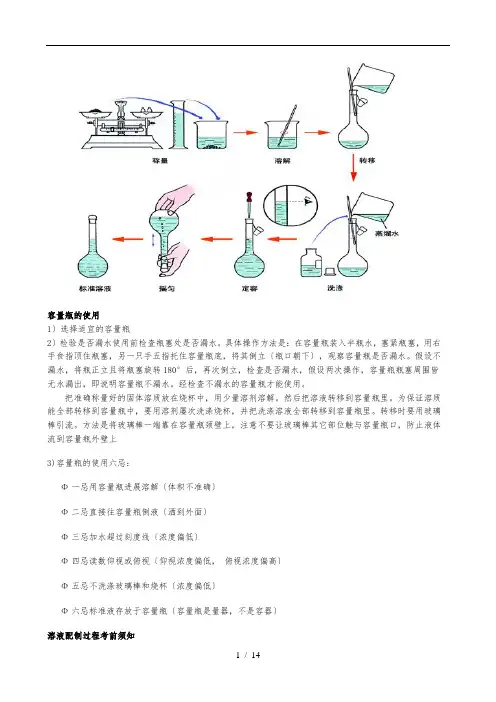
容量瓶的使用1〕选择适宜的容量瓶___2〕检验是否漏水使用前检查瓶塞处是否漏水。
具体操作方法是:在容量瓶装入半瓶水,塞紧瓶塞,用右手食指顶住瓶塞,另一只手五指托住容量瓶底,将其倒立〔瓶口朝下〕,观察容量瓶是否漏水。
假设不漏水,将瓶正立且将瓶塞旋转180°后,再次倒立,检查是否漏水,假设两次操作,容量瓶瓶塞周围皆无水漏出,即说明容量瓶不漏水。
经检查不漏水的容量瓶才能使用。
把准确称量好的固体溶质放在烧杯中,用少量溶剂溶解。
然后把溶液转移到容量瓶里。
为保证溶质能全部转移到容量瓶中,要用溶剂屡次洗涤烧杯,并把洗涤溶液全部转移到容量瓶里。
转移时要用玻璃棒引流。
方法是将玻璃棒一端靠在容量瓶颈壁上,注意不要让玻璃棒其它部位触与容量瓶口,防止液体流到容量瓶外壁上3)容量瓶的使用六忌:___Φ一忌用容量瓶进展溶解〔体积不准确〕___Φ二忌直接往容量瓶倒液〔洒到外面〕___Φ三忌加水超过刻度线〔浓度偏低〕___Φ四忌读数仰视或俯视〔仰视浓度偏低,俯视浓度偏高〕_Φ五忌不洗涤玻璃棒和烧杯〔浓度偏低〕___Φ六忌标准液存放于容量瓶〔容量瓶是量器,不是容器〕溶液配制过程考前须知1 / 14___1〕用量筒取液体试剂时,洗量筒的液体不能再倒入烧杯中___2〕烧杯与玻璃棒的洗涤液要倒入容量瓶___3〕在液面接近容量瓶的刻度线1~2cm时,应改用胶头滴管___4〕读数时,视线应与溶液的凹液面恰好相切__5〕容量瓶是配制溶液的容器,不是装试剂用的___6〕假设用浓硫酸配制稀硫酸时,一定要注意将浓硫酸慢慢用玻璃棒引流到水中。
切不可相反操作!使用容量瓶时应注意以下几点:(1)容量瓶的容积是特定的,刻度不连续,所以一种型号的容量瓶只能配制同一体积的溶液。
在配制溶液前,先要弄清楚需要配制的溶液的体积,然后再选用一样规格的容量瓶。
(2)易溶解且不发热的物质可直接用漏斗到入容量瓶中溶解,其他物质根本不能在容量瓶里进展溶质的溶解,应将溶质在烧杯中溶解后转移到容量瓶里。