分析化学中各种溶液配制与标定
- 格式:doc
- 大小:44.00 KB
- 文档页数:4


实验四盐酸标准溶液的配制与标定一、实验目的与要求1.学会配制、标定盐酸标准溶液;2.学习酸碱指示剂的使用原理,指示剂选择的原则,了解混合指示剂的作用;3.巩固减量法称量,学习滴定操作,滴定终点的判断;4.学习数据处理的有关知识,有效数字的概念及应用。
二、基本操作1.差减称量法2.酸式滴定管的使用;三、思考与检查1.0.1mol·L-1盐酸标准溶液的浓度为什么要标定,而不能准确配制;2. 在标定过程中,HCl与Na2CO3发生了哪些反应,有几个化学计量点,计量点的pH各是多少?3.如何计算盐酸使用量?如何计算分析结果?(1)配制0.1mol/L盐酸溶液需要量取浓盐酸多少毫升?如何配制?(2)用基准无水碳酸钠标定盐酸,0.1503g无水碳酸钠耗掉盐酸标准溶液26.50mL。
问:盐酸标准溶液的浓度是多少(mol/L)?4. 差减称量法操作5.酸式滴定管操作操作顺序可能存在的问题从试剂瓶中倒出盐酸时,浓盐酸未全部进入10mL量筒,导致量筒外、桌面上都是酸;配制盐酸标准溶液时,忘了已加多少纯水;忘了读或不记初读数就开始滴定;滴定管中途漏水或转动不灵活;用搪瓷盘端干燥器、表面皿和烧杯到天平室时,将干燥器盖、表面皿打碎;小纸带或纸片拿不住称量瓶盖,瓶盖滑落在烧杯中,或滑落在地打碎;试样洒落在天平内,大理石上;电子天平未关、未登记,干燥器忘在天平室;滴定管滴定完一份试样后,未加盐酸液,又滴定另一份试样;测定结果一份比一份大,或反之,或忽大忽小,精密度差;滴定管初读、终读均记录到0.1mL;S、T值的记录有四位有效数字;用铅笔记录;涂改原始数据,或用橡皮擦、胶带纸粘、修正液盖去原始数据;原始数据未经指导教师批阅。
B.B.B.B.B.B.A. 正确;B. 错误;B.B.B.B.实验四盐酸标准溶液的配制和标定一、目的要求1.掌握减量法准确称取基准物的方法。
2.掌握滴定操作并学会正确判断滴定终点的方法。
3.学会配制和标定盐酸标准溶液的方法。

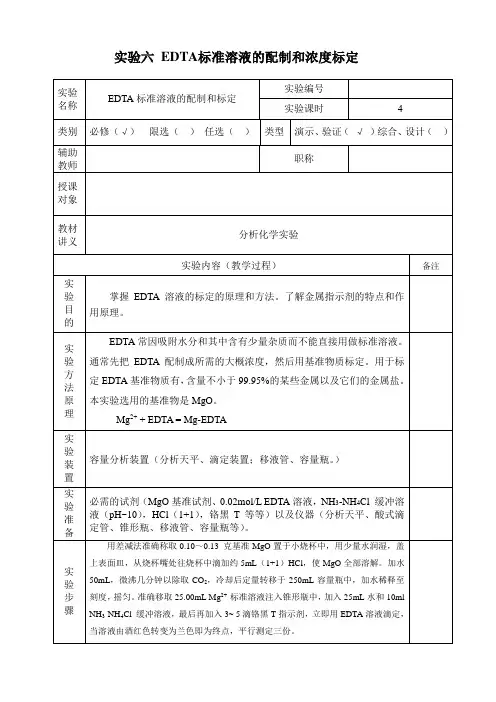
实验六EDTA标准溶液的配制和浓度标定
教学安排
一.请预先认真预习实验5—1的内容和相关资料。
了解实验目的、原理和方法。
二.本实验的目的要求
1.了解EDTA标准溶液的配制和标定原理。
2.掌握常用的标定EDTA方法
为基准物标定EDTA。
3.本次实验采用CaCO
3
三.实验内容
(一)Ca2+标准溶液和EDTA溶液的配制
1.Ca2+标准溶液的配制,提醒学生注意称样(称量值与计算值偏离最好不超过10%)、溶样、定溶的操作。
2. EDTA溶液的配制(m=CVM公式计算),提醒学生注意,使用的水溶解样品应该使用热的蒸馏水。
(二)标定操作
为基准物标定EDTA溶液的浓度。
1.以铬黑T为指示剂,CaCO
3
2. 教师应对学生讲清滴定时是在PH=10的氨性缓冲溶液中进行,如果不加缓冲溶液,对标定结果会有什么影响?
3.加入Mg-EDTA的作用是什么?对滴定结果是否有影响?
4. 注意滴定速度不宜过快,平行滴定三份。
5.实验结束后,教师应对实验室,天平室进行台面,包括窗台,清扫擦洗地面,清洁天平室台面、地面(勿用湿布)检查;检查开关;检查柜门及钥匙;检查门窗是否关好。
最后须经老师允许后方能离开。

实验一高锰酸钾标准溶液的配制与标定一、实验目的1.了解KMnO4标准溶液的配制和保存条件。
2.了解自身指示剂和自动催化的原理。
3. 掌握用草酸钠作基准物标定高锰酸钾浓度的原理、方法及滴定条件。
二、实验原理(一)高锰酸钾标准溶液的配制:间接配制法(原因:高锰酸钾中含有二氧化锰等还原性杂质;高锰酸钾在水溶液中的自动分解;高锰酸钾见光易分解)配制步骤:1.称取稍多于理论计算量的高锰酸钾(如配制0.02mol/L溶液1L则需称取3.3~3.5g);2.用煮沸的冷却的蒸馏水溶解称好的高锰酸钾,以除去水中的还原性物质;3.将配好的高锰酸钾溶液煮沸,保持微沸1小时,然后放置2~3天,使溶液中的各种还原性全部与高锰酸钾反应完全;用微孔玻璃漏斗或古氏磁坩埚将溶液中的沉淀过滤去;配好的高锰酸钾溶液应于棕色瓶中暗处保存。
待标定。
(二)高锰酸钾标准溶液的标定:基准物法--以草酸钠用得最多。
1.标定原理:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O(自身批示剂)反应条件:(1)温度:75~85℃(2)酸度:0.5--1.0mol/LH2SO4(3)滴定速度:与自动催化反应相适应(先慢后快再慢)(4)终点:粉红色稳定30秒(4 KMnO4 + 6 H2SO4= 2K2SO4 + 4MnSO4 + 6H2O + 5O2↑)2.计算224422442(Na C O)10005(KMnO)(Na C O)(KMnO)mcM V创=´三、试剂与仪器仪器:分析化学实验常用仪器、烘干箱、称量瓶、电子天平、干燥器、水浴锅或电炉等;试剂:基准物Na2C2O4、3mol/L H2SO4溶液、KMnO4固体四、实验步骤(一)KMnO4标准溶液配制称取KMnO4固体1.0g于小烧杯中,用水分数次溶解(每次加水30mL溶解,复重操作直到完全溶解)后转移至500mL烧杯中,用水稀释至300mL。
转入棕色试剂瓶中,在暗处静置1~2后,过滤备用。


K2Cr2O7标准溶液的配制与标定一、实验目的掌握间接法配制K2Cr2O7标准溶液的原理、方法及相关计算。
二、实验原理K2Cr2O7是基准试剂,可以采用直接法配制标准溶液,当采用非基准试剂K2Cr2O7时,则必须用间接法配制,即在一定量K2Cr2O7溶液中加入过量KI溶液及硫酸溶液,生成的I2用Na2S2O3标准溶液滴定。
反应为:Cr2O72- +14H+ +6e→2Cr3+ +7H2O以淀粉指示剂确定终点。
三、试剂K2Cr2O7基准试剂烘干至恒重K2Cr2O7固体KI溶液硫酸溶液Na2S2O3标准溶液淀粉指示液( 5g/L)四、实验步骤(1)配制称取2.5g重铬酸钾于小烧杯中,加20mL水,摇动至溶解,转入500mL试剂瓶中。
每次用少量水冲洗烧杯多次,转入试剂瓶中,用水稀释至500mL。
(2)标定用滴定管准确量取30.00—35.00mL重铬酸钾溶液于碘量瓶中,加入2g碘化钾及20mL硫酸溶液,立即盖好瓶塞,摇匀,用水封好瓶口,在暗处静置10min,打开瓶塞,用水洗涤塞子及瓶颈,加150mL水,用硫代硫酸钠标准滴定溶液滴定至溶液呈浅黄色,加3mL淀粉指示液,继续滴定至蓝色消失,出现亮绿色为止。
记录消耗的硫代硫酸钠标准溶液的体积,计算重铬酸钾标准滴定溶液的浓度。
平行测定3次。
实验流程五、数据记录与处理滴定至溶液呈浅黄色色用滴定管准确量取30.00—50.00ml 重铬酸钾溶液续滴定至液由浅黄六、注意事项1.碘量瓶瓶塞的拿法。
2.加入淀粉指示剂的时间。
七、思考题1.什么规格的重铬酸钾能够直接配制重铬酸钾标准滴定溶液?2.间接碘量法中用水封口的目的是什么?于暗处放置10分钟的目的是什么?参考文献:张龙、潘亚芬《化学分析技术》邢文卫、李炜《分析化学实验》。

分析化学四大滴定总结滴定分析法又称为容量分析法,是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。
这其中又有重要的四大滴定方法。
一、酸碱滴定原理:利用酸和碱在水中以质子转移反应为基础的滴定分析方法。
可用于测定酸、碱和两性物质。
其基本反应为H�+OH�=H2O也称中和法,是一种利用酸碱反应进行容量分析的方法。
用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。
最常用的酸标准溶液是盐酸,有时也用硝酸和硫酸。
标定它们的基准物质是碳酸钠Na2CO3。
方法简介:最常用的碱标准溶液是氢氧化钠,有时也用氢氧化钾或氢氧化钡,标定它们的基准物质是邻苯二甲酸氢钾KHC8H4O6或草酸H2C2O・2H2O:OH+HC8H4O6ˉ→C8H4O6ˉ+H2O如果酸、碱不太弱,就可以在水溶液中用酸、碱标准溶液滴定。
离解常数 A和Kb是酸和碱的强度标志。
当酸或碱的浓度为0.1M,而且A或Kb大于10-7时,就可以准确地滴定,一般可准确至0.2%。
多元酸或多元碱是分步离解的,如果相邻的离解常数相差较大,即大于104,就可以进行分步滴定,这种情况下准精确度不高,误差约为1%。
盐酸滴定碳酸钠分两步进行:�ˉCO32-+H→HCO3HCO3ˉ+H�→CO2↑+H2O相应的滴定曲线上有两个等当点,因此可用盐酸来测定混合物中碳酸钠和碳酸氢钠的含量,先以酚酞(最好用甲酚红-百里酚蓝混合指示剂)为指示剂,用盐酸滴定碳酸钠至碳酸氢钠,再加入甲基橙指示剂,继续用盐酸滴定碳酸氢钠为二氧化碳,由前后消耗的盐酸的体积差可计算出碳酸氢钠的含量。
某些有机酸或有机碱太弱,或者它们在水中的溶解度小,因而无法确定终点时,可选择有机溶剂为介质,情况就大为改善。
这就是在非水介质中进行的酸碱滴定。
有的非酸或非碱物质经过适当处理可以转化为酸或碱。
然后也可以用酸碱滴定法测定之。
例如,测定有机物的含氨量时,先用浓硫酸处理有机物,生成NH��,再加浓碱并蒸出NH3,经吸收后就可以用酸碱滴定法测定,这就是克氏定氮法。


标准酸液的配置、标定及碱含量的测定摘要:在滴定实验中,试剂的标定是非常重要的,由于误差的传递性,使得后面的滴定分析的误差相当大。
所以,对配制的标准溶液进行校定是分析化学实验中极为重要的一步。
实验中所用的碱灰由于制法不同,通常含有氯化钠、碳酸氢钠、氢氧化钠、硫酸钠等。
在本实验中,将利用配制好的0.1mol/L盐酸溶液,采取无水碳酸钠为基准物质,甲基橙为指示剂进行滴定,用t检验法对数据进行分析,从而得到配制的盐酸标准溶液浓度。
并将用配制的0.1mol/L盐酸溶液,在甲基橙作指示剂条件下滴定碱灰溶液,测定其碱灰含量。
关键词:标准溶液的标定;甲基橙;大样分析法;t检验法;工业碱灰Configuration and calibration of standard acid and determination of alkalicontentAbstract: in the titration experiment, the calibration of reagents is very important. Because of the transmission of errors, the errors of later titration analysis are quite large. Therefore, the calibration of the standard solution is a very important step in the analytical chemistry experiment. The alkali ash used in the experiment usually contains sodium chloride, sodium bicarbonate, sodium hydroxide, sodium sulfate, etc. In this experiment, 0.1mol/l hydrochloric acid solution is used, anhydrous sodium carbonate is used as the reference material, methyl orange is used as the indicator to titrate, and t-test method is used to analyze the data, so as to obtain the concentration of prepared hydrochloric acid standard solution. The alkali ash solution was titrated with 0.1mol/l hydrochloric acid and methyl orange as indicator to determine the content of alkali ash.Key words: calibration of standard solution; methyl orange;前言本实验是配制并标定浓度约为0.1mol/L的盐酸标准溶液,并用配制的盐酸标液在甲基橙作指示剂条件下滴定工业碱灰,测定其总碱度。

标准溶液标定标准溶液标定是化学分析中常见的实验操作,通过标定可以确定溶液的浓度,为后续的定量分析提供准确的数据支持。
本文将详细介绍标准溶液标定的步骤、方法和注意事项。
一、实验步骤。
1. 准备标定溶液,首先准备好待标定的溶液和标准溶液,根据实际需要选择合适的标定方法和溶液浓度。
2. 称量溶液,使用准确的天平称取待标定溶液,记录下溶液的质量。
3. 转移溶液,将称取好的待标定溶液转移至容量瓶中,用去离子水定容至刻度线,摇匀使溶液均匀混合。
4. 取样分析,取一定体积的标定溶液,进行定量分析,记录下实验数据。
5. 计算浓度,根据实验数据,利用标定计算公式计算待标定溶液的浓度。
二、标定方法。
1. 直接法,直接法是最常用的标定方法,即直接将标定溶液与标准溶液进行滴定,通过滴定终点的观察确定待标定溶液的浓度。
2. 内标法,内标法适用于待标定溶液与标准溶液反应缓慢或滴定终点不明显的情况,通过添加内标物质进行测定,提高准确度和灵敏度。
3. 标准曲线法,标准曲线法适用于需要进行多次标定的情况,通过绘制标准曲线,利用待标定溶液的吸光度与浓度的关系进行测定。
三、注意事项。
1. 实验仪器,使用高精度的量具和仪器,保证实验数据的准确性。
2. 操作规范,操作过程中要注意操作规范,避免操作失误导致实验失败。
3. 滴定终点,观察滴定终点时要注意细心,避免滴定过程中出现误差。
4. 数据记录,实验数据要认真记录,确保数据的真实性和可靠性。
5. 结果计算,在计算浓度时要注意四舍五入,保留合适的有效数字。
通过本文的介绍,相信大家对标准溶液标定有了更深入的了解。
标定溶液的准确浓度是化学分析工作的基础,只有通过严谨的实验操作和精确的数据计算,才能得到可靠的分析结果。
在实际工作中,我们应该根据具体情况选择合适的标定方法,严格按照操作规程进行实验,确保实验结果的准确性和可靠性。
希望本文对大家有所帮助,谢谢阅读!。
案例34 0.1mol/LNaOH溶液配制与标定一、来源本案例来源于粮食收储、烘焙、发酵企业检验员的岗位工作。
XX某玉米淀粉企业检测其淀粉酸值是经常性的工作,需要定期配制和标定0.1mol/LNaOH。
20XX年5月18日化验员李成承担了这一工作。
二、背景标准滴定溶液的配制与标定是许多化学检验项目的基础工作。
过程是否娴熟规范,标定是否准确可靠,直接与检验结果的准确度有关,也直接影响粮油发酵产品质量的判定。
要规范准确地完成配制与标定滴定溶液这项任务,首先就要规范使用称量仪器、滴定仪器,向操作细节要准确度。
其次要有一定的数据处理知识,具备有效数字运算、结果处理能力,能正确记录、整理实验报告。
第三是对有关试剂药品的性质有所了解。
标准滴定溶液的配制与标定是中级粮油检验员的重要工作内容之一。
三、主要仪器设备、材料、药品和试剂(一)仪器设备、材料1. 50ml碱式滴定管,滴定台架。
2. 分析天平或电子分析天平。
3. Φ45高型称量瓶,250ml锥形瓶。
4. 定性滤纸,记录表簿。
5. 聚乙烯试剂瓶。
(二)药品试剂1. 蒸馏水或去离子水。
2. AR级氢氧化钠NaOH。
3. 基准级邻苯二甲酸氢钾KHC8H4O4。
4. 10%酚酞乙醇溶液。
四、测定过程本案例参照GB601-2002化学试剂标准滴定溶液的制备;GB/T5009.1-2003食品卫生检验方法理化部分,总则附录B;有关《分析化学》教材。
(一)操作流程图(二)操作步骤1.实验准备(1)配制:称取110gNaOH,溶于100mL无CO2蒸馏水中,摇匀,注入乙烯容器中,密闭放置至溶液清亮。
此为Na0H饱和溶液。
(2)于105℃~110℃烘箱中干燥基准试剂邻苯二甲酸氢钾至恒重。
(3)分析天平称量准备:检查分析天平,正确进行减量法称量操作。
(4)滴定管准备:检查滴定管质量,清洗,查漏,正确进行滴定操作。
2.溶液配制用塑料管量取NaOH饱和溶液5.4ml上层清夜,用无CO2蒸馏水定容至1000mL,摇匀。
碘标准溶液的配制及标定
一、配制:
碘标准溶液C (I2) = 0.1mol/L
称取13g碘及35g碘化钾,溶于少量水中,然后移入1L棕色试剂瓶中,加水稀释至1L,摇匀。
二、标定:
1、原理:
2Na2S2O3 + I2 → 2NaI + Na2S4O6
2、标定:
准确量取20ml~25ml碘液,加50ml水、30ml 0.1C(HCl)盐酸,摇匀,用0.1 C(Na2S2O3)的Na2S2O3标准溶液滴定近终点(微黄色)时加30ml 0.5%淀粉指示剂,继续滴定至溶液兰色消失为终点。
3、计算:
V1×C1
C =
V
式中:
V1 ―滴定消耗Na2S2O3标准溶液体积,ml;
C1 ―Na2S2O3标准溶液浓度,mol/L;
V―吸取碘液体积,ml。
三、注意事项:
1、碘易挥发,浓度变化较快,保存时应特别注意要密封,并用棕色瓶保存放置暗处。
2、避免碘液与橡皮接触。
3、配制时碘先和碘化钾溶解,溶解完全后再稀释。
4、滴定过程中,振动要轻,以避免碘挥发,但临近终点时要摇动应激烈一点。
5、在良好保存条件下,0.1C (I2)碘液有效期一个月。
6、必要时也可用基准三氧化二砷作基准物标定碘液。
四、方法来源:
本法采用石油部标准SY2002-76中标定碘液时的对照方法。
一、硫酸铁铵标准溶液的配制硫酸铁铵标准溶液是一种常用的化学试剂,用于分析化学实验中的定量分析和质量分析。
其配制方法如下:1.1 安全注意事项在配制硫酸铁铵标准溶液时,应注意个人防护,戴上防护眼镜和手套,避免溶液溅入眼睛或皮肤。
1.2 材料准备配制硫酸铁铵标准溶液需要准备一定浓度的硫酸铁铵固体和一定体积的溶剂(通常为去离子水)。
1.3 操作步骤根据需要的溶液浓度和容量,称取适量的硫酸铁铵固体,然后加入容器中。
在容器中加入适量的去离子水,搅拌均匀溶解硫酸铁铵固体。
用标定的蒸馏水将容器中的溶液加至目标容量,并用盖子盖好,摇匀后,放置数小时使残留物质充分溶解,即可得到硫酸铁铵标准溶液。
1.4 注意事项在溶解硫酸铁铵固体时应搅拌均匀,以免产生不均匀的溶液浓度。
配制好的硫酸铁铵标准溶液应保存在干燥、阴凉的地方,避免受潮和阳光直射。
二、硫酸铁铵标准溶液的标定硫酸铁铵标准溶液是需要经过标定的,具体操作如下:2.1 标定仪器和试剂(1)标定烧杯:使用具有刻度的烧杯,以便准确读取液面高度。
(2)标定溶液:使用已知浓度的硫酸铁铵标准溶液作为标定溶液。
(3)指示剂:使用硫酸铵铁指示剂,用于反应终点的颜色变化指示。
2.2 操作步骤用烧杯量取一定体积的待测硫酸铁铵标准溶液,加入容量瓶中。
加入硫酸铵铁指示剂,并用蒸馏水定容至刻度线。
取一定容量的已知浓度的硫酸亚铁标准溶液,加入烧杯中。
在搅拌的同时缓慢加入硫酸铵铁指示剂,直至出现终点的颜色变化,并记录加入的硫酸亚铁标准溶液体积。
2.3 数据处理根据已知浓度的硫酸亚铁标准溶液的用量和待测硫酸铁铵标准溶液的用量,可以计算出硫酸铁铵标准溶液的实际浓度。
2.4 注意事项在进行标定时要注意观察颜色变化的终点,避免过量滴定导致误差。
进行计算时,要对数据进行合理的四舍五入,保留适当的有效数字,并进行误差分析。
三、结论通过配制和标定硫酸铁铵标准溶液,得到了一定浓度的可用于化学分析的质量较为稳定的标准溶液。
盐酸溶液的配制与标定实验报告化学实验报告——盐酸溶液的标定化学实验报告(无机及分析化学)题目:盐酸溶液的标定学院班级: ##### 姓名: ### 学号:###########指导老师: ###############年##月#日制时间:盐酸浓度的标定一、实验目的1. 练习酸碱标准溶液的标定方法。
2. 学习并掌握用酸碱滴定法测溶液浓度的方法。
3. 练习移液管、容量瓶的使用二、实验原理1.常用的标定NaOH溶液的基准物质是邻苯二甲酸氢钾(KHP),其结构式是:。
标定时反应式:KHC8H4O4 + NaOOH = KNaC8H4O4 + H2O (转载于: 写论文网:盐酸溶液的配制与标定实验报告)2.用盐酸标定氢氧化钠,反应方程式: Na2CO3 + 2HCl = 2NaCl +H2O + CO23.根据邻苯二甲酸氢钾的质量计算氢氧化钠的浓度,再根据氢氧化钠的浓度计算出盐酸的浓度。
三、实验步骤1、0.1mol?L-1 NaOH溶液的标定 (1)检查、洗涤仪器(2)称KHP 用差量法平行准确称量0.4—0.6 g KHP 三份,分别放入250ml的锥形瓶中(标号1、2、3)。
(3)溶解在各锥形瓶中加入20—30ml水溶解。
(4)滴定在锥形瓶中各滴2滴1%酚酞,然后用NaOH溶液滴定至溶液呈微红色30秒内不褪色为终点。
(5)数据处理记录滴定前后NaOH溶液体积,计算NaOH溶液的物质的量浓度,求其平均值,计算相对平均偏差。
2、约1mol?L-1 HCl溶液的标定(1)检查、洗涤仪器检查仪器是否可用,洗涤3支锥形瓶、100ml的烧杯和25ml的移液管,并用盐酸样品润洗移液管三次。
(2)盐酸的稀释用移液管准确量取25ml的盐酸试样于250ml容量瓶中,加水稀释至液面与刻度线相切,摇动,使稀释均匀。
(3)洗涤移液管重新洗涤移液管并用稀释后的盐酸润洗移液管三次。
(4)滴定用移液管从容量瓶中平行取25ml稀释后的盐酸三份,分别放入锥形瓶中,并各滴2滴1%酚酞,然后用NaOH溶液滴定至溶液呈微红色30秒内不褪色为终点。
分析化学实验-缓冲溶液配制原理&常用缓冲溶液的配制一、缓冲溶液与缓冲作用原理 (一)缓冲作用与缓冲溶液纯水在25℃时PH 值为7.0,但只要与空气接触一段时间,因为吸收二氧化碳而使PH 值降到5.5左右。
1滴浓盐酸(约12.4mol·L-1)加入1升纯水中,可使[H +]增加5000倍左右(由1.0×10-7增至5×10-4mol·L-1),若将1滴氢氧化钠溶液(12.4mol·L-1)加到1升纯水中,PH 变化也有3个单位。
可见纯水的PH 值因加入少量的强酸或强碱而发生很大变化。
然而,1滴浓盐酸加入到1升HAc-NaOAc 混合溶液或NaH2PO4-Na2HPO4混合溶液中,[H+]的增加不到百分之一(从1.00×10-7增至1.01×10-7mol·L-1),PH 值没有明显变化.这种能对抗外来少量强酸\强碱或稍加稀释不引起溶液PH 值发生明显变化的作用叫做缓冲作用;具有缓冲作用的溶液,叫做缓冲溶液。
(二)缓冲溶液的组成缓冲溶液由足够浓度的共轭酸碱对组成。
其中,能对抗外来强碱的称为共轭酸,能对抗外来强酸的称为共轭碱,这一对共轭酸碱通常称为缓冲对、缓冲剂或缓冲系,常见的缓冲对主要有三种类型。
1.弱酸及其对应的盐 例如,HAc-NaOAc (实际上是Ac-);H2CO3-NaHCO3;H2C8H4O4-KHC8H4O4(邻苯二甲酸-邻苯二甲酸氢钾);H3BO3-Na2B4O7(四硼酸钠水解后产生H2BO-3)。
2.多元弱酸的酸式盐及其对应的次级盐,例如,NaHCO3-Na2CO3;NaH2PO4-Na2HPO4;NaH2C5HO7(柠檬酸二氢钠)-Na2HC6H5O7;KHC8H4O4-K2C8H4O4。
3.弱碱及其对应的盐 例如NH3-NH+4CL-;RNH2-RNH+3A-(伯胺及其盐);Tris-TrisH+A-(三羟甲基烷及其盐)。
盐酸溶液的配制与标定混合碱中碳酸钠和碳酸氢钠含量的测定
试剂:
碳酸钠基准物质
溴甲酚绿-二甲基黄混合指示剂
碱灰试样
酚酞指示剂
0.1mol/l的HCL标准溶液
EDTA标准溶液的配制与标定
试剂:
NH3●H2O-NH4Cl缓冲溶液(PH=10)
铬黑T指示剂
纯Zn
EDTA二钠盐
水中钙镁含量的测定
试剂
6mol/lNaOH
NH3●H2O-NH4Cl缓冲溶液(PH=10)
铬黑T指示剂
钙指示剂
高锰酸钾溶液的配制与标定
试剂
H2SO4(3 MOL/L)
KMnO4(s)
Na2C2O4(s,A R)
过氧化氢含量的测定
试剂
工业H2O2样品
KMnO4标准溶液(0.02 mol/l)
H2SO4(3 mol/l)
碘和硫代硫酸钠溶液的配制与标定
试剂
K2Cr2O7(s)
HCL(2 mol/l)
Na2S2O3●H2O(s)
KI(s)
I2(s)
淀粉溶液(w=0.005)
碳酸钠固体
葡萄糖含量的测定
试剂
I2标准溶液(0.05 mol/l)
Na2S2O3标准溶液(0.1 mol/l)
NaOH溶液(2 mol/l)
HCL(6 mol/l)
葡萄糖注射液(w=0.50)
淀粉指示剂(w=0.005)
氯化钡中钡的测定
试剂
氯化钡试样
HCL(6 mol/l)
H2SO4(1 mol/l)
HNO3(6 mol/l)
AgNO3(w=0.001)
铁的比色测定
试剂
邻菲咯林水溶液(w=0.0015)
盐酸羟胺水溶液(w=0.10)
NaAc溶液(1 mol/l)
HCL(6 mol/l)
NH4Fe(SO4)2标准溶液
化学
分析天平称量练习滴定分析基本操作练习
仪器与试剂
半自动电光天平台秤小烧杯称量瓶
Na2SO4(s)
NaOH(s)
浓HCL(p=1.18g/ml)
酚酞2 g/l 乙醇溶液
甲基橙1 g/l水溶液
NaOH标准溶液浓度的标定铵盐中氮含量的测定
试剂
邻苯二甲酸氢钾(KHP) 基准试剂或分析纯
无水碳酸钠优级纯
NaOH标准溶液(0.01 mol/l)
酚酞2 g/l 乙醇溶液
甲基橙1 g/l水溶液
40%甲醛
HCL标准溶液浓度的标定混合碱的分析
试剂
邻苯二甲酸氢钾(KHP) 基准试剂或分析纯
无水碳酸钠优级纯
HCL(0.01 mol/l)
酚酞2 g/l 乙醇溶液
甲基橙1 g/l水溶液
EDTA标准溶液的配制与标定水中总硬度的测定
试剂
乙二胺四乙酸二钠
CaCO3优级纯
HCL溶液1:1 1:5
钙指示剂
NaOH 溶液40g/l
Zn SO4●H2O优级纯或金属Zn,w>99.9%
六亚甲基四胺溶液200g/l
二甲酚橙2 g/l水溶液
铬黑T指示剂5 g/l
氨性缓冲溶液(PH=10)
三乙醇胺溶液1:2
高锰酸钾溶液的配制与标定高锰酸钾法测定过氧化氢含量
试剂
KMnO4(s)分析纯
Na2C2O4(s)基准试剂或分析纯
H2SO4溶液3mol/L
MnSO4溶液1mol/L
H2O2试样市售质量分数约为30%的H2O2水溶液
I2和Na2 S2O3 标准溶液的配制及标定碘量法测定葡萄糖的含量试剂
0.017mol/LK2Cr2O7标准溶液
Na2S2O3.5H2O分析纯
I2分析纯
KI(s)
KI溶液100g/L
淀粉指示剂5g/L
Na2CO3(s)
HCL溶液6mol/L
NaOH 溶液1mol/L
HCL溶液1:1
葡萄糖(s)或葡萄糖试液
可溶性氯化物中氯含量的测定(莫尔法)
AgNO3分析纯
NaCl优级纯,使用前在高温炉中于500~600度下干燥2~3h
K2CrO4溶液50 g/L
钡盐中钡含量的测定(沉淀重量法)
仪器与试剂
瓷坩埚漏斗马弗炉定量滤纸
BaCl2 ●2H2O
HCL溶液2 mol/L
H2SO4溶液1mol/L
AgNO3溶液0.1mol/L
离子交换树脂交换容量的测定
仪器与试剂
离子交换柱可用25mL酸式滴定管代用
732型强酸性阳离子交换树脂
玻璃棉
HCL溶液4mol/L
Na2SO4 溶液0.5mol/L
0.10mol/L HCL标准溶液
0.10mol/L NaOH 标准溶液
酚酞2g/L乙醇溶液
邻二氮菲分光光度法测定铁(基本条件实验及试样中微量铁的测定)
仪器与试剂
721或722型分光光度计
0.1mg/L铁标准储备液
0.001 mol/L铁标准溶液
100 g/L盐酸羟胺水溶液
1.5g/L 邻二氮菲水溶液
1.0 mol/L乙酸钠溶液
0.1 mol/L氢氧化钠溶液。