大小鼠麻醉手册
- 格式:pdf
- 大小:956.67 KB
- 文档页数:60

动物麻醉麻醉(anesthesia)的基本任务是消除实验过程中所至的疼痛和不适感觉,保障实验动物的安全,使动物在实验中服从操作,确保实验顺利进行。
一、常用的麻醉药(一)常用局部麻醉剂:普鲁卡因,此药毒性小,见效快,常用于局部浸润麻醉,用时配成0.5%~1%;利多卡因,此药见效快,组织穿透性好,常用1%~2%溶液作为大动物神经干阻滞麻醉,也可用0.25%~0.5%溶液作局部浸润麻醉。
(二)常用全身麻醉剂:1. 乙醚乙醚吸入法是最常用的麻醉方法,各种动物都可应用。
其麻醉量和致死量相差大,所以其安全度大。
但由于乙醚局部刺激作用大,可刺激上呼吸道粘液分泌增加;通过神经反射还可扰乱呼吸、血压和心脏的活动,并且容易引起窒息,在麻醉过程中要注意。
但总起来说乙醚麻醉的优点多,如麻醉深度易于掌握,比较安全,而且麻醉后恢复比较快。
其缺点是需要专人负责管理麻醉,在麻醉初期出现强烈的兴奋现象,对呼吸道又有较强的刺激作用,因此,需在麻醉前给予一定量的吗啡和阿托品(基础麻醉),通常在麻醉前20-30分钟,皮下注射盐酸或硫酸吗啡(每公斤体重5~10mg)及阿托品(每公斤体重0.1mg)。
盐酸吗啡可降低中枢神经系统兴奋性,提高痛阈,还可节省乙醚用量及避免乙醚麻醉过程中的兴奋期。
阿托品可对抗乙醚刺激呼吸道分泌粘液的作用,可避免麻醉过程中发生呼吸道堵塞,或手术后发生吸入性肺炎。
进行手术或使用过程中,需要继续给予吸入乙醚,以维持麻醉状态。
慢性实验预备手术的过程中,仍用麻醉口罩给药,而在一般急性使用,麻醉后可以先进行气管切开术,通过气管套管连接麻醉瓶继续给药。
在继续给药过程中,要时常检查角膜反射和观察瞳孔大小(如发现角膜反射消失,瞳孔突然放大,应立即停止麻醉。
万一呼吸停止,必须立即施行人工呼吸。
待恢复自动呼吸后再进行操作。
2. 苯巴比妥钠此药作用持久,应用方便,在普通麻醉用量情况下对于动物呼吸、血压和其它功能无多大影响。
通常在实验前半至一小时用药。

小鼠(mouse)麻醉剂量表IM:肌肉注射IV:静脉注射SC:皮下注射IP:腹腔注射Inhalation:吸入大鼠(Rat)麻醉剂量表IM:肌肉注射IV:静脉注射SC:皮下注射IP:腹腔注射Inhalation:吸入Reference: 1.实验动物管理与使用指南。
(中华实验动物学会出版2004)2.Clinical laboratory animal medicine。
(K,Hrapkiewicz Iowa State University Press1998)IM:肌肉注射IV:静脉注射SC:皮下注射IP:腹腔注射Inhalation:吸入Reference: 1.实验动物管理与使用指南。
(中华实验动物学会出版2004)2.Clinical laboratory animal medicine。
(K,Hrapkiewicz Iowa State University Press1998)IM:肌肉注射IV:静脉注射SC:皮下注射IP:腹腔注射Inhalation:吸入Reference: 1.实验动物管理与使用指南。
(中华实验动物学会出版2004)2.Clinical laboratory animal medicine。
(K,Hrapkiewicz Iowa State University Press1998)IM:肌肉注射IV:静脉注射SC:皮下注射IP:腹腔注射Inhalation:吸入Reference: 1.Clinical laboratory animal medicine。
(K,Hrapkiewicz Iowa State University Press1998)天竺鼠(Guinea Pig)麻醉剂量表IM:肌肉注射IV:静脉注射SC:皮下注射IP:腹腔注射Inhalation:吸入Reference: 1.Clinical laboratory animal medicine。



大鼠和小鼠的处死方法1.脊椎脱臼法右手抓住鼠用力向后拉,同时左手拇指与食指用力向下按住鼠头,将脊髓与脑髓拉断,鼠便立即死亡。
2.断头法实验者戴上棉绿纱手套,用右手握住大鼠头部,左手握住背部,露出颈部,助手用剪刀在鼠颈部将鼠头剪掉。
小鼠处死法相同。
3.击打法右手抓住鼠尾,提起,用力摔击其头部,鼠痉挛后立即死亡。
用小木锤用力击打鼠头部也可致死。
4.急性大失血法可采用鼠眼眶动脉和静脉急性大量失血方法使鼠立即死亡。
5.化学致死法吸入一氧化碳,大、小鼠在一氧化碳浓度为0.2-0.5%环境中即可致死。
皮下注射士的年,吸入乙醚、氨仿,均可致死。
士的年注射量,小鼠为0.76~2.0mg/kg体重,大鼠3.0-3.5ml/kg体重。
氯化钾处死大鼠剂量:25%溶液0.6ml/只静脉注入。
快速处死小鼠的专业方法:这是在动物试验中最常用的也是最使用的处死小鼠的方法,要领是拉的时候必须要快速使劲,才可让小鼠瞬间死亡,如果拉时固定小鼠头部的手指松了有可能造成小鼠转身咬伤手指的事故发生。
脊柱脱臼法:用左手拇指和食指捏住小白鼠头的后部,并用力下压,右手抓住鼠尾,用力向后上方拉,即可使颈椎脱臼,瞬间死亡动物处死方法:主要依据动物的种类、动物的大小、取材的手段以及观察的组织结构特点,选用动物处死的方法。
1.麻醉的方法(1)吸入麻醉法:适用的动物:大鼠、豚鼠等。
麻醉药物:乙醚、三氯甲烷(氯仿)。
(2)注射麻醉法适宜的动物:大鼠、豚鼠、兔、猫、犬、猴等。
麻醉药物: 4%戊巴比妥、20%氨基甲酸乙酯、1%水合氯醛。
按照动物的每公斤体重给予药量。
注射途经:肌肉注射、静脉注射、腹腔注射。
2.空气栓塞方法通过向动物静脉内注射一定量的空气,使其心脏在暂短的时间内发生急性空气栓塞,从而造成机体血液循环障碍,导致动物痉挛而死亡。
适用的动物:家兔、犬等。
注射空气的量视动物大小而不同,家兔:约20~60ml;犬:约80~150ml。
注意:利用空气栓塞方式处死动物虽然迅速方便,但此方法可使动物机体内各脏器或多或少地出现淤血的现象,如心内膜下淤血。

小鼠(mouse)麻醉劑量表大鼠(Rat)麻醉劑量表Reference: 1.實驗動物管理與使用指南。
(中華實驗動物學會出版2004)2.Clinical laboratory animal medicine。
(K,Hrapkiewicz Iowa State University Press1998)Reference: 1.實驗動物管理與使用指南。
(中華實驗動物學會出版2004)2.Clinical laboratory animal medicine。
(K,Hrapkiewicz Iowa State University Press1998)Reference: 1.實驗動物管理與使用指南。
(中華實驗動物學會出版2004)2.Clinical laboratory animal medicine。
(K,Hrapkiewicz Iowa State University Press1998)Reference: 1.Clinical laboratory animal medicine。
(K,Hrapkiewicz Iowa State University Press1998)天竺鼠(Guinea Pig)麻醉劑量表Reference: 1.Clinical laboratory animal medicine。
(K,Hrapkiewicz Iowa State University Press1998)兔(Rabbit)麻醉劑量表Reference: 1.實驗動物管理與使用指南。
(中華實驗動物學會出版2004)2.Clinical laboratory animal medicine。
(K,Hrapkiewicz Iowa State University Press1998)犬(Dog)麻醉劑量表Reference: 1.實驗動物管理與使用指南。
(中華實驗動物學會出版2004)靈長類(Primate)麻醉劑量表Reference: 1.實驗動物管理與使用指南。

常用麻醉药的剂量和用法
1、戊巴比妥钠:适用于犬、猫、兔时多采用静脉和腹腔注射的方法,静脉时剂量为30mg/kg常用浓度为3%,用药量为1.0ml/kg,腹腔时剂量为40-50mg/kg,常用浓度为3%。
当对象为豚鼠时,用腹腔注射剂量为40-50mg/kg常用浓度为2%。
大,小鼠时,用腹腔,剂量为45mg/kg,常用浓度为2%。
2、氨基甲醛:主要用于犬、猫、兔采用腹腔和静脉注射的方法,一般剂量为750-1000mg/kg常用浓度为25%。
3、氨基甲酸乙酯(乌拉坦):适用于豚鼠和大,小鼠时,多采用腹腔注射的方法,剂量为1350mg/kg,常用浓度为20%家兔,可以静脉,也可以腹腔注射。
剂量1g/kg。
4、异戊巴比妥:适用于犬、猫、兔时,如果采用静脉时,剂量为40-50mg/kg常用浓度为5%,用药量为0.8-1.0mg/kg,如果采用腹腔和肌肉注射时,剂量为80-100mg/kg常用浓度为10%。
5、硫喷妥钠: 适用于犬、猫、兔时采用静脉和腹腔方法,剂量为25-50mg/kg,常用浓度为2%。
当是大白鼠时,采用静脉和腹腔方法,剂量为50-100/kg,常用浓度为1%。
麻醉时间为15-30min,效力强,宜慢注射。
6、乙醚:适用于各种动物,采用器官内插入吸入。

大小鼠乙醚麻醉1 麻醉药的领取1.1 麻醉药采用双人双锁保管。
1.2 领取麻醉药时,由SD或SD指定的试验人员先通知管理负责人。
管理负责人或其指定的管理人员按规定程序进入供试品室。
在双方管理人都在场情况下,打开双锁,然后交给SD或SD指定的实验人员。
1.3 SD或SD指定的试验人员用电子天平准确称取所需质量的麻醉药,并填写电子天平使用记录和麻醉药领用记录。
1.4 管理人员将麻醉药放回原处,加上双锁,并对麻醉药领用记录进行确认。
2 麻醉药配制2.1 配制者将所需质量的麻醉药,置入容器中,先以适量无菌0.9%氯化钠注射液或蒸馏水溶解,再加相应溶媒稀释混匀后定容至所需体积。
2.2 配制好的麻醉药溶液应标明名称、配制日期、配制浓度、贮存条件、有效期和配制者等信息。
3 麻醉用物品的准备:小烧杯、鼠麻醉盒、乙醚、干棉球若干、止血钳4 麻醉药使用前准备4.1 把干棉球放入小烧杯内。
4.2 将适量乙醚倒入小烧杯内使棉球完全浸润,立即将乙醚容器盖紧。
4.3 把小烧杯放入鼠麻醉盒内,然后紧闭麻醉盒。
5 鼠的抓取及放入麻醉盒5.1 小鼠的抓取待小鼠在笼内安静时,用右手拇指和食指捏住尾部中央将其提起,左手打开麻醉盒,迅速把小鼠放入麻醉盒,然后紧闭麻醉盒。
5.2 大鼠的抓取戴上防护手套,待大鼠在笼内安静时,4-5周龄以内的大鼠用右手拇指和食指捏住尾部中央将其提起后放在笼盖上,周龄较大的鼠应抓住尾巴的基部将其提起。
左手打开麻醉盒,迅速把大鼠放入麻醉盒,然后紧闭麻醉盒。
6 麻醉效果的判断6.1 仔细观察,当鼠自行倒下、呼吸由快变慢时将其从麻醉盒内取出,开始检查其角膜反射和痛觉反射。
6.2 用止血钳前头轻轻碰触鼠的角膜,若鼠不闭眼和闪避,证明鼠的角膜反射消失。
6.3 用止血钳用适当力量夹鼠的足趾,若鼠无挣扎和闪避证明痛觉反射消失。
6.4 这时证明鼠已麻醉好。
6.5 假如角膜反射和痛觉反射未消失,将其放回麻醉盒继续进行麻醉。
然后重复4.1~4.4步操作。


大、小鼠戊巴比妥钠麻醉1 注射前物品的准备1.1 无菌注射器、5%碘伏棉球、75%的酒精棉球、灭菌干棉球若干、镊子、防护手套1.2 药品的准备大鼠用3%的戊巴比妥钠、小鼠用0.3%的戊巴比妥钠溶液。
1.3 将待麻醉的鼠称重,并根据体重计算需要使用的麻醉剂数量,大鼠0.1~0.2 ml/100 g,小鼠0.1~0.2 ml/10 g。
1.4 把注射器内抽好已计算出的药量备用。
2 鼠抓取与固定:2.1 小鼠2.1.1 抓取:小鼠称重或者移盒时戴好防护手套,抓住小鼠的尾根部进行抓取。
2.1.2 固定:用一手抓住鼠尾并提起,放在表面较粗糙的台面或笼具盖上,用另一手食指和拇指抓住小鼠尾巴移交给无名指和小指夹住,再用拇指和食指捏住双耳及头颈部皮肤即可完全固定,进行试验操作。
2.2 大鼠2.2.1 抓取:大鼠称重或者移盒时戴好防护手套,抓住大鼠的尾根部进行抓取。
2.2.2 固定:用一手抓住大鼠的尾根部提起置于较粗糙的台面或笼具盒上,一手抓住大鼠的尾巴向后拉,用另一手拇指、食指抓住头颈部皮肤,手掌握住大鼠上半身背部皮肤即可将大鼠完全固定,进行试验操作。
3 注射3.1 手持已抽好戊巴比妥钠溶液的注射器,食指固定注射器前端。
针头在鼠的下腹部腹白线稍右/左位置,从下腹部朝头方向平行地刺入皮下。
3.2 进针3~5 mm后,再将针头与皮肤成45°角斜穿过腹肌,当感到有落空感时,停止进针,固定针头。
回抽无回血、无肠液、尿液,便可缓缓推入药液。
3.3 此给药量可麻醉2~3 h,如需延长麻醉,中途可加量1/5,可多维持1 h。
4 麻醉后事项4.1 操作者在记录表格相应位置记录麻醉时间并签名。
4.2 鼠麻醉完毕后,剩下戊巴比妥钠溶液按麻醉药品的管理制度交回专管人员。
其它用品按实验室常规要求处理。
标准操作规程(SOP)——一、目的该文件用以说明实验动物麻醉的具体操作以及操作规范,以保证麻醉剂量准确,使实验动物处于麻醉状态,实验顺利进行。
同时保证操作人员的安全。
二、范围适用于中国国家流感中心的所有技术人员对实验动物进行麻醉。
三、程序(一)生物安全要求动物实验涉及到H5、H7亚型高致病性禽流感病毒,H2N2亚型流感病毒的时候,动物麻醉操作需要在ABSL-3级实验室进行操作。
操作其他病毒的时候,动物麻醉操作需要在ABSL-2级实验室中进行。
(二)材料1.实验动物:中小型实验动物,如:小鼠、大鼠、豚鼠、兔及雪貂等。
2.动物实验中常用的麻醉剂分为三类,即挥发性麻醉剂、非挥发性麻醉剂和中药麻醉剂。
(1)挥发性麻醉剂这类麻药包括乙醚、氯仿等。
乙醚吸入麻醉适用于各种动物,其麻醉量和致死量差距大,所发安全度亦大,动物麻醉深度容易掌握,而且麻后苏醒较快。
其缺点是对局部刺激作用大,可引起上呼吸道粘膜液体分泌增多,再通过神经反射可影响呼吸、血压和心跳活动,并且容易引起窒息,故在乙醚吸入麻醚时必须有人照看,以防麻醉过深而出现上情况。
(2)非挥发性麻醉剂这类麻醉剂种类较多,包括苯巴比妥钠、戊巴比妥钠、硫喷妥钠等巴比妥类的衍生物,氨基甲酸乙脂和水合氯醛。
这些麻醉剂使用方便,一次给药可维持较长的麻醉时间,麻醉过程较平衡,动物无明显挣扎现象。
但缺点是苏醒较慢。
(3)中药麻醉剂动物实验时有时也用到象洋金花和氢溴酸东莨菪碱等中药麻醉剂,但由于其作用不够稳定,而且常需加佐剂麻醉效果才能理想,故在使用过程中不能得到普及,因而,多数实验室不选用这类麻醉剂进行麻醉。
(三)实验步骤1.吸入法用一块圆玻璃板和一个钟罩或一个密闭的玻璃箱作为挥发性麻醉剂的容器,多选用乙醚作麻醉药。
麻醉时用几个棉球,将乙醚倒可其中,迅速转入钟罩或箱内,让其挥发,然后把待麻醉动物投入,约隔4-6min即可麻醉,麻醉后应立即取出,并准备一个蘸有乙醚的棉球小烧杯,在动物麻醚变浅时给套在鼻上使其补吸麻醉药。
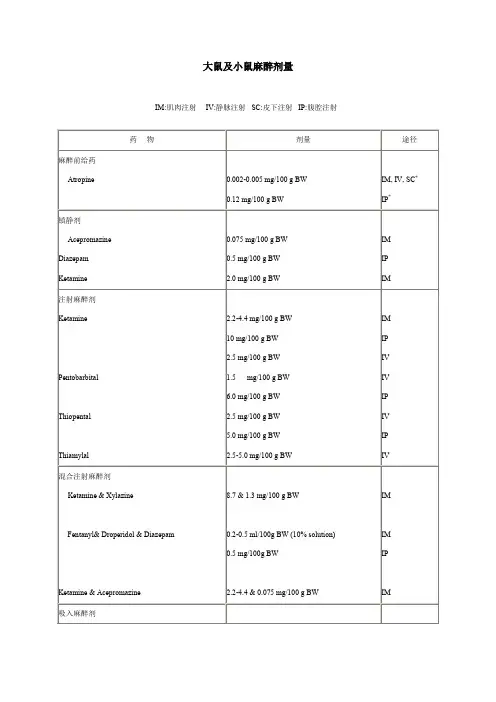
小鼠(mouse)麻醉剂量IM:肌肉注射 IV:静脉注射 SC:皮下注射 IP:腹腔注射麻醉前给药阿托品0.002-0.005 mg/100 g BW0.12 mg/100 g BW IM, IV, SC* IP*镇静剂乙酰丙嗪安定氯胺酮0.075 mg/100 g BW0.5 mg/100 g BW2.0 mg/100 g BWIMIPIM注射麻醉剂氯胺酮戊巴比妥戊硫代巴比妥戊巴比妥钠2.2-4.4 mg/100 g BW10 mg/100 g BW2.5 mg/100 g BW1.5 mg/100 g BW6.0 mg/100 g BW2.5 mg/100 g BW5.0 mg/100 g BW2.5-5.0 mg/100 g BWIMIPIVIVIPIVIPIV混合注射麻醉剂氯胺酮 & 甲氧氟烷芬太奴 & 氟哌啶 & 安定氯胺酮 & 乙酰丙嗪8.7 & 1.3 mg/100 g BW0.2-0.5 ml/100g BW (10% solution)0.5 mg/100g BW2.2-4.4 & 0.075 mg/100 g BWIMIMIPIM吸入麻醉剂甲氧氟烷三氟溴氯乙烷 CO2起始浓度: 2-4%维持浓度: 0.5-1.5%起始浓度: 1-3%维持浓度: 0.5-1.5%起始浓度: 10-15 seconds止痛剂度冷丁喷他佐辛纳布啡布托啡诺布诺啡2.0 mg/100 g BW0.4 mg/100 g BW1.0 mg/100 g BW0.5 mg/100 g BW0.1-0.5 mg/100 g BW0.2 mg/100 g BW /12h0.2 mg/100 g BW /6-8hIM, SCIPIM, SC, IVIM, SCIM, SCSCIP不推荐使用的药物氯仿四氯化丙嗪乙醚三氯乙烯三溴乙醇。
实验动物麻醉规范一、麻醉深度的监测(1)后足反射消失:方法---用镊子夹脚趾没有收缩反应(2)肌肉松弛失去张力(3)呼吸深,慢,但有节律*** 对于长时间的手术,整个手术过程中要不断检查麻醉深度***二、全身麻醉(1)腹腔注射戊巴比妥钠(小鼠50-90 mg/kg;大鼠40-60 mg/kg;兔20-40 mg/kg 静脉注射)(2)同时术前给予皮下注射美洛昔康(小鼠1-2 mg/kg;大鼠 1 mg/kg;兔 0.3 mg/kg)或卡洛芬(小鼠 5 mg/kg;大鼠 5 mg/kg;兔 4 mg/kg)三、术后给予镇痛药(1)大鼠,小鼠:美洛昔康 (0.005 mg/mL 加入饮水瓶中) 或布洛芬(0.2 mg/mL 加入饮水瓶中),持续2-3天(2)兔:皮下注射美洛昔康(0.3 mg/kg)或卡洛芬(4 mg/kg),每天一次,持续2-3天*** 对于创伤大的手术(包括开腹,开胸,器官移植,骨科手术,烧伤模型,创伤模型,肠穿孔模型,皮下泵植入,永久性插管等)术后必须使用镇痛剂***四、局部麻醉用药(推荐)*** 对于创伤大的手术推荐局麻药和全身麻醉联合使用***方法:0.5% 布匹卡因→生理盐水稀释至 0.25%,皮下局部浸润(总剂量不超过8 mg/kg,大鼠、小鼠相同)如何溶解美洛昔康莫比可 0.5 片(含美洛昔康 3.75 mg), 加入 1.5 ml 90% 乙醇和 0.5 ml 0.1 M 的氢氧化钠,充分研磨溶解,用pH 7.5 的磷酸缓冲液稀释至 0.5 mg/ml 的原液。
将原液按 1:100 的比例加入饮水中(饮水中可适当加些蔗糖消除异味)。
可用于大鼠和小鼠。
*** 美洛昔康溶于DMSO,如注射可先用DMSO溶解再用生理盐水稀释 ***。