(“六六六”)
三、苯的用途
合成纤维、合成橡胶、塑料、农药、医 药、染料、香料等,也常用于有机溶剂。
结构
苯的特 殊结构
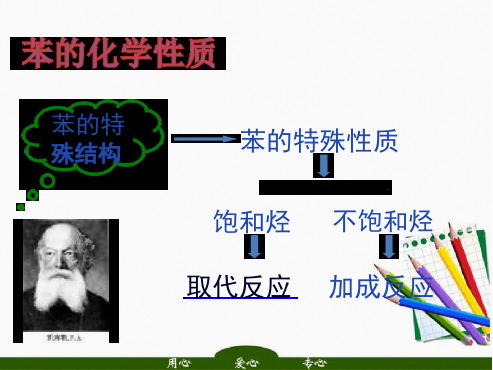
总结:苯的化学性质
性质
苯的特殊性质
卤代反应 硝化反应 磺化反应
饱和烃 取代反应
不饱和烃 加成反应
与H2 与Cl2
例1:能说明苯分子中的碳碳键不是单、双键交替的是(B ) A、苯的一元取代物没有同分异构体 B、苯的邻位二元取代物只有一种 C、苯的间位二元取代物只有一种 D、苯的对位二元取代物只有一种
思考:1、Fe的作用? 2、AgNO3溶液的作用? 3、双球U形管中CCl4的作 用? 4、溴苯在哪里产生,如何除去其中溶解的溴单质? 5、上述现象中, 是否可以说明此为取代反应,而非加成反应?
总结: 1、Fe/FeBr3是催化剂; 2、AgNO3溶液和HBr反应,以证明苯和液溴是取代反 应; 3、双球U形管中CCl4吸收溴蒸气,避免溴蒸气进入 AgNO3溶液产生HBr; 4、溴苯是无色油状物,不溶于水,密度比水大,常因 溶解液溴而成棕褐色。可用NaOH溶液洗去其中的液溴。
苯的性质
提纲 一、苯的物理性质 二、苯的化学性质 三、苯的用途
一、苯的物理性质
无色,带有特殊气味的液体 熔沸点低:沸点 80.1℃、 熔点 5.5℃ 密度比水小 不溶于水,易溶于有机溶剂 易挥发,苯蒸气有毒(密封保存)
二、苯的化学性质 1、氧化反应
(1)燃烧:2C6H6 +15O2 → 12CO2 + 6H2O 现象:火焰明亮,产生大量黑烟
(3)磺化反应
+ HO-SO3H 70~80C (H2SO4)
SO3H
+ H2O
(苯磺酸,溶于水,强酸)