教材图解(思维导图+微试题)人教版化学选修4 2-4化学反应进行的方向.doc
- 格式:doc
- 大小:1.24 MB
- 文档页数:4




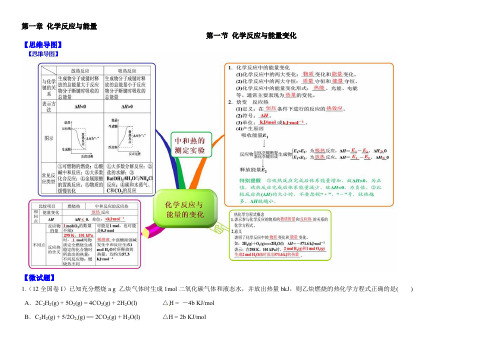
第一章化学反应与能量第一节化学反应与能量变化【思维导图】【微试题】1.(12全国卷I)已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( ) A.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l) △H = -4b KJ/molB.C2H2(g) + 5/2O2(g) == 2CO2(g) + H2O(l) △H = 2b KJ/molC.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l) △H = -2b KJ/molD.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l) △H = b KJ/mol【答案】C2.(2014年全国理综试题)已知(1)H2(g)+1/2O2(g) = H2O(g) △H1= a kJ·mol-1(2)2H2(g)+O2(g) = 2H2O(g) △H2= b kJ·mol-1(3)H2(g)+ 1/2O2(g) = H2O(l) △H3= c kJ·mol-1(4)2H2(g)+O2(g) = 2H2O(l) △H4= d kJ·mol-1下列关系式中正确的是( )A.a<b<c<0 B.b>d>0 C.2a=b<0 D.2c= d>0 【答案】C3. (2012·大纲全国理综,9)反应A+B→C(ΔH<0)分两步进行:①A+B→X(ΔH>0),②X→C(ΔH<0)。
下列示意图中,能正确表示总反应过程中能量变化的是()【答案】D4.实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:实验次数起始温度t1/℃终止温度t2/℃盐酸NaOH溶液1 20.2 20.3 23.72 20.3 20.5 23.83 21.5 21.6 24.9试完成下列问题:(1)实验时用环形玻璃棒搅拌溶液的方法是_____________________________________,不能用铜丝搅拌棒代替环形玻璃棒的理由是__________________________________。

普通高中化学
(山东科学技术出版社)
化学反应原理(第1章化学反应与能量转化)
思维导图
史学强
2014年10月18日
你是否发现笔记记得越多,思维也越混乱?你是否经常为琐事缠身而苦无分身之术?你是否总是感叹一天的时间太少?思维导图来了!它可以“解救”你!
思维导图是一种终极思维工具,由英国“记忆之父”东尼·博赞发明,并在全球得到广泛推广,已成为21世纪风靡全球思维工具,到目前已被世界上2.5亿人所使用。
思维导图注重开发人的左、右脑,运用线条、符号、词汇和图像,把一长串枯燥的信息变成彩色的、容易记忆的、有高度组织性的图,它绘制起来非常简单,而且十分有趣!它可以帮助人们改善思维,提高记忆力和办事效率。
关键词:高中化学化学反应原理电解池盖斯定律反应热原电池史学强
本资料利用思维导图整理高中化学《化学反应原理》第一章章中每一节基础知识,可以帮助大家增强记忆、改善思维、提高化学学习效率!
化学反应与能量转化
1-1化学反应的热效应
1-2电能转化为化学能——电解
1-3化学能转化为电能——电池。
高二化学教学案一、课标解读:1.了解熵的基本涵义,理解化学反应方向判断的焓判据及熵判据;2.能用焓变和熵变说明化学反应的方向。
重点难点:化学反应的焓变与熵变对反应进行方向的影响。
二、复习巩固:1.对于可逆反应:A (g )+ 2B (g) 2C (g )△H >0,图中正确的是( )2.在容积固定的4L 密闭容器中,进行可逆反应:X(气)+2Y (气) 2Z(气)并达到平衡,在此过程中,以Y 的浓度改变表示的反应速率υ(正)、υ(逆)与时间t 的关系如右图,如图中阴影部分面积表示( )A .X 的浓度的减少B .Y 的物质的量的减少C .Z 的浓度的增加D .X 的物质的量的减少 3. 一真空密闭容器中盛有1molPCl 5,加热到200℃时发生反应PCl 5(g) PCl 3(g)+Cl 2(g),反应达到平衡时,PCl 5所占体积百分数为M%。
若在同一温度和同一容器中,最初投入的是2molPCl 5,反应达平衡时,PCl 5所占体积百分数为N%,则M 和N 的正确关系是( )A .M >NB .M <NC .M =ND .无法比较4.可逆反应:2X+Y 2Z (g ),△H <0,气体的平均摩尔质量(M )随温度变化如图所示,则下列说法正确的是( )A .X 和Y 可能都是固体B .X 和Y 一定都是气体C .若Y 为固体,X 一定是气体D .X 和Y 不可能都是气体 三、教学互动【思考与交流】汽车尾气中的主要污染物是一氧化氮以及燃料不完全燃烧所产生的一氧化碳,它们是现代城市中的大气污染物,为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO (g )+ 2CO (g )= N 2(g )+ 2CO 2(g ),你能否判断这一方案是否可行?理论依据是什么?A D CB K )水由高处往低处流,自由落体,电流由电位高的地方向电位低的地方流,铁器暴露于潮湿的空气中会生锈,室温下冰块会融化,……这些都是在一定条件下,不需要外力作用就能自动进行的过程——自发过程。
第二章化学反应速率和化学平衡
第四节化学反应进行的方向
【思维导图】
【微试题】
1.(2010·杭州第一次质量检测)下列说法中正确的是()
A.凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应B.自发反应一定是熵增大的反应,非自发反应一定是熵减小或不变的反应C.熵增加且放热的反应一定是自发反应
D.非自发反应在任何条件下都不能发生
【答案】C
2.对于反应:4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)ΔH=-444.3 kJ·mol-1,且熵减小,在常温常压下该反应能自发进行,对该反应的方向起决定作用的是( )
A.焓变B.温度C.压强D.熵变
【答案】A
3.高温下,某反应达平衡,平衡常数K=[c(CO)·c(H2O)]/[c(CO2)·c (H2)],恒容时,温度升高,H2浓度减小,下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O CO2+H2
【答案】A
4.(2012·海南高考·15) 已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“>”“=”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率υ(A)=0.003 mol·L-1·s-1。
,则6s时c(A)= mol·L-1,C的物质的量为mol;若反应经一段时间后,达到平衡时A的转化率为,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为;
(3)判断该反应是否达到平衡的依据为(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为。
【答案】(1)(C)(D)
(A)(B)⋅⋅c c c c < (2)0. 022 0.09 80% 80%
(3)c (4)2.5
【解析】(1)因反应中的物质都是气体,据平衡常数的定义可知其K=(C)(D)
(A)(B)⋅⋅c c c c ;由表中数
据可知,温度升高,K 值减小,故正反应为放热反应,ΔH<0。
(2)υ(A)=0.003 mol ·L -1·s -1 ,则A 减少的浓度Δc(A)=υ(A)·t=0.018 mol ·L -1,故剩余的A 的浓度为0.2mol/5L-0.018 mol ·L-1=0.022 mol ·L -1;A 减少的物质的量为0.018 mol ·L -1×5L=0.09mol ,根据方程式的计量数关系,生成的C 的物质的量也为0.09mol 。
设830℃达平衡时,转化的A 的浓度为x ,则: A(g) +
B(g)
C(g) + D(g)
起始浓度(mol ·L -
1) 0.04 0.16 0 0 转化浓度(mol ·L -
1) x x x x
平衡浓度(mol ·L -
1) 0.04-x 0.16-x x x
有:(0.04)(0.16)⋅-⋅-x x x x =1, 解得x =0.032,故A 的转化率α(A)=-1
-1
0.032mol L 0.04mol L ⋅⋅×100%
=80%;由于容器的体积是固定的,通入氩气后各组分的浓度不变,反应速率不改变,平衡不移动。
(3)由于该反应是气体分子数不变的反应,容器中压强、气体的密度都永远不变,故a 、b 错;c(A)随反应的进行要减小,故c 可以;不论是否达平衡,单位时间里生成C 和D 的物质的量永远相等,故d 错。
(4)反应“C(g)+D(g)
A(g)+B(g)”与“A(g)+B(g)
C(g)+D(g)”互为逆反应,平衡常数互为倒数关系,故1200℃时,
C(g)+D(g)
A(g)+B(g)的
K=1
0.4=2.5。