大学物理化学实验报告---液体饱和蒸汽压的测定
- 格式:doc
- 大小:85.50 KB
- 文档页数:6

液体饱与蒸汽压的测定一、实验目的1、明确液体饱与蒸汽压的意义,熟悉纯液体的饱与蒸汽压与温度的关系以及克劳休斯-克拉贝农方程。
2、了解静态法测定液体饱与蒸汽压的原理。
3、学习用图解法求解被测液体在试验温度范围内的平均摩尔蒸发焓与正常沸点。
二、实验原理1、热力学原理通常温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱与蒸气压,简称为蒸气压。
蒸发1mol 液体所吸收的热量称为该温度下液体的摩尔气化热。
液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低,这主要与分子的动能有关。
当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变。
当外压为101、325kPa 时,液体的沸点称为该液体的正常沸点。
液体的饱与蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示:2mvap d ln d RT H T p ∆= (1)式中,R 为摩尔气体常数;T 为热力学温度;Δvap H m 为在温度T 时纯液体的摩尔气化热。
假定Δvap H m 与温度无关,或因温度范围较小,Δvap H m 可以近似作为常数,积分上式,得:C TR H p +⋅∆-=1ln m vap (2)其中C 为积分常数。
由此式可以瞧出,以ln p 对1/T 作图,应为一直线,直线的斜率为 RH mvap ∆-,由斜率可求算液体的Δvap H m 。
2、实验方法静态法测定液体饱与蒸气压,就是指在某一温度下,直接测量饱与蒸气压,此法一般适用于蒸气压比较大的液体。
静态法测量不同温度下纯液体饱与蒸气压,有升温法与降温法二种。
本次实验采用升温法测定不同温度下纯液体的饱与蒸气压,所用仪器就是纯液体饱与蒸气压测定装置。
平衡管由A 球与U 型管B 、C 组成。
平衡管上接一冷凝管,以橡皮管与压力计相连。
A 内装待测液体,当A 球的液面上纯粹就是待测液体的蒸气,而B 管与C 管的液面处于同一水平时,则表示B 管液面上的(即A 球液面上的蒸气压)与加在C 管液面上的外压相等。

4纯液体饱和蒸汽压的测定实验报告测定纯液体饱和蒸汽压实验报告
实验目的:
本实验是为了测定纯液体的饱和蒸汽压,并分析结果得出不同温度下的汽油饱和蒸汽压的特性,从而获得不同温度下汽油的饱和汽油蒸汽压。
实验原理:
纯液体的饱和蒸汽压是液体中的分子在特定温度下蒸发组成的气体恒定的压强,它是特定温度下液体分子能够蒸发的最大的压力,也是液体蒸发过程中最重要的温度参数。
只有当液体的压力高于此压力时,液体分子才能持续蒸发,从而保持气体浓度和压强的恒定。
因此,测定纯液体饱和蒸汽压有重要意义。
实验设备:
1、一台(S-3010)压力表,能够测量饱和蒸汽压,可以实时显示出压力值;
2、一台(T-500)恒温恒压蒸发装置,能够将液体恒温恒压蒸发;
3、一台(T-6R)温控恒温恒压容器,能够将恒温恒压的液体室放入容器内保存,非常重要;
4、标准液体,包括甲苯、乙醇、丙酮、正己烷、苯等;
实验方法:
1、将温控恒温恒压容器中的恒温恒压的液体放入到(T-500)恒温恒压蒸发装置内;
2、在(T-500)恒温恒压蒸发装置中调节液体温度,调节液体温度的范围是25℃-95℃;。

实验4 液体饱和蒸气压的测定丛乐2005011007 生51实验日期:2007年11月24日星期六提交报告日期:2007年12月8日星期六助教老师:叶逢春1 引言1.1实验目的1.运用克劳修斯-克拉贝龙方程,求出所测温度范围内平均摩尔气化焓及正常沸点。
2.掌握测定饱和蒸汽压的方法。
1.2 实验原理在通常温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。
蒸发1摩尔液体所吸收的热量称为该温度下液体的摩尔气化热。
液体的蒸气压与液体的本性及温度等因素有关。
随温度不同而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低,这主要与分子的动能有关。
当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变,当外压为pø(101.325kPa)时,液体的沸点称为该液体的正常沸点。
液体的饱和蒸气压与温度的关系用克劳修斯(Clausius)-克拉贝龙(Clapeyron)方程式表示:式中,R为摩尔气体常数;T为热力学温度;Δvap H m为在温度T时纯液体的摩尔气化热。
假定Δvap H m与温度无关,或因温度变化范围较小,Δvap H m可以近似作为常数,积分上式,得:Aln p BT=-+或Aln p BT=-+vap mH Rm ∆=-式中:B——积分常数。
从上式可知:若将ln p 对1/T 作图应得一直线,斜率m=vap m -A H /R =-∆由此可得 vap m H Rm ∆=-,同时从图上可求出标准压力时的正常沸点。
2 实验操作2.1 实验药品、仪器型号及测试装置示意图1.仪器等压管1支、稳压瓶1个、负压瓶1个、恒温槽1套、冷凝管1个、真空泵1台、自耦调压变压器1台(TDG1/250型)、搅拌器1个、压力计1台(LZ-PI 型)、温度测量控制仪1台(CK-1B 型)。
2.药品无水乙醇(分析纯;20℃时密度:0.789-0.791g/ml ;M r =46.07)2.2 实验条件 表1 实验条件记录实验前温度(℃) 实验前大气压(kPa ) 实验前空气湿度15.8 102.59 35%2.3 实验操作步骤及方法要点1. 装置与装样按图1安装好整套装置,并把乙醇装入等压管中,使液面在等压管的三分之二处。

实验一液体饱和蒸气压的测定一、实验目的1.掌握静态法测定液体饱和蒸气压的原理及操作方法。
学会由图解法求其平均摩尔气化热和正常沸点。
2.了解纯液体的饱和蒸气压与温度的关系、克劳修斯-克拉贝龙(Clausius-Clapeyron)方程式的意义。
3.了解真空泵、恒温槽及气压计的使用及注意事项。
二、实验原理通常温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。
蒸发1mol液体所吸收的热量称为该温度下液体的摩尔气化热。
液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低,这主要与分子的动能有关。
当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变,当外压为101.325kPa时,液体的沸点称为该液体的正常沸点。
液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示:(1)式中,R为摩尔气体常数;T为热力学温度;ΔvapHm为在温度T时纯液体的摩尔气化热。
假定ΔvapHm与温度无关,或因温度范围较小,ΔvapHm可以近似作为常数,积分上式,得:(2)其中C为积分常数。
由此式可以看出,以lnp对1/T作图,应为一直线,直线的斜率为,由斜率可求算液体的ΔvapHm。
静态法测定液体饱和蒸气压,是指在某一温度下,直接测量饱和蒸气压,此法一般适用于蒸气压比较大的液体。
静态法测量不同温度下纯液体饱和蒸气压,有升温法和降温法二种。
本次实验采用升温法测定不同温度下纯液体的饱和蒸气压,所用仪器是纯液体饱和蒸气压测定装置,如图2-3-1所示:平衡管由A球和U型管B、C组成。
平衡管上接一冷凝管,以橡皮管与压力计相连。
A内装待测液体,当A球的液面上纯粹是待测液体的蒸气,而B管与C管的液面处于同一水平时,则表示B管液面上的(即A球液面上的蒸气压)与加在C管液面上的外压相等。
此时,体系气液两相平衡的温度称为液体在此外压下的沸点。

液体饱和蒸汽压的测定实验报告
实验一
实验目的:
本实验旨在使用气体计/沸点仪测量液体饱和蒸汽压(SVP),比较实验室和理论值,了解液体沸点的变化会如何影响SVP。
实验原理:
液体饱和蒸汽压(SVP)是液体/蒸汽体系中液体和蒸汽的均衡温度,给定温度下,系统的饱和蒸汽压由系统中液体的饱和蒸汽压和系统中蒸汽的饱和蒸汽压的和求得。
它可以被定义为液体中蒸汽分子的力学平衡的作用,即根据热力学等式,在给定的温度条件下液体和蒸汽的压强相等。
实验材料:
1.烧杯
2.液体样品
3.气体计/沸点仪
实验步骤:
(1)将烧杯放置在气体计/沸点仪上,将液体样品加入烧杯,确保液体样品的温度不低于室温;
(2)将气体计/沸点仪设置为手动模式,调节温度至与室温相当的温度;
(3)将气体计/沸点仪的温度慢慢调节,观察液体样品是否有沸腾的现象,当液体样品沸腾时,检测气体计/沸点仪的读数,确定其对应的饱和蒸汽压;
(4)重复以上步骤,用不同的温度设置测量液体饱和蒸汽压;。

实验二液体饱和蒸汽压的测定一、实验目的与要求:对液体饱和蒸汽压与温度的关系作实验上的研究。
根据建立起的经验方程式,求算液体的平均摩尔汽化热。
二、预习要求:1、明确蒸气压、正常沸点、沸腾温度的含义;了解动态法测定蒸气压的基本原理。
2、了解真空泵、气压计的使用及注意事项。
3、了解如何检漏及实验操作时抽气、放气的控制。
三、实验原理:在封闭体系中,液体很快和它的蒸汽达到平衡。
这时的蒸汽的压力称为液体的饱和蒸汽压。
蒸发一摩尔液体需要吸收的热量,即为该温度下液体的摩尔汽化热。
它们的关系可用克拉贝龙~克劳修斯方程表示:(2-1)D H:摩尔汽化热(J·mol-1) R:气体常数(8.314J·mol-1·K-1)若温度改变的区间不大,D H可视为为常数(实际上D H与温度有关)。
积分上式得:(2-2)或 (2-3)常数,。
(3)式表明与有线性关系。
作图可得一直线,斜率为-B。
因此可得实验温度范围内液体的平均摩尔汽化热D H。
(2-4)当外压为101.325kPa(760mmHg)时,液体的蒸汽压与外压相等时的温度称为液体的正常沸点。
在图上,也可以求出液体的正常沸点。
液体饱和蒸汽压的测量方法主要有三种:1、静态法:在某一固定温度下直接测量饱和蒸汽的压力。
2、动态法:在不同外部压力下测定液体的沸点。
3、饱和气流法:在液体表面上通过干燥的气流,调节气流速度,使之能被液体的蒸汽所饱和,然后进行气体分析,计算液体的蒸汽压。
本实验利用第二种方法。
此法基于在沸点时液体的饱和蒸汽压与外压达到平衡。
只要测得在不同外压下的沸点,也就测得在这一温度下的饱和蒸汽压。
四、仪器和药品:液体饱和蒸汽测定仪1套抽气泵1台福廷式压力计1支加热电炉1个搅拌马达1台1/10°C温度计2支五、装置简介:图2--1中,平衡管由三个相连通的玻璃球构成,顶部与冷凝管相连。
冷凝管与U形压力计6和缓冲瓶7相接。
在缓冲瓶7和安全瓶11之间,接一活塞9,用来调节测量体系的压力。

物理化学实验报告-液体饱和蒸汽压的测定实验二液体饱和蒸汽压的测定摘要:本实验采取动态法,通过测定在不同外部压力下水的沸点来确定不同温度条件下水的饱和蒸汽压同温度的关系。
根据实验结果对克拉贝龙―克劳修斯方程进行了验证,并由此方程计算出纯水的平均摩尔汽化热。
关键词:沸点饱和蒸汽压摩尔汽化热克拉贝龙―克劳修斯方程Experiment No.2: The Determination of SaturatedVapor Pressure of the LiquidAbstract: In this experiment, we determined the boiling point of purewater under different exterior pressures in order to make sure therelationship of saturated vapor pressures and temperature, by using ‘Dyn amic Method’. According to the result, we validate Clapeyron-Clausuis Equation,and then calculated the molar heat of vaporization of pure water.Key words: Saturated vapor pressure Molar heat of vaporizationClausius-Clapeyron Equation Boiling point第 1 页共 11 页物理化学实验报告NO.2 PB07007303王璐1. 前言在封闭体系中,当液相的蒸发速度与相应气相的凝聚速度相等时,体系达到动态平衡,此时的蒸气压为该温度下的饱和蒸气压,液体的饱和蒸气压等于外压时的温度为液体的沸点,因此沸点是随外压变化的,当外压为101325Pa时,称之为正常沸点。

纯液体饱和蒸汽压的测定实验报告一、实验目的1、明确纯液体饱和蒸汽压的定义及其与温度的关系。
2、掌握静态法测定纯液体饱和蒸汽压的原理和方法。
3、学会使用数字压力计和恒温水浴等实验仪器。
4、通过实验数据处理,绘制纯液体饱和蒸汽压与温度的关系曲线,并计算出被测液体在实验温度范围内的平均摩尔汽化热。
二、实验原理在一定温度下,纯液体与其蒸汽达到平衡时的压力称为该温度下液体的饱和蒸汽压。
饱和蒸汽压与温度之间存在一定的关系,克劳修斯克拉佩龙方程给出了它们之间的定量关系:\\ln\frac{P}{P_0} =\frac{\Delta H_{vap}}{R}\left(\frac{1}{T} \frac{1}{T_0}\right)\其中,\(P\)为温度\(T\)时液体的饱和蒸汽压,\(P_0\)为温度\(T_0\)时液体的饱和蒸汽压,\(\Delta H_{vap}\)为液体的摩尔汽化热,\(R\)为摩尔气体常数。
本实验采用静态法测定纯液体的饱和蒸汽压。
即在一定温度下,将被测液体置于一密闭容器中,待液体与其蒸汽达到平衡后,测定此时的蒸汽压力。
通过改变温度,测量不同温度下的饱和蒸汽压,从而绘制出饱和蒸汽压与温度的关系曲线。
三、实验仪器与试剂1、仪器饱和蒸汽压测定装置一套,包括恒温水浴、数字压力计、平衡管等。
真空泵及连接装置。
放大镜。
2、试剂去离子水。
四、实验步骤1、装置安装将平衡管、数字压力计、恒温水浴等按要求连接好。
检查装置的气密性,确保系统无漏气现象。
2、装样取下平衡管,加入适量去离子水,使液面在平衡管的 U 形管内高度适中。
重新安装好平衡管。
3、排除系统中的空气打开真空泵,抽气至数字压力计显示的压力较低时,关闭真空泵和抽气阀。
4、测定不同温度下的饱和蒸汽压设定恒温水浴的温度,待温度稳定后,读取数字压力计的示数,即为该温度下的饱和蒸汽压。
依次升高恒温水浴的温度,重复上述测量步骤,记录不同温度下的饱和蒸汽压数据。

物化实验报告_纯液体饱和蒸气压的测定目录一、实验目的 (2)1. 了解饱和蒸气压的概念及其在物理化学中的重要性 (2)2. 学会使用液体饱和蒸气压测定仪进行实验操作 (3)3. 分析实验数据,计算纯液体的饱和蒸气压 (4)二、实验原理 (4)1. 饱和蒸气压是指在一定温度下,液体与其上方的蒸汽达到动态平衡时,蒸汽所具有的压力52. 纯液体的饱和蒸气压可以通过克劳修斯方程式计算得出 (5)3. 实验通过测量液体在一定温度下的蒸发量,结合已知的液体质量和温度,计算出饱和蒸气压6三、实验仪器与试剂 (7)1. 液体饱和蒸气压测定仪 (7)2. 玻璃器皿 (8)3. 温度计 (9)4. 蒸馏水或待测液体 (9)5. 实验室安全防护用品 (10)四、实验步骤 (11)1. 准备实验器材,确保设备正常运行 (12)2. 根据待测液体的性质,设置实验温度 (13)3. 将液体倒入测定仪的蒸发皿中,注意不要超过最大刻度 (14)4. 连接好实验装置,打开电源,开始加热 (14)5. 观察蒸发皿内的液体变化,记录蒸发量、液体质量和温度 (15)6. 当液体蒸发完毕后,关闭电源,停止加热 (16)7. 根据实验数据,计算纯液体的饱和蒸气压 (17)五、实验数据记录与处理 (18)1. 记录实验过程中的蒸发量、液体质量和温度数据 (18)2. 将数据整理成表格,便于后续分析 (19)3. 利用克劳修斯方程式计算纯液体的饱和蒸气压 (19)六、实验结果与分析 (20)1. 展示实验数据,分析纯液体饱和蒸气压的变化趋势 (20)2. 与其他已知数据进行对比,验证实验结果的准确性 (21)3. 分析影响实验结果的因素,提出改进建议 (22)七、实验总结与讨论 (23)1. 总结实验过程,回顾实验要点 (24)2. 讨论实验中遇到的问题和解决方法 (25)3. 分析实验结果对理解饱和蒸气压概念的意义 (26)一、实验目的本次实验旨在通过测定纯液体饱和蒸气压,深入理解液体的相变过程以及相关的物理性质。

液体饱和蒸气压的测定的实验报告
通过测定不同温度下水的液体饱和蒸气压,探究饱和蒸气压与温度的关系,并验证水的饱和蒸气压遵循克劳修斯-克拉佩龙方程。
实验原理:
液体饱和蒸气压是指液体表面和其中气态分子相平衡时形成的蒸气压力。
克劳修斯-克拉佩龙方程描述了饱和蒸气压和温度之间的关系:
ln(P/P0) = -ΔHvap/R * (1/T - 1/T0)
其中,P为温度为T时的饱和蒸气压,P0为温度为T0时的饱和蒸气压,ΔHvap为液体的汽化热,R为气体常数。
实验步骤:
1. 准备好实验器材:玻璃管、温度计、水槽、蒸气压计、橡皮塞等。
2. 将玻璃管充满水,并将橡皮塞放在管口上,将水管放入水槽中。
3. 将蒸气压计与玻璃管相连,使其处于静态状态下,等待蒸气压计读数稳定。
4. 测量水槽中的温度,并记录下蒸气压计的读数。
5. 重复以上步骤,在不同温度下进行实验,记录下每次的温度和蒸气压计的读数。
6. 根据克劳修斯-克拉佩龙方程计算出每个温度下的饱和蒸气压值。
实验结果:
根据实验数据,可以绘制出饱和蒸气压与温度的关系曲线,验证克劳修斯-克拉佩龙方程的正确性。
同时,还可以比较不同液体的饱和蒸气压值,探究其物理化学性质的差异。
实验结论:
本实验通过测量不同温度下水的液体饱和蒸气压,验证了克劳修斯-克拉佩龙方程的正确性。
同时,还可以应用该方程计算出其他液体的饱和蒸气压值,进一步探究液体的物理化学性质。
液体饱和蒸气压的测定一、实验目的(1)测定乙酸乙酯在不同温度下的饱和蒸气压。
(2)求出所测温度范围内乙酸乙酯的平均摩尔气化焓。
二、实验原理(1)饱和蒸气压:在一定的温度下与纯液体处于平衡状态时的蒸汽压力,称为该温度下的饱和蒸汽压。
如果将气相视为理想气体时,对有气相的两相平衡可用克拉贝龙方程来表示:2ln vap mH d p dT RT ∆=(1) 若温度变化范围较小,v a p m H ∆可近似看成一常数,对(1)式积分得:1ln(/)/vap mH p Pa C R T K∆=-⋅+ (2)由(2)式可知ln p 与1T 为直线关系,以ln p 为纵坐标,1T为横坐标作图得到一条直线,从直线的斜率可以求得所测温度范围内液体的平均摩尔汽化焓。
(2)不同温度下的饱和蒸气压是使用等压计来直接测定的。
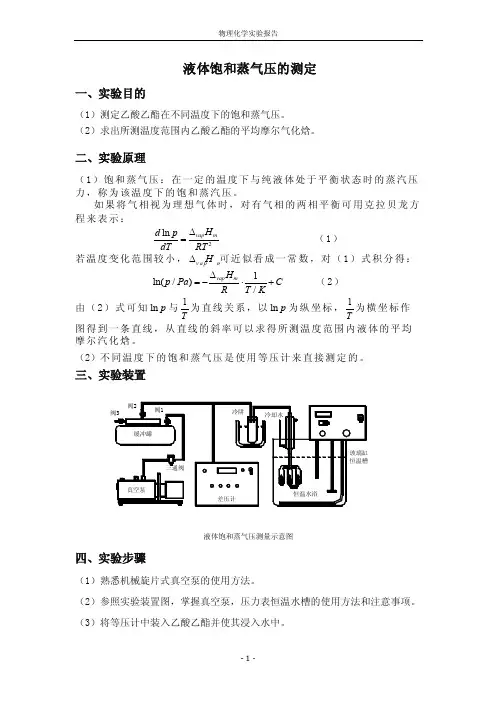
三、实验装置差压计玻璃缸恒温槽冷阱冷却水恒温水浴真空泵缓冲罐阀1阀2阀3三通阀液体饱和蒸气压测量示意图四、实验步骤(1)熟悉机械旋片式真空泵的使用方法。
(2)参照实验装置图,掌握真空泵,压力表恒温水槽的使用方法和注意事项。
(3)将等压计中装入乙酸乙酯并使其浸入水中。
(4)装置系统检漏:冷凝管通冷凝水。
关闭阀1,打开2,3,使系统通大气,将压力表置零。
启动真空泵。
关闭阀3,使真空泵与系统相通,缓慢打开阀1,使系统减压。
当读数为—40到—50千帕时,关闭阀1,若压力表读数变化小于0.1千帕每分钟,则认为不漏气,打开阀3,是系统通气。
(5)读取此时大气压值。
(6)调节恒温水浴至第一个设定温度。
(例如35℃)(7)关闭阀3,缓慢打开阀1,使系统减压抽气。
使A管中液体中的空气和AB 管间的空气通过BC间液体成气泡装溢出。
继续减压,使A管中液体气化,随空气一起溢出,当待测液体的蒸气通过冷凝管时被冷凝回流。
通过调节阀1来控制抽气的速度。
(8)抽气几分钟后,关闭阀1,缓慢打开阀2,直到BC管内液面在同一高度,从压力表上读数。
液体饱和蒸汽压的测定实验报告英文回答:Experiment on Determining the Saturated Vapor Pressure of Liquid.Objective:The objective of this experiment is to determine the saturated vapor pressure of a liquid using the static method.Materials:Liquid sample.Thermometer.Barometer.Vacuum pump.Vacuum flask.Manometer.Dew point apparatus.Procedure:1. Assemble the apparatus as shown in the diagram.2. Evacuate the vacuum flask using the vacuum pumpuntil the pressure inside the flask is close to zero.3. Close the valve to the vacuum pump.4. Introduce the liquid sample into the vacuum flask.5. Heat the liquid sample slowly using a heating mantle or hot water bath.6. Observe the temperature of the liquid sample and the pressure inside the vacuum flask using the thermometer and manometer, respectively.7. Record the temperature and pressure data at regular intervals until the liquid sample reaches its boiling point.8. Determine the saturated vapor pressure of the liquid sample at each temperature by using the following equation:P = P_atm + P_man.where:P is the saturated vapor pressure.P_atm is the atmospheric pressure.P_man is the manometer reading.9. Plot a graph of the saturated vapor pressure versus temperature.Results:The graph of the saturated vapor pressure versus temperature should show a linear relationship. The slope of the graph represents the rate of change of the saturated vapor pressure with temperature.Conclusion:The experiment successfully determined the saturated vapor pressure of the liquid sample at various temperatures. The results can be used to predict the behavior of theliquid sample under different conditions, such as in avapor-compression refrigeration system.中文回答:液体饱和蒸汽压测定实验报告。
液体饱和蒸汽压的测定实验报告液体饱和蒸汽压的测定实验报告引言:液体饱和蒸汽压是指在一定温度下,液体与其蒸汽之间达到平衡时的压强。
测定液体饱和蒸汽压的实验是研究物质相变性质的重要方法之一。
本实验旨在通过测定不同温度下某种液体的饱和蒸汽压,探究温度对饱和蒸汽压的影响,并验证饱和蒸汽压与温度之间的关系。
实验原理:液体蒸发过程中,蒸发速率与液体表面上蒸发的分子数目成正比。
当液体表面上的蒸发速率与液体内部的凝结速率相等时,液体与蒸汽之间达到平衡,此时的压强即为饱和蒸汽压。
根据这一原理,我们可以通过测定液体与其蒸汽平衡时的压强来确定饱和蒸汽压。
实验仪器和药品:1. 温度计:用于测量温度。
2. 烧瓶:用于装载液体样品。
3. U型玻璃管:用于测量液体与蒸汽平衡时的压强差。
4. 液体样品:选择一种适合的液体作为实验样品。
实验步骤:1. 准备工作:将烧瓶清洗干净,确保无杂质。
选择一种液体样品,并将其倒入烧瓶中。
2. 测量温度:将温度计插入液体中,记录下初始温度。
3. 测量压强差:将U型玻璃管的一端插入烧瓶中,另一端放在室温下。
待液体与蒸汽平衡后,观察U型玻璃管两侧的水平面高度差,并记录下来。
4. 改变温度:将烧瓶放置在恒温水浴中,提高温度。
每隔一定温度间隔,重复步骤2和步骤3,记录下相应的温度和压强差。
5. 绘制实验结果:根据测得的温度和压强差数据,绘制出温度与饱和蒸汽压之间的关系曲线。
实验结果与分析:根据实验数据绘制的温度与饱和蒸汽压之间的关系曲线,可以看出两者呈正相关关系。
随着温度的升高,饱和蒸汽压也随之增加。
这符合热力学理论中的饱和蒸汽压与温度之间的关系。
结论:通过本实验的测量与分析,我们得出了液体饱和蒸汽压与温度之间的关系。
实验结果表明,随着温度的升高,液体的饱和蒸汽压也随之增加。
这一实验结果与热力学理论相符合。
实验中可能存在的误差:1. 温度计的精度限制了测量温度的准确性。
2. U型玻璃管的读数误差可能会影响到压强差的测量结果。
物化实验报告_纯液体饱和蒸气压的测定实验目的1. 了解纯液体饱和蒸气压的概念,掌握其测定方法。
2. 通过实验了解温度对纯液体饱和蒸气压的影响规律。
3. 掌握实验测量中需要使用的各种仪器的使用方法。
实验原理饱和蒸气压是指在一定温度下液体和气体达到平衡时,气体所产生的压强,与该温度的一种有确定的关系,称之为该温度下该液体的饱和蒸气压。
多数情况下,饱和蒸气压与温度成正比关系。
玻意耳定律指出,液体的饱和蒸气压等于温度的函数,即P=f(T)。
本实验主要通过使用玻意耳装置,测定苯、乙醚、乙酸乙酯等三种液体在不同温度下的饱和蒸气压,并对其进行对比分析,探讨液体种类及温度对其饱和蒸气压的影响。
实验器材1. 玻意耳装置2. 恒温槽3. 手动电动抽气泵4. 夹子和200ml试管5. 热水浴装置实验步骤1. 将玻意耳装置组装好并进行漏气测试(具体步骤可参考附录1)。
2. 装好试管,并将三种液体分别加入到试管中至1/4 — 1/3 的高度,避免试管过满。
3. 将试管用夹子固定到玻意耳装置中,并紧密封闭。
4. 按照以下温度值进行实验测量:苯(50℃、55℃、60℃、65℃、70℃)、乙醚(20℃、25℃、30℃、35℃、40℃)和乙酸乙酯(20℃、25℃、30℃、35℃、40℃)。
5. 在每个温度下,依次进行以下步骤:(1)调节恒温槽的温度至设定值,记下所设定的值。
(2)等待液体和气体达到平衡后,先用电动抽气泵抽出装置内的空气,然后切换至手动模式,在超高真空状态下,记录下温度和室内压强值。
(3)观察室内压强值的稳定时间,稳定20分钟后,每隔1-2分钟记录一次室内压强值,直至压强不再变化为止,记录最后一次压强值。
(4)将试管从玻意耳装置中取出,并记录试管中液面高度。
(5)将室内压强、液体所在温度和液面高度的数据记录下来后,计算出液体的蒸气压强和归一化的蒸气压强P/P0(P0为液体在标准大气压下的蒸气压强)。
6. 完成实验后,按照实验室规定归还实验器材、清洗工作台等。
液体饱和蒸气压测定实验报告液体饱和蒸气压测定实验报告实验目的:了解饱和蒸气压的概念,学习测量液体饱和蒸气压的方法及计算过程,掌握实验操作技能,加深对气态物质热力学性质的认识。
实验原理:饱和蒸气压是指在一定温度下,液体表面上达到动态平衡时饱和蒸气的压强。
当液体表面饱和蒸气达到一定压强时,液体中的分子从液态转化为气态,气态中的分子又会返回液态,这样就形成了饱和蒸气压的平衡状态。
实验步骤:1. 预备工作:准备好实验器材及试剂,根据实验要求掌握实验原理及操作步骤。
2. 洁净实验仪器:将用于实验的烧瓶、玻璃滴管和橡皮塞清洗干净,使其干燥,防止实验中杂质的影响。
3. 加热液体:待加热液体置入干净烧瓶中后,在恒温水浴中加热,要保证恒温水浴沸腾时温度不同,防止液体产生沸腾现象。
4. 观察:在恒温水浴沸腾的同时,当液面上升至确定高度时,应观察液面高度并记录,保持液体与恒温水浴保持一致,液面高度不发生变化时调整恒温水浴温度,使液面高度固定不变。
5. 测量:用已知质量的玻璃滴管取适量液体,沿液体表面逐渐加入,每次滴加后待液面达到平衡状态后观察液面高度并记录。
6. 计算:根据测量得到的液面高度及已知液体的密度即可计算出此时的饱和蒸气压。
实验结果:在实验操作中得到实验数据后,计算出饱和蒸气压为X值。
实验分析:通过本次实验我们可以了解到液体饱和蒸气压的概念,学习测量液体饱和蒸气压的方法及计算过程,掌握实验操作技能,加深对气态物质热力学性质的认识。
在实验中应及时记录数据并加以分析,遇到问题及时调整解决,保证实验结果的准确性,同时也增强了我们对实验操作技能的掌握。
实验总结:本次实验通过实验操作及计算,我们可以获得液体饱和蒸气压的测量值,以及对气态物质热力学特性的认识。
在实验过程中也发现了一些问题,例如实验操作的不细致以及实验器材的清洗有待改进等,需要在以后的实验中加以改进。
通过本次实验的学习,我们也加强了实验技能的掌握,提高了实验操作的能力。
纯液体饱和蒸汽压的测量
目的要求
一、
明确纯液体饱和蒸气压的定义和汽液两相平衡的概念,深入了解纯液体饱
和蒸气压与温度的关系公式——克劳修斯-克拉贝龙方程式。
二、
用数字式真空计测量不同温度下环己烷的饱和蒸气压。初步掌握真空实验
技术。
三、
学会用图解法求被测液体在实验温度范围内的平均摩尔气化热与正常沸
点。
实验原理
通常温度下(距离临界温度较远时),纯液体与其蒸气达平衡时的蒸气压称为
该温度下液体的饱和蒸气压,简称为蒸气压。蒸发1mol液体所吸收的热量称为
该温度下液体的摩尔气化热。
液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气
压降低,这主要与分子的动能有关。当蒸气压等于外界压力时,液体便沸腾,此
时的温度称为沸点,外压不同时,液体沸点将相应改变,当外压为1atm
(101.325kPa)时,液体的沸点称为该液体的正常沸点。
液体的饱和蒸气压与温度的关系用克劳修斯-克拉贝龙方程式表示:
2
mvap
dlndRTHT
p
(1)
式中,R为摩尔气体常数;T为热力学温度;ΔvapHm为在温度T时纯液体的摩尔
气化热。
假定ΔvapHm与温度无关,或因温度范围较小,ΔvapHm可以近似作为常数,
积分上式,得:
CTRHp1ln
mvap
(2)
其中C为积分常数。由此式可以看出,以lnp对1/T作图,应为一直线,直线的
斜率为 RHmvap,由斜率可求算液体的ΔvapHm。
静态法测定液体饱和蒸气压,是指在某一温度下,直接测量饱和蒸气压,此
法一般适用于蒸气压比较大的液体。静态法测量不同温度下纯液体饱和蒸气压,
有升温法和降温法二种。本次实验采用升温法测定不同温度下纯液体的饱和蒸气
压,所用仪器是纯液体饱和蒸气压测定装置,如图1所示:
平衡管由A球和U型管B、C组成。平衡管上接一冷凝管,以橡皮管与压
力计相连。A内装待测液体,当A球的液面上纯粹是待测液体的蒸气,而B管与
C管的液面处于同一水平时,则表示B管液面上的(即A球液面上的蒸气压)与加
在C管液面上的外压相等。此时,体系气液两相平衡的温度称为液体在此外压
下的沸点。
图1 液体饱和蒸气压测定装置图
1.恒温槽;2.冷凝管;3.压力计;4.缓冲瓶平衡阀;5. 平衡阀2(通大气用);6. 平
衡阀1(抽真空用);8平衡管
Ⅲ、仪器与试剂
DP-A精密数字压力计,SYP-Ⅲ玻璃恒温水浴,液体饱和蒸气压测定装置,
旋片式真空泵,环己烷。
Ⅳ、实验步骤
1、准备工作。接通冷却水。认识系统中各旋塞的作用。开启进气旋塞(逆时针
旋转“平衡阀2”)使系统与大气相通。读取大气压力p0,以后每半小时读
一次。
2、系统检漏。开启真空泵,2分钟后开启抽气旋塞(逆时针旋转“平衡阀门1”),
关闭进气旋塞(平衡阀门2),使系统减压至压力计读数约为-70 KPa,关闭
抽气旋塞(平衡阀门1)。系统若在5分钟之内压力计读数不变,则说明系
统不漏气。
3、打开玻璃恒温浴“加热器”开关,置于“强加热”、“慢搅拌”,同时接通
SWQP型数字控温仪的电源,显示屏的右下部得“置数”红灯亮,按动×10
和×1按钮,使“设定温度”至30.00℃按动“工作/置数”使水浴升温。
4、水浴温度升至30.00℃后加热方式改为“弱”,稳定三分钟,精确读取水浴
温度。缓慢旋转进气旋塞(平衡阀门2),使平衡管中二液面等高,读取DP-A
精密数字压力计和水浴的温度,记录。
5、分别测定35、40、45、50、55、60、65℃液体的饱和蒸气压。
6、实验完毕,断开电源、水源。
【注意事项】
减压系统不能漏气,否则抽气时达不到本实验要求的真空度。
抽气速度要合适,必须防止平衡管内液体沸腾过剧,致使B管内液体快
速蒸发。
实验过程中,必须充分排除净AB弯管空间中全部空气,使B管液面上空
只含液体的蒸气分子。AB管必须放置于恒温水浴中的水面以下,否则其温度与
水浴温度不同。
测定中,打开进空气活塞时,切不可太快,以免空气倒灌入AB弯管的空
间中。如果发生倒灌,则必须重新排除空气。
纯液体饱和蒸汽压的测量
实验者 赖思香 林晓倩
实验时间
室温 ℃
31.4
大气压/kpa 100.96 100.97 100.95 100.9
6
平均大气压/kPa 100.9
6
序号 1 2 3 4 5 6 7 8
水浴温
度℃ 40.01 44.99 50.00 52.98 55.99 58.02 60.03 61.98
压力差/kPa -75.99 -70.65 -64.47 -60.56 -55.83 -52.73 -49.18 -45.35
蒸汽压
P
/kPa
25.0 30.3 36.5 40.4 45.1 48.2 51.8 55.6
ln P 3.2177 3.4115 3.5970 3.6988 3.8095 3.8760 3.9470 4.0184
1/T*1000 3.193 3.143 3.094 3.066 3.038 3.019 3.001 2.983
直线斜率 -3.80236544
直线截距 15.36
相关系数 1.00
蒸发热
kJ/mol
31.6
正常沸
点℃ 80.8
实验结论:
本试验,初步掌握真空实验技术。深入了解纯液体饱
和蒸气压与温度的关系公式——克劳修斯-克拉贝龙方程
式。利用图像斜率可得出纯液体的摩尔气化热。
。
指导教师批阅意见:
成绩评定:
指导教师签字:
年 月 日
备注:
注:1、报告内的项目或内容设置,可根据实际情况加以调整