液体饱和蒸汽压实验测定
- 格式:doc
- 大小:184.50 KB
- 文档页数:3

实验五液体饱和蒸汽压的测定一、实验目的与要求:对液体饱和蒸汽系作实验上的研究。
根据建立起的经验方程式,求算液体的平均摩尔汽化热。
饱和蒸汽压与温度的关系二、预习要求:1. 明确蒸气压、正常沸点、沸腾温度的含义;了解动态法测定蒸气压的基本原理。
2. 了解真空泵、气压计的使用及注意事项。
3. 了解如何检漏及实验操作时抽气、放气的控制。
三、实验原理:在封闭体系中,液体很快和它的蒸汽达到平衡。
这时的蒸汽的压力称为液体的饱和蒸汽压。
蒸发一摩尔液体需要吸收的热量,即为该温度下液体的摩尔汽化热。
它们的关系可用克拉贝龙~克劳修斯方程表示:dlnp/dTt=Δvap H m/RT2 (1)ΔHm:摩尔汽化热(J·mol-1)R:气体常数(8.314J·mol-1·K-1)若温度改变的区间不大,ΔH可视为为常数(实际上ΔH与温度有关)。
积分上式得:lnp=A’-ΔH m/RT (2)或logP=A-B/T (3)常数A=A’/2.303 ,B=Δvap H m/2.303RT 。
(3)式表明logP与1/T有线性关系。
作图可得一直线,斜率为-B。
因此可得实验温度范围内液体的平均摩尔汽化热ΔH m。
ΔH m=2.303RB (4)当外压为101.325kPa(760mmHg)时,液体的蒸汽压与外压相等时的温度称为液体的正常沸点。
在图上,也可以求出液体的正常沸点。
液体饱和蒸汽压的测量方法主要有三种:1. 静态法:在某一固定温度下直接测量饱和蒸汽的压力。
2. 动态法:在不同外部压力下测定液体的沸点。
3. 饱和气流法:在液体表面上通过干燥的气流,调节气流速度,使之能被液体的蒸汽所饱和,然后进行气体分析,计算液体的蒸汽压。
本实验利用第二种方法。
此法基于在沸点时液体的饱和蒸汽压与外压达到平衡。
只要测得在不同外压下的沸点,也就测得在这一温度下的饱和蒸汽压。
四、仪器和药品:液体饱和蒸汽测定仪1套,抽气泵1台,福廷式压力计1支,加热电炉1个,搅拌马达1台,1/10℃温度计2支。

纯液体饱和蒸汽压的测定实验报告数据实验报告:纯液体饱和蒸汽压的测定一、实验目的与原理本次实验的主要目的是研究纯液体饱和蒸汽压的测定方法,通过实验数据的收集与分析,掌握液体饱和蒸汽压的计算方法,为后续相关研究提供理论依据。
实验原理:液体在一定温度下,当其表面存在足够多的蒸汽分子时,这些蒸汽分子产生的压力达到与大气压力相等的程度,此时液体就达到了饱和状态。
饱和蒸汽压是指在这种状态下,单位时间内逸出的蒸汽分子数与单位时间内返回到液面的蒸汽分子数相等时所形成的压力。
纯液体饱和蒸汽压的测定方法主要有皮尔逊法、亨利定律法和自拟方法等。
二、实验设备与材料1. 设备:实验室恒温水浴、气压计、U形管、滴定管、酒精灯等。
2. 材料:甲醇、乙醇、苯、汽油等有机溶剂,以及去离子水。
三、实验步骤与数据处理1. 皮尔逊法测定纯液体饱和蒸汽压(1)取一定量的有机溶剂,加入去离子水中,使其充分溶解。
(2)将U形管水平放置,一端浸入溶液中,另一端用酒精灯加热至90°C左右。
(3)关闭进气阀,打开排气阀,使U形管内的气体与外界大气相通,待气体稳定后,记录此时的压力值P1。
(4)继续加热U形管,使液体沸腾,记录此时的压力值P2。
(5)重复以上步骤3-4次,取平均值作为实验数据。
2. 亨利定律法测定纯液体饱和蒸汽压(1)取一定量的有机溶剂,加入去离子水中,使其充分溶解。
(2)将U形管水平放置,一端浸入溶液中,另一端用酒精灯加热至90°C左右。
(3)在另一容器中加入一定量的去离子水,并放入气压计测量初始压力值P0。
(4)关闭进气阀,打开排气阀,使U形管内的气体与外界大气相通,待气体稳定后,记录此时的压力值P1。
(5)继续加热U形管,使液体沸腾,记录此时的压力值P2。
(6)根据亨利定律公式:P2 = (P1 + P0) * R * T / (V L),其中R为气体常数,T为温度差,V为U形管内液体的体积,L为U形管内液体的升力。

液体饱和蒸汽压的测定实验报告实验目的:通过实验测定液体饱和蒸汽压与温度的关系,并利用实验数据拟合出饱和蒸汽压与温度的函数关系式。
实验原理:液体饱和蒸汽压是指在一定温度下,液体表面上的蒸汽与液体之间达到动态平衡时的蒸汽压力。
根据克劳修斯-克拉佩龙方程,液体饱和蒸汽压与温度之间存在着一定的函数关系,通常用以下形式表示:lnP = A B/T。
其中,P为饱和蒸汽压,T为温度,A和B为常数。
实验仪器和试剂:1. 饱和蒸气压测定仪。
2. 温度计。
3. 蒸馏水。
4. 实验杯。
实验步骤:1. 将蒸馏水倒入实验杯中,放入温度计。
2. 将实验杯放入饱和蒸气压测定仪中,调节温度,等待温度稳定。
3. 记录相应温度下的饱和蒸汽压力。
4. 重复步骤2-3,直至测定出多组数据。
实验数据处理:根据实验数据,绘制出饱和蒸汽压与温度的曲线图,利用最小二乘法对数据进行拟合,得到函数关系式。
实验结果:经过数据处理和拟合,得到液体饱和蒸汽压与温度的函数关系式为:lnP = 14.53 3816/T。
其中,P的单位为Pa,T的单位为K。
结论:通过实验测定和数据处理,得到了液体饱和蒸汽压与温度的函数关系式。
实验结果与理论值吻合较好,验证了克劳修斯-克拉佩龙方程的适用性。
同时,实验过程中也发现了一些影响实验结果的因素,如温度计的精度和实验杯的材质等,这些因素需要在实际应用中予以考虑。
实验改进:为了提高实验结果的精确度,可以采用更精密的温度计和实验杯,同时在实验过程中要严格控制温度稳定性,减小误差的影响。
参考文献:1. 《物理化学实验》。
2. Smith, J. M., Van Ness, H. C., & Abbott, M. M. (2005). Introduction to chemical engineering thermodynamics. McGraw-Hill.以上是本次液体饱和蒸汽压的测定实验报告,希望对相关领域的研究和实验有所帮助。

液体饱和蒸气压的测定1引言1.1实验目的(1) 运用Clausius-Clapeyron方程,求出所测温度范围内的液体平均摩尔汽化焓及正常沸点(2) 掌握测定饱和蒸气压的方法1.2 实验原理液体的蒸气压与液体的本性以及温度有关。
温度升高时,液体分子平均动能增大,蒸气压上升,反之亦然。
当液体在其温度下的蒸气压等于外界压力时,液体沸腾,这个温度称为液体的沸点。
在外压为p⊖=101.325 kPa下液体的沸点称为标准沸点。
液体的饱和蒸气压与温度的关系由Clausius-Clapeyron方程给出:d(ln p) dT =Δvap H mRT2式中R为摩尔气体常数;T为热力学温度,Δvap H m是温度T下纯液体的摩尔汽化热。
假定Δvap H m与温度无关,对上式积分,可得ln p=−Δvap H m RT+C若将ln p对1/T作图,应该得到一条直线,斜率m=−Δvap H m/R,于是Δvap H m=−Rm在不同温度下测定纯液体的饱和蒸气压,可以推出该液体的摩尔汽化焓和正常沸点了。
2 实验操作2.1 实验用品、仪器及装置实验使用等压管1支,稳压瓶1个,负压瓶1个,恒温槽1套,真空泵1台,干燥管一套,搅拌器一台,压力计1台,数显温度仪。
乙醇(AR)测试装置如图2.1所示(实验中使用数显温度仪)图2.12.2 实验条件实验过程中实验室内温度19.3 °C,相对湿度30%,大气压102.15 kPa2.3 实验操作(1) 装置与装样。
此步骤已在课前完成;(2) 检漏。
将H活塞关上,打开活塞I、F和G,用真空泵抽气到压力计显示的气压为25kPa时,关闭I、F和G。
等片刻后,若压力读数不变说明系统气密性良好;(3) 升温。
开动搅拌器,调节加热器电压在160V左右;(4) 排气。
当水浴温度超过50 °C时,等压管内液体开始沸腾,大量气泡由C管排出。
沸腾3~5 min就可以除去AB间的空气及溶在液体中的空气。
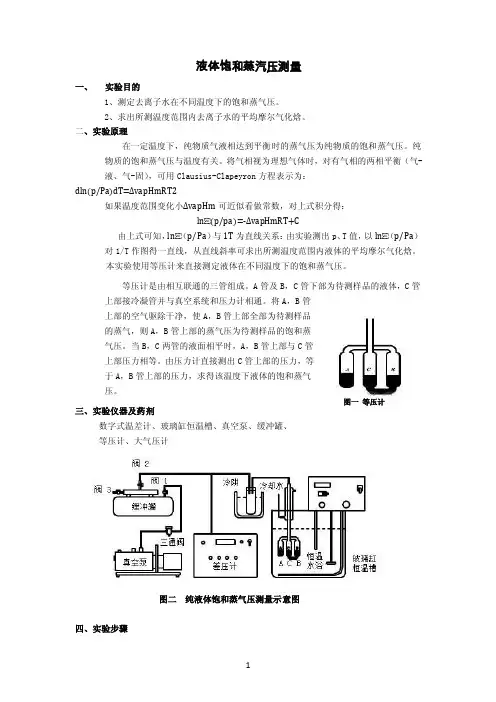
液体饱和蒸汽压测量一、实验目的1、测定去离子水在不同温度下的饱和蒸气压。
2、求出所测温度范围内去离子水的平均摩尔气化焓。
二、实验原理在一定温度下,纯物质气液相达到平衡时的蒸气压为纯物质的饱和蒸气压。
纯物质的饱和蒸气压与温度有关。
将气相视为理想气体时,对有气相的两相平衡(气-液、气-固),可用Clausius-Clapeyron方程表示为:dln(p/Pa)dT=∆vapHmRT2如果温度范围变化小∆vapHm可近似看做常数,对上式积分得:ln(p/pa)=-∆vapHmRT+C由上式可知,ln(p/Pa)与1T为直线关系:由实验测出p、T值,以ln(p/Pa)对1/T作图得一直线,从直线斜率可求出所测温度范围内液体的平均摩尔气化焓。
本实验使用等压计来直接测定液体在不同温度下的饱和蒸气压。
等压计是由相互联通的三管组成。
A管及B,C管下部为待测样品的液体,C管上部接冷凝管并与真空系统和压力计相通。
将A,B管上部的空气驱除干净,使A,B管上部全部为待测样品的蒸气,则A,B管上部的蒸气压为待测样品的饱和蒸气压。
当B,C两管的液面相平时,A,B管上部与C管上部压力相等。
由压力计直接测出C管上部的压力,等于A,B管上部的压力,求得该温度下液体的饱和蒸气压。
图一等压计三、实验仪器及药剂数字式温差计、玻璃缸恒温槽、真空泵、缓冲罐、等压计、大气压计图二纯液体饱和蒸气压测量示意图四、实验步骤1、熟悉实验仪器和装置,按上图所示组装仪器,水浴锅中去离子水不能低于刻度线,冷阱中加入冰水。
2、打开三通阀使得真空泵接大气,打开真空泵电源。
3、检漏:压力计上的冷凝管通冷却水。
打开三通阀并通大气,打开真空泵。
关阀1,开阀2、3,使系统同大气,待差压计示数稳定后按置零按钮,示数变为零。
关阀3,真空泵与系统相通,缓慢开阀1,系统减压。
当压力表读数为-40 ~-50kPa时,关阀1,封闭系统。
观察压力表读数,如果压力表示数在5min中内基本不变或者变幅小于0,2kPa/min则可以判断系统没有漏气,否则系统漏气需要分段检查(此时不要打开恒温水浴锅的加热和搅拌装置,体系内气压对温度很敏感,这样很容易使得示数不稳定而不利于判断。

实验四 纯液体饱和蒸汽压的测定一、实验目的1. 掌握用静态法测定乙醇在不同温度下的饱和蒸汽压。
2. 学会用图解法求被测液体在实验温度围的平均摩尔汽化热与正常沸点。
二、实验原理在一定温度下,与纯液体处于平衡状态时的蒸气压力,称为饱和蒸气压这里的平衡状态是指动态平衡。
在某一温度下,被测液体处于密闭真空容器中,液体分子从表面逃逸而成蒸气,蒸气分子又会因碰撞而凝结成液相,当两者的速率相同时,就达到了动态平衡,此时气相中的蒸气密度不再改变,因而具有一定的饱和蒸气压。
当液体处于沸腾状态时,其上方的压力即为其饱和蒸气压。
温度不同,分子从液体逃逸的速度不同,因此饱和蒸气压不同。
饱和蒸气压与温度的关系可用克-克方程来表示:2ln{p }vap m H d dT RT *∆= (2-1)式中 p *——液体在温度T 时的饱和蒸气压,Pa ;T ——热力学温度,K ;Δvap H m ——液体的摩尔汽化热,J ·mol -1;R ——摩尔气体常,8.314 K -1·mol -1。
如果温度的变化围不大,Δvap H m 视为常数,可当作平均摩尔汽化热。
对式(2-1)进行积分得:ln vap mH p C RT *-∆=+ (2-2)式中c 为积分常数,此数与压力p *的单位有关。
此式表示在一定温度围,液体饱和蒸气压的对数值与温度的倒数成正比。
如果测定出液体在各温度下的饱和蒸气压,以lnp*对1/T作图,可得一条直线,根据直线斜率可求出液体的平均摩尔汽化热。
当外压为101.325kPa时,液体的蒸气压与外压相等时的温度称为该液体的正常沸点。
在图中,将该直线外推到压力为常压时的温度,即为液体的正常沸点。
测定液体饱和蒸气压的方法有三种,分别为动态法、静态法和饱和气流法。
动态法是指在连续改变体系压力的同时测定随之改变的沸点;静态法是指在密闭体系中改变温度而直接测定液体上方气相的压力;饱和气流法是在一定的液体温度下,采用惰性气体流过液体,使气体被液体所饱和,测定流出的气体所带的液体物质的量而求出其饱和蒸气压。


实验D-4 液体的饱和蒸汽压测定(大气压力计的使用)实验目的1. 测定苯在不同温度下的饱和蒸气压,求其平均摩尔气化热。
2. 掌握大气压力计使用方法,实验原理在一定温度下,气液达平衡时的蒸气压叫做饱和蒸气压,蒸发一摩尔液体所需要吸收的热量称为该温度下液体的摩尔气化热。
蒸气压随着绝对温度的变化率服从克拉贝龙方程 ()g l dp H dT T V V ∆=- 式中:ΔH 为温度为T 时纯液体的摩尔气化热,V g 和V l 分别为一摩尔气体和液体的体积。
若气体可视为理想气体,和气体体积比较,液体体积可忽略,并假设温度变化范围不大,摩尔气化热可近似看做常数,将上式积分得 122121ln p H T T p R T T ∆-=∙ 或 1ln H p B R T ∆=-⨯+ 式中:R 为气体普适常数,B 为积分常数。
此式称为克劳修斯-克拉贝龙方程式,若以升华热代替气化热,此式也适用气固两相平衡。
从上式可以看出用实验测得不同温度下液体饱和蒸气压P ,且用lnP 对1/T 作图,应为一直线,从其斜率可求得摩尔气化热。
测定液体饱和蒸气压的方法有两类:(1)静态法,测量在某一温度下饱和蒸气压。
或间接测量,在一定外界压力测量其沸点.(2)饱和气流法:使干燥的惰性气流通过被测物质,并使其为被测物质所饱和,然后测定所通过气体中被测蒸气的含量,就可以根据分压定律算出此被测物质的饱和蒸气压。
仪器与试剂封闭式电炉,电动搅拌器,大烧杯,冷凝管与等张计,真空泵,缓冲瓶,水银温度计,DP-A 数字压力计,分析纯苯。
本实验采用静态法中的直接测量在某一温度下的饱和蒸气压。
实验步骤图D4-1等张计测量饱和蒸汽压装置实验装置见图D4-1其中平衡管(又称等张计)是由三个相连的玻璃管a ,b 和c 组成。
a 管储存液体.b管和c 管中液体在底部相通。
当a 管和b 管上部是待测液体的蒸气,如b 管和c 管中液面在同一水平,则表示加在b 管液面上的蒸气压与加在c 管液面上的外压相等。

实验四-纯液体饱和蒸汽压的测定实验四纯液体饱和蒸汽压的测定一、实验目的1.理解饱和蒸汽压的概念及物理意义。
2.掌握饱和蒸汽压测定的基本原理和方法。
3.学习使用蒸汽压测定仪,提高实验技能。
4.观察并理解饱和蒸汽压与温度的关系。
二、实验原理饱和蒸汽压是指一定温度下,纯液体与其蒸气达到动态平衡时的蒸汽分压强。
当液体的温度升高时,其分子运动加剧,动能增加,使得液体分子蒸发到其蒸气中的速率增加,而当蒸气中的分子凝结到液体表面时,也形成了一定的阻碍。
当这两个过程达到平衡时,液体的蒸汽压力保持在一个固定值,即为饱和蒸汽压。
在一定的压力下,随着温度的升高,液体的饱和蒸汽压也会升高。
根据这个原理,我们可以利用温度与饱和蒸汽压的关系,通过测定不同温度下的饱和蒸汽压,绘制出饱和蒸汽压随温度变化的曲线,从而得到液体饱和蒸汽压与温度的关系。
三、实验步骤1.准备好实验所需的仪器和试剂,包括纯液体、温度计、真空泵、压力计、蒸馏瓶等。
2.将蒸馏瓶置于恒温水浴中,使液体温度保持恒定。
将压力计连接到蒸馏瓶的侧口,记录压力读数。
3.在恒定的温度下,通过真空泵缓慢降低蒸馏瓶内的压力,使液体逐渐蒸发。
在每个较低压力下保持几分钟以建立饱和蒸汽压。
4.逐渐提高压力,记录每个压力下的温度值,直到压力不再升高,即可停止实验。
5.根据实验数据绘制出饱和蒸汽压随温度变化的曲线。
四、数据分析1.对于每一个压力和温度值,我们可以计算其对应的饱和蒸汽压。
例如,当温度为T1时,压力P1下的饱和蒸汽压为P1(T1);当温度为T2时,压力P2下的饱和蒸汽压为P2(T2),以此类推。
2.将所有压力和温度下的饱和蒸汽压数据整理成表格,便于观察和分析。
3.使用Excel或其他绘图软件将表格中的数据转化为图形,绘制出饱和蒸汽压与温度的关系曲线。
五、实验结论通过本次实验,我们成功地测量了纯液体在不同压力和温度下的饱和蒸汽压数据,并绘制出了饱和蒸汽压与温度的关系曲线。
通过对比不同条件下(例如不同压力、不同温度)的饱和蒸汽压数据,可以发现纯液体的饱和蒸汽压与温度存在明显的相关性:随着温度的升高,饱和蒸汽压也相应增加;反之亦然。

实验八液体饱和蒸气压的测定【摘要】本文的目的是学习和掌握测定液体在不同温度下的饱和蒸气压的方法,加深对克拉佩龙-克劳修斯方程的认识和理解。
采用了动态法,测定了乙醇的饱和蒸气压。
实验结果表明,乙醇的摩尔汽化热∆vap H m=41.50 k J∙mol−1,沸点T=349.36K=76.36℃。
结果说明,实验方法正确。
【前言】在温度T下的一个真空密闭容器中,当液体分子从表面蒸发逃逸和蒸气分子向液面凝结的速度相等时,我们就认为液体和它的蒸气处于动态平衡。
此时液面上的蒸气压力就是液体在温度T时的饱和蒸气压。
液体的饱和蒸气压与温度有一定的关系:当温度升高时,分子运动加剧,因面单位时向内从液面逸出的分子数增加,蒸气压增大;反之,温度降低时蒸气压减小。
当蒸气压与外界压力相等时,液体便开始沸腾,外压不同时液体的沸点也不同。
我们把外压为1个大气压(101325Pa)时的沸腾温度称为液体的正常佛点。
根据克拉佩龙方程,气液两相的平衡温度T与平衡压力p之间存在如下关系:dp dT =∆vap H m T(V g−V l)其中∆vap H m为纯液体在温度T时的摩尔汽化热,V g和V l分别为气相和液相的摩尔体积。
在远离临界温度时,V g≫V l。
若把蒸气视为理想气体,则V g=RT p⁄,那么克拉佩龙方程就变成克拉佩龙-克劳修斯方程,即:d㏑p dT =∆vap H mRT2当温度范围变化不大时可忽略温度对∆vap H m的影响。
对上式变形并积分可得:ln p=−∆vap H m+C即:ln p=A+C其中,A=−∆vap H m/R;C为积分常数。
由上式可以看出,若根据实验结果用Inp对1/T作图可得一条直线,其中斜率为A。
根据斜率便可求出摩尔汽化热。
测定液体饱和蒸气压的方法有如下三类:动态法、静态法、饱和气流法;本次实验采用动态法测定乙醇的饱和蒸气压,即:在不同外界压力下,测定其沸点。
【正文】一、仪器和试剂液体饱和蒸气压的测定装置、福廷式大气压力计、真空泵、数字压差计、温度计、电热水壶、无水乙醇。

实验一液体饱和蒸汽压的测定一、实验目的1、明确饱和蒸气压的定义,了解纯液体的饱和蒸气压与温度的关系和克劳修斯-克拉贝龙(Clausius-Clapeyron)方程式的意义。
2、掌握静态法测定液体饱和蒸气压的原理及操作方法。
作P-1/T直线,由直线的斜率求出液体的摩尔气化焓。
3、学会蒸气压的测量技术和压力计的使用。
二、实验原理通常温度下(距离临界温度较远时),密闭真空容器中的纯液体与其蒸气达平衡时的蒸气压称为该温度下液体的饱和蒸气压,简称为蒸气压。
恒压条件下蒸发1mol液体所吸收的热量称为该温度下液体的摩尔气化热。
液体的蒸气压随温度而变化,温度升高时,蒸气压增大;温度降低时,蒸气压降低。
当蒸气压等于外界压力时,液体便沸腾,此时的温度称为沸点,外压不同时,液体沸点将相应改变,当外压为101.325kPa时,液体的沸点称为该液体的正常沸点。
单位物质的量的液体蒸发过程的焓变,即为该液体的摩尔气化焓。
由热力学理论我们知道,液体饱和蒸气压随温度变化的定量关系,可由克劳修斯-克拉贝龙(Clausius-Clapeyron)方程给出:=式中:P——液体在温度T时的饱和蒸气压,R——气体常数,R=8.314J·K-1·mol-1。
在温度较小的变化范围内,可视为与温度无关,积分上式可得:由上式可知,若以对作图应得一直线,直线的斜率由此得到:由实验测定几个不同温度下饱和蒸气压,用图解法求得直线的斜率m,根据上式即可求出。
不同物质具有不同蒸汽压,有时相差很大,且大多数物质的蒸汽分子组成与其凝聚态不完全相同。
另外,因为各组分挥发性的不同,所以测定中很难长时间地维持成分稳定,鉴于以上这些特点,特别是压力大小的不同,必须对蒸汽压采用多种测定方法,以保证测量的准确度,一般当压力大于130Pa时,采用直接测量法、相变法和气流携带法;当压力小于130Pa时,通常采用自由蒸发法、喷射法和克努森喷射——高温质谱仪联合法。
液体饱和蒸汽压测定实验报告实验目的:1、了解液体的饱和蒸汽压与温度的关系。
2、掌握液体饱和蒸汽压的测量方法。
实验原理:液体的饱和蒸汽压是指在特定温度下,液体与其蒸汽达到平衡时的气压。
饱和蒸汽压随温度的升高而增大。
常用的液体饱和蒸汽压测定方法有饱和蒸汽法和开水法。
实验仪器和材料:1、饱和蒸汽压计2、恒温槽3、温度计4、水5、饱和盐溶液(如氯化钠溶液)6、玻璃棒7、蒸馏水实验步骤:1、将饱和蒸汽压计的竖柱充满水,将底部的开口放入恒温槽中并将其与恒温槽连接。
2、在恒温槽中加入饱和盐溶液,并用玻璃棒搅拌均匀,使溶液温度保持恒定。
3、读取恒温槽中的温度,并在饱和蒸汽压计的刻度尺上找到相应的温度刻度位置。
4、根据温度刻度位置,读取饱和蒸汽压计上的压强值。
5、重复以上步骤,记录不同温度下的饱和蒸汽压值。
实验数据:温度(摄氏度)饱和蒸汽压(千帕)-----------------------------202.34253.18304.25355.49406.88实验结果:通过实验数据可以看出,液体的饱和蒸汽压随温度的升高而增大。
在本实验中,温度从20摄氏度增加到40摄氏度,饱和蒸汽压增加了大约4倍。
实验讨论:1、实验中是否存在误差?如果存在误差,可能是由什么原因导致的?实验中可能存在误差。
误差可能来自于温度读取的不精确以及饱和蒸汽压计的刻度不准确。
此外,实验过程中的温度波动和压强计的漏气也可能导致误差。
2、在实验中,我们使用了饱和盐溶液来保持恒温槽的温度,请问为什么使用饱和盐溶液而不是普通水?饱和盐溶液可以提供更稳定的温度,因为其具有较高的沸点和凝固点。
普通水在达到其沸点和凝固点之前可能发生相变,导致温度不稳定。
3、在实验中如何保持实验环境的稳定性?为保持实验环境的稳定性,需要使用恒温槽来控制温度。
此外,还需谨慎操作,避免外界因素对实验环境的影响。
实验结论:通过本实验,我们了解到液体的饱和蒸汽压与温度的关系,并掌握了液体饱和蒸汽压的测量方法。
液体饱和蒸汽压的测定实验报告液体饱和蒸汽压的测定实验报告引言:液体饱和蒸汽压是指在一定温度下,液体与其蒸汽之间达到平衡时的压强。
测定液体饱和蒸汽压的实验是研究物质相变性质的重要方法之一。
本实验旨在通过测定不同温度下某种液体的饱和蒸汽压,探究温度对饱和蒸汽压的影响,并验证饱和蒸汽压与温度之间的关系。
实验原理:液体蒸发过程中,蒸发速率与液体表面上蒸发的分子数目成正比。
当液体表面上的蒸发速率与液体内部的凝结速率相等时,液体与蒸汽之间达到平衡,此时的压强即为饱和蒸汽压。
根据这一原理,我们可以通过测定液体与其蒸汽平衡时的压强来确定饱和蒸汽压。
实验仪器和药品:1. 温度计:用于测量温度。
2. 烧瓶:用于装载液体样品。
3. U型玻璃管:用于测量液体与蒸汽平衡时的压强差。
4. 液体样品:选择一种适合的液体作为实验样品。
实验步骤:1. 准备工作:将烧瓶清洗干净,确保无杂质。
选择一种液体样品,并将其倒入烧瓶中。
2. 测量温度:将温度计插入液体中,记录下初始温度。
3. 测量压强差:将U型玻璃管的一端插入烧瓶中,另一端放在室温下。
待液体与蒸汽平衡后,观察U型玻璃管两侧的水平面高度差,并记录下来。
4. 改变温度:将烧瓶放置在恒温水浴中,提高温度。
每隔一定温度间隔,重复步骤2和步骤3,记录下相应的温度和压强差。
5. 绘制实验结果:根据测得的温度和压强差数据,绘制出温度与饱和蒸汽压之间的关系曲线。
实验结果与分析:根据实验数据绘制的温度与饱和蒸汽压之间的关系曲线,可以看出两者呈正相关关系。
随着温度的升高,饱和蒸汽压也随之增加。
这符合热力学理论中的饱和蒸汽压与温度之间的关系。
结论:通过本实验的测量与分析,我们得出了液体饱和蒸汽压与温度之间的关系。
实验结果表明,随着温度的升高,液体的饱和蒸汽压也随之增加。
这一实验结果与热力学理论相符合。
实验中可能存在的误差:1. 温度计的精度限制了测量温度的准确性。
2. U型玻璃管的读数误差可能会影响到压强差的测量结果。
液体饱和蒸气压测定实验报告液体饱和蒸气压测定实验报告实验目的:了解饱和蒸气压的概念,学习测量液体饱和蒸气压的方法及计算过程,掌握实验操作技能,加深对气态物质热力学性质的认识。
实验原理:饱和蒸气压是指在一定温度下,液体表面上达到动态平衡时饱和蒸气的压强。
当液体表面饱和蒸气达到一定压强时,液体中的分子从液态转化为气态,气态中的分子又会返回液态,这样就形成了饱和蒸气压的平衡状态。
实验步骤:1. 预备工作:准备好实验器材及试剂,根据实验要求掌握实验原理及操作步骤。
2. 洁净实验仪器:将用于实验的烧瓶、玻璃滴管和橡皮塞清洗干净,使其干燥,防止实验中杂质的影响。
3. 加热液体:待加热液体置入干净烧瓶中后,在恒温水浴中加热,要保证恒温水浴沸腾时温度不同,防止液体产生沸腾现象。
4. 观察:在恒温水浴沸腾的同时,当液面上升至确定高度时,应观察液面高度并记录,保持液体与恒温水浴保持一致,液面高度不发生变化时调整恒温水浴温度,使液面高度固定不变。
5. 测量:用已知质量的玻璃滴管取适量液体,沿液体表面逐渐加入,每次滴加后待液面达到平衡状态后观察液面高度并记录。
6. 计算:根据测量得到的液面高度及已知液体的密度即可计算出此时的饱和蒸气压。
实验结果:在实验操作中得到实验数据后,计算出饱和蒸气压为X值。
实验分析:通过本次实验我们可以了解到液体饱和蒸气压的概念,学习测量液体饱和蒸气压的方法及计算过程,掌握实验操作技能,加深对气态物质热力学性质的认识。
在实验中应及时记录数据并加以分析,遇到问题及时调整解决,保证实验结果的准确性,同时也增强了我们对实验操作技能的掌握。
实验总结:本次实验通过实验操作及计算,我们可以获得液体饱和蒸气压的测量值,以及对气态物质热力学特性的认识。
在实验过程中也发现了一些问题,例如实验操作的不细致以及实验器材的清洗有待改进等,需要在以后的实验中加以改进。
通过本次实验的学习,我们也加强了实验技能的掌握,提高了实验操作的能力。
实验四 液体饱和蒸汽压的测定
一、实验目的
1.了解纯液体的饱和蒸气压与温度的关系,理解Clausius- Clapeyron 方程的意义; 2.掌握静态法测定不同温度下乙醇饱和蒸气压的方法,学会用图解法求被测液体在实验温度范围内的平均摩尔气化焓;
3.初步掌握真空实验技术、进一步熟悉恒温槽及气压计的使用方法。
二、实验原理 /
/
饱和蒸气压:在真空容器中,液体与其蒸气建立动态平衡时(蒸气分子向液面凝结和液体分子从表面逃逸的速率相等)液面上的蒸气压力为饱和蒸气压。
温度升高,分子运动加剧,单位时间内从液面逸出的分子数增多,所以蒸气压增大。
饱和蒸气压与温度的关系服从 C lausius- Clapeyron 方程:
m m
Vap V T H dT dp ∆∆=*
(4-1)
液体蒸发时要吸收热量,温度T 下,1 mol 液体蒸发所吸收的热量为该物质的摩尔气化焓。
沸点:蒸气压等于外压的温度。
显然液体沸点随外压而变,101.325kPa 下液体的沸点称正常沸点。
对包括气相的纯物质两相平衡系统,因V m (g )≫V m (l ),故 △V m ≈V m (g )。
若气体视为理想气体,则Clausius- Clapeyron 方程式为:
2
RT
H p dT dp m
vap *∆= (4-2)
因温度范围小时,Δvap H *m 可以近似作为常数,将上式积分得:
[]C RT
H p p m vap +∆-=*ln (4-3)
作])/[ln(p p ~1/T 图,得一直线,斜率为 R
H m
*
vap ∆-
,由斜率可求算液体的
Δvap H*m 。
三、实验仪器
饱和蒸气压测定有静态、动态、饱和气三种方法。
本实验采用静态法,
以等压计在不同
1-不锈钢真空包;2-抽气阀;3-真空包抽气阀;4-进气阀;5-DP-A 数字压力表;6-玻璃恒温水浴;7-温度计;8-等压计;9-试样球;10-冷凝管;11-真空橡皮管;12-加样口
温度下测定乙醇的饱和蒸气压。
实验仪器见图4-4,包括恒温水浴;等压计;数字压力计;真空泵及附件。
被测样装入小球9中,以样品作U型管封闭液。
某温度下若小球液面上方仅有被测物的蒸气,则等压计U型管右支液面上所受到的压力就是其蒸气压。
当该压力与U型管左支液面上的空气的压力相平衡(U型管两臂液面齐平)时,就可从与等压计相接的压力计测出在此温度下的饱和蒸气压。
四、实验耗材
无水乙醇。
五、实验步骤
1.装样:从加样口加入2/3体积的无水乙醇,并在U型管内装入一定体积的无水乙醇。
2.按图4-4安装仪器。
3.打开数字压力计电源开关,预热5 min,按下“复位”键,调单位至“mmHg”。
4.关闭进空气口4,打开阀门2,3和真空泵,抽真空2 min~3 min,关闭阀门3,若数字压力计上的数字基本不变,表明系统不漏气,可进行下步实验。
否则应逐段检查,消除漏气因素。
5.打开阀门3,继续抽真空。
这时试样球与U型管之间的空气呈气泡状通过U型管中的液体逸出。
当发现气泡成串逸出时,迅速关闭抽气阀门3(若沸腾不能停止,可缓缓打开进气门4,使少许空气进入系统),2 min~5 min后关闭抽气阀门2。
打开恒温水浴的加热开关,将水温升高至20℃~25℃。
升温时可看到有气泡通过U型管逸出。
6.慢慢打开真空包抽气阀3,使等压计内的溶液缓缓沸腾1 min左右。
缓缓打开进气门4,使少许空气进入。
待等压计左右支管中液面相平时,迅速关闭阀门4,同时读出压力和温度。
计算出所测温度下的饱和蒸气压(p饱和=p大气-p表),并与标准数据比较,误差控制在5 mmHg以内。
若大于此误差,重复此步骤。
7.每次升温2︒C ~3︒C,重复上述操作,测定乙醇在不同温度下的蒸气压。
8.实验结束后,打开阀门3、4,关闭气压计、恒温水浴的开关。
先将系统排空,然后关闭真空泵。
六、实验结果及处理
室温t= ℃大气压p= kPa
1.将实验数据填入表4-4。
注意:饱和蒸气压p* =大气压读数+压差计读数(为负值!)
表4-4 乙醇的饱和蒸气压测定试样数据记录
编号温度/℃表压/mmHg P*/Pa ln(P/[P]) 1
T/K-1
1 2 3
4 5 6
2.以])/[ln(p p 对1/T 作图,得直线,由直线的斜率求出Δvap H m *。
文献值:乙醇的正常沸点78.37℃(351.52K),水的正常沸点为100.0℃。
作图建议: p *~T 图中p *:5 kPa/cm , T : 5 K/cm ; ln p *~1/T 中ln p *:0.1/cm ,1/T :0.02 K -1/cm 。
七、实验注意事项
1.在一定的温度下,真空密闭容器内的液体能很快和它的蒸汽相建立动态平衡,即蒸汽分子
向液面凝结和液体中分子从表面逃逸的速率相等。
此时液面上的蒸汽压力就是液体在此温度下的饱和蒸汽压力。
液体的饱和蒸汽压与温度有关:温度升高,分子运动加速,因而在单位时间内从液相进入气相的分子数增加,蒸汽压升高,所以测定蒸气压时为何要严格控制温度。
排净等压计小球上面的空气,使液面上空只含液体的蒸气分子(如果数据偏差在正常误差范围内,可认为空气已排净)。
但要注意抽气速度不要过快,以防止液封溶液被抽干。
2.等压计中有溶液的部分必须放置于恒温水浴中的液面以下,否则所测溶液温度与水浴温度
不同。
3.待等压计左右支管中液面调平时,一定要迅速关闭阀门4,严防空气倒灌影响实验的进行。
4.在关闭真空泵前一定要先将系统排空,然后关闭真空泵,否则可能使真空泵中的油倒灌入系统。
八、思考题
1.如何判断等位计中试样球与等位计间空气已全部排出?如未排尽空气,对实验有何影响?怎样防止空气倒灌?
2.测定蒸气压时为何要严格控制温度? 3.升温时如液体急剧气化,应作何处理? 4.每次测定前是否需要重新抽气?。