第3章 稳态极化及研究方法
- 格式:ppt
- 大小:3.24 MB
- 文档页数:76



稳态及其调节提要本文介绍了对高等动物内环境稳态及其调节机制方面的基本认识及进展,提出了神经系统、内分泌系统和免疫系统所形成的调节网络是维持稳态的主要机制。
稳态是生理学发展史上早已提出的一个经典概念。
随着生理学及其它学科的发展,这个概念的地位得到巩固和扩展,其内涵也不断充实。
现在,稳态不仅是人体及动物生理学科的基本概念之一,也已成为生命科学的现代概念之一。
人类研究生命现象的主要目的是揭示生命的奥秘,进而为认识自然(包括人类自身)、改造自然服务。
稳态是生命体存在的前提条件,揭示稳态的机制也就成了生命科学研究的一个重要内容。
高等生物具有维持稳态的机制是生物长期进化的结果,现代科学的发展将从不同的角度与不同的水平对其作出解释。
因此,稳态又是一个尚待进一步阐释的现代概念。
1 稳态概念的提出与现代发展1.1 内环境及内环境恒定概念的提出经典稳态概念的形成分别得益于两位著名生理学家的杰出工作。
第一位是法国著名的实验生理学家伯尔纳(C. Bernard);第二位是美国著名生理学家坎农(W. B. Cannon)。
伯尔纳对生理学的研究非常广泛,几乎涉及生理学的每个部分,对生理学的贡献极多,意义最大的是于1857年提出的内环境及内环境恒定概念。
他认为,多细胞生物每一细胞的外液是机体所有细胞生活的直接环境,其整体即构成了机体的内部环境。
内环境不仅为机体所有细胞的营养供应与代谢物的排出提供了中介介质,更重要的是为各种细胞的生存与活动提供了一个较为稳定的理化环境,使得机体外部生活环境的变化难以直接影响各种细胞的生理活动。
在提出内环境概念之后,伯尔纳进一步发现内环境具有自我保持稳定的特性。
这一发现主要依据其对肝脏活动与血糖浓度间存在互动关系的研究结果。
即,肝脏能通过释放或储存葡萄糖来维持血糖浓度的恒定。
伯尔纳认为,“内环境恒定是机体自由和独立生存的首要条件”。
机体内的生理过程与生理机制种类繁多且功能各异,均是机体所不可缺少的,但它们都围绕着一个共同的目标而活动,即维持内环境的稳定。

第3章 电化学极化 (电荷转移步骤动力学)绪论中曾提到:一个电极反应是由若干个基本步骤形成的,一个反应至少有三个基本步骤:00R R ze O O s s →→+→-1) 反应粒子自溶液深处向电极表面的扩散——液相传质步骤。
2) 反应粒子在界面得失电子的过程——电化学步骤。
3) 产物生成新相,或向溶液深处扩散。
当有外电流通过电极时,ϕ将偏离平衡值,我们就说此时发生了极化。
如果传质过程是最慢步骤,则ϕ的偏离是由浓度极化引起的(此时0i s i C C ≠,e ϕ的计算严格说是用s i C 。
无浓度极化时0i s i C C =,ϕ的改变是由s i C 的变化引起)。
这时电化学步骤是快步骤,平衡状态基本没有破坏。
因此反映这一步骤平衡特征的Nernst 方程仍能使用,但须用ϕ代e ϕ,s i C 代0i C ,这属于下一章的研究内容。
如果传质等步骤是快步骤,而电化学步骤成为控制步骤,则这时ϕ偏离e ϕ是由电化学极化引起的,也就是本章研究的内容。
实际上该过程常常是比较慢的,反应中电荷在界面有积累(数量渐增),ϕ随之变化。
由此引起的ϕ偏离就是电化学极化,这时Nernst 方程显然不适用了,这时ϕ的改变将直接以所谓“动力学方式”来影响反应速度。
3.1 电极电位与电化学反应速度的关系电化学反应是一种特殊的氧化—还原反应(一个电极上既有氧化过程,又有还原过程)。
若一个电极上有净的氧化反应发生,而另一个电极上有净的还原反应发生,则在这两个电极所构成的电化学装置中将有电流通过,而这个电流刚好表征了反应速度的大小,)(nFv i v i =∝[故电化学中总是用i 表示v ,又i 为电信号,易测量,稳态下串联各步速度同,故浓差控制也用i 表示v 。
i 的单位为A/cm 2,zF 的单位为C/mol ,V 的单位为mol/(cm 2.s )]。
既然电极上有净的反应发生(反应不可逆了),说明电极发生了极化,ϕ偏离了平衡值,偏离的程度用η表示,极化的大小与反应速度的大小有关,这里就来研究i ~ϕ二者间的关系。


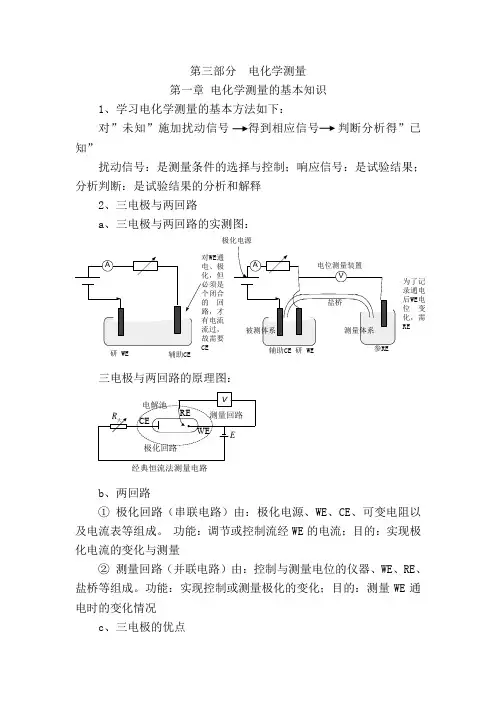
第三部分 电化学测量 第一章 电化学测量的基本知识1、学习电化学测量的基本方法如下:对”未知”施加扰动信号 得到相应信号 判断分析得”已知”扰动信号:是测量条件的选择与控制;响应信号:是试验结果; 分析判断:是试验结果的分析和解释2、三电极与两回路a 、三电极与两回路的实测图:三电极与两回路的原理图:b 、两回路① 极化回路(串联电路)由:极化电源、WE 、CE 、可变电阻以及电流表等组成。
功能:调节或控制流经WE 的电流;目的:实现极化电流的变化与测量② 测量回路(并联电路)由:控制与测量电位的仪器、WE 、RE 、盐桥等组成。
功能:实现控制或测量极化的变化;目的:测量WE 通电时的变化情况c 、三电极的优点研 WE辅助CE通回为了记录通电后WE 电位变化,需RE极化电源经典恒流法测量电路① 可以同时测量极化电流和极化电位; ② 三电极两回路具有足够的测量精度。
d 、两类溶液体系① 被测体系:研究电极所处的溶液体系。
② 测量体系:参比电极所处的溶液体系。
3、三电极体系中各组成部分的作用和要求a 、电解池/容器:是装电解质溶液、WE 、CE 所用,是一种容器,要求稳定性好,不溶出杂质,不与电极物质、电解液发生反应,大部分无机电解质是玻璃的,强碱电解液例外,具体要求如下:① 化学稳定性高;② 体积适中,太小:研究体系浓度变化;太大:浪费。
浓度变化: ,可见c 与J0有关→η。
③ 鲁金Luggin 毛细管距离;太近:电位测不准;太远:较大的欧姆压降;距离(管直径) ,这是半定性半定量关系。
④辅助电极的位置、大小及形状;位置:与WE 平行放置;大小:S CE >5S WE 。
φ研-φ参=φ研-φ界+IR Ω⑥ 恒电位测量中,电解池的内阻要小。
b 、参比电极作用:比较,本身电位的稳定。
应具备的条件:① 可逆电极(浓度不变,电位不变);这是热力学说法,符合Nernst 方程。
② 参比电极是不极化电极(i 0→∞);实际上i 0不可能∞,所以需要控制流经RE 的电流非常小,即:I 测<10-7 A/cm 2。




稳态极化曲线测定镍在硫酸溶液中的钝化⾏为学⽣讲义稳态极化曲线测定镍在硫酸溶液中的钝化⾏为⼀、实验⽬的(1)了解⾦属钝化⾏为的原理和测量⽅法;(2)掌握稳态法测定⾦属钝化曲线的基本⽅法;(3)测定⾦属镍在硫酸介质中的钝化曲线及其维钝电流密度和维钝电位值;(4)测定C1-浓度对Ni钝化的影响;(5)学会处理电极表⾯,了解电极表⾯状态对极化曲线的影响。
⼆、实验原理1、⾦属的钝化在以⾦属作阳极的电解池中,通过电流时,通常会发⽣阳极的电化学溶解过程,其反应式为: M →M n++ n e-在⾦属的阳极溶解过程中,其电极电势必须⼤于其热⼒学电势(即平衡电位),电极过程才能发⽣。
这种电极电势偏离其热⼒学电势的⾏为称为极化。
当阳极极化不⼤时,阳极过程的速率(即溶解电流密度)随着电势变正⽽逐渐增⼤,这是⾦属的正常溶解。
但是在某些化学质介中,当电极电势正到某⼀数值时,其溶解速率达到最⼤,⽽后,阳极溶解速率随着电势变正,反⽽⼤幅度降低,这种现象称为⾦属的钝化。
⾦属钝化⼀般可分为:化学钝化和电化学钝化。
⾦属之所以由活化状态转变为钝化状态,⽬前对此问题有着不同看法:(1)氧化膜理论:在钝化状态下,溶解速度的剧烈下降,是由于在⾦属表⾯上形成了具有保护性的致密氧化物膜的缘故。
(2)吸附理论:这是由于表⾯吸附了氧,形成氧吸附层或含氧化物吸附层,因⽽抑制了腐蚀的进⾏。
(3)连续模型理论:开始是氧的吸附,随后⾦属从基底迁移⾄氧吸附膜中,然后发展为⽆定形的⾦属-氧基结构。
各种⾦属在不同介质或相同介质中的钝化原因不尽相同,因此很难简单地⽤单⼀理论予以概括。
2. 影响⾦属钝化过程的⼏个因素(1)溶液的组成溶液中存在的H+、卤素离⼦以及某些具有氧化性的阴离⼦对⾦属钝化现象起着显著的影响。
在中性溶液中,⾦属⼀般是⽐较容易钝化的,⽽在酸性或某些碱性溶液中要困难得多。
(2)⾦属的化学组成和结构各种纯⾦属的钝化能⼒均不相同,以Fe、Ni、Cr种⾦属为例,易钝化的顺序Cr>Ni>Fe。