平板菌落计数法操作步骤
- 格式:doc
- 大小:32.50 KB
- 文档页数:2

菌落总数计数方法菌落总数计数是一种常见且重要的实验方法,用于评估菌落的数量和密度。
菌落总数计数方法有多种,常见的包括平板计数法、薄层计数法、过滤膜计数法等。
下面将详细介绍这几种方法的原理和步骤。
平板计数法是最常见的菌落总数计数方法之一。
它的原理是将待测菌液均匀涂布在含有固体营养培养基的平板上,通过菌落的生长扩散形成可见的单个菌落,再通过对菌落进行计数并乘以稀释倍数,最后得到待测菌液的菌落总数。
具体步骤如下:1. 准备固体培养基。
根据所要检测菌落的要求,选择适当的培养基并准备好。
固体培养基一般含有琼脂或明胶等物质,可以提供营养物质和支持菌落的生长。
2. 制备合适浓度的菌液。
将待测菌种培养在含有适宜营养物质的液体培养基中,利用培养箱或摇床进行恒温、恒湿的培养,待菌液呈现合适浓度时即可使用。
3. 稀释菌液。
根据待测菌液的预估浓度,将适量的菌液和无菌生理盐水按一定比例进行稀释,以获得合适浓度的菌液。
4. 涂布菌落。
取一定数量的稀释后的菌液,利用灌注器或鱼鳞划线法将菌液均匀涂布在固体培养基的平板上。
为了保证菌液的均匀分布,可以采取旋转、摇动等方法。
5. 培养菌落。
将涂布好的平板置于恒温、恒湿的培养箱中进行培养。
根据菌种的不同,一般在30-37的温度下培养24-48小时。
6. 计数菌落。
在培养好的平板上,通过肉眼或借助显微镜仔细观察菌落的形态、大小、颜色等特征,并使用菌落计数器或放大镜进行计数。
根据菌落的密度和分布情况,可以选择在整个平板上计数,或者在特定区域计数后进行推算。
7. 乘以稀释倍数。
由于菌液在进行稀释时常用不同倍数的生理盐水进行稀释,所以在计算菌落总数时需要将计数结果乘以稀释倍数,以获得准确的结果。
薄层计数法是另一种常见的菌落总数计数方法。
它的原理是将含有待测菌液的液体培养基均匀地倒入培养基皿中,使其能够覆盖整个底面。
待液体凝固后,菌落会在培养基表面生长,并且可以通过视觉或显微镜观察和计数菌落。

大肠菌群平板计数法方法学验证报告实验步骤如下:1.准备培养基:将大肠杆菌选择培养基加入培养基瓶中,并用自来水洗净外面的杂质,随后用蒸馏水冲洗内表面。
将瓶口用无菌布覆盖,用锡箔纸包好,然后高温高压灭菌,储存在无菌环境中备用。
2.取少量待检样品:将待检食品样品(例如牛奶、蔬菜、饮用水等)取一适量,在无菌的条件下进行操作。
先将样品摇匀使其均匀分布,然后用无菌吸管取1毫升待检样品。
3.稀释样品:用无菌吸管将1毫升待检样品转移至无菌试管中,再向试管分别加入9毫升无菌生理盐水,摇匀使其均匀混合。
此时的样品为10倍稀释样品,将试管中的液体倒入下一个试管中,再加入9毫升无菌生理盐水,以此类推,制备出一系列浓度递减的稀释样品。
4.接种培养基:将每个稀释样品分别倒入标记好的平板培养基上,倒入后轻轻晃动,使其均匀分布在培养基上,然后在无菌工作台上用无菌铂丝铲取纱球大小的韧带状菌液涂抹在固体培养基表面,使细菌均匀生长。
5.培养和计数:将培养基板反面朝上,放入37°C恒温培养箱中进行培养,培养的时间一般为24小时。
待培养结束后,观察培养基表面是否出现典型的大肠菌群菌落。
使用菌落计数器对每个平板上的菌落进行计数。
根据以上实验步骤进行大肠菌群平板计数法的实验后,得出以下结论:1.适用性验证:通过本实验,我们可以验证大肠菌群平板计数法的适用性。
在我们的实验中,使用该方法对不同类型的食品样品进行了检测,并得出了相应的菌落计数。
这表明该方法适用于不同类型的样品,可以准确地测定大肠菌群数量。
2.优点:大肠菌群平板计数法具有以下优点:简单易行,操作方便;可定量测定大肠菌群数量,结果可靠;适用于不同类型的食品样品。
3.缺点:大肠菌群平板计数法也存在一些局限性:菌落计数需要较长时间,一般需要24小时才能观察到菌落;该方法只能测定培养基中能够生长的细菌,无法对其他微生物进行定量测定。
综上所述,大肠菌群平板计数法是一种能够准确测定大肠菌群数量的方法。

平板菌落计数法一、目的要求学习平板菌落计数的基本原理和方法。
二、基本原理平板菌落计数法是将等测样品经适当稀释后,其中的微生物充分分散为单个细胞,取一定量的稀释液接种到平板上,经过培养,由每个单细胞生长繁殖而形成的肉眼可见的菌落,即一个单菌落应代表原样品中的一个单细胞。
统计菌落数,根据其稀释倍数和取样接种量即可换算出样品中的含菌数。
但是,由于待测样品往往不易完全分散成单个细胞,所以,长成的一个单菌落也可能来自样品中的2~3或更多个细胞。
因此平板菌落计数的结果往往偏低。
现在常使用菌落形成单位。
该计数法的缺点是操作较繁,结果需要培养一段时间才能取得,而且测定结果易受多种因素的影响,但是这种计数方法最大的优点是可以获得活菌的信息,所以被广泛用于生物制品检验,以及食品、饮料和水等含菌指数或污染度的检测。
三、器材大肠杆菌悬液,LB琼脂培养基,1mL、5mL无菌吸管,无菌平皿,无菌水,无菌试管,试管架和记号笔等。
四、操作步骤1、编号取无菌平皿9套,分别标明为10-4、10-5、10-6各三套,另取6支无菌试管分别标记为10-1、10-2、10-3、10-4、10-5、10-6。
2、稀释用1mL无菌吸管吸取1mL已充分混匀的大肠杆菌菌悬液,精确地放0.5mL至10-1的试管中,此即为10倍稀释,将多余的菌液放回原菌液中。
将10-1试管充分振荡、混匀。
另取一支1ml吸管插入10-1试管中来回吹吸菌液三次,进一步将菌体分散、混匀。
动作不要太猛太快,吸时插入,吹时提出,再用此吸管吸取10-1菌液1mL,精确地放0.5mL至10-2试管中,此即为100倍稀释,依次类推,3、取样用三支1ml无菌吸定分别吸取10-4、10-5、10-6的稀释菌悬液各1mL,对号放入编好号的无菌平皿中,每个平皿放0.2mL4、倒平板尽快向上述盛有不同稀释菌液的平皿中倒入融化后冷却至45度的LB培养基约15-20ml,置水平位置迅速旋动平皿,使培养基与菌液混合均匀。

实验原理平板菌落计数法是将待测样品经适当稀释之后,其中的微生物充分分散成单个细胞,取一定量的稀释样液接种到平板上,经过培养,由每个单细胞生长繁殖而形成肉眼可见的菌落,即一个单菌落应代表原样品中的一个单细胞。
统计菌落数,根据其稀释倍数和取样接种量即可换算出样品中的含菌数。
但是,由于待测样品往往不易完全分散成单个细胞,所以,长成的一个单菌落也可能来自样品中的2—3或更多个细胞。
因此平板菌落计数的结果往往偏低。
为了清楚地阐述平板菌落计数的结果,现在已倾向使用菌落形成单位(cfu)而不以绝对菌落数来表示样品的活菌含量。
平板菌落计数法虽然操作较繁,结果需要培养一段时间才能取得,而且测定结果易受多种因素的影响,但是,由于该计数方法的最大优点是可以获得活菌的信息,所以被广泛用于生物制品检验(如活菌制剂),以及食品、饮料和水〔包括水源水〕等的含菌指数或污染程度的检测。
实验器材LB液体、固体培养基1m1移液器,平皿,试管,试管架,恒温培养箱等。
实验步骤1.无菌器材的准备(1) 无菌培养皿:取培养皿9套,包扎、灭菌。
(2) 无菌水:取6支试管,分别装入4.5m1蒸馏水,加棉塞,灭菌。
2.样品稀释液的制备(1) 编号取无菌平皿9套,分别用记号笔标明10-4、10-5、10-6(稀释度)各3套。
另取6支盛有4.5m1无菌水的试管,依次标是10-1、10-2、10-3、10-4、10-5、10-6。
(2) 稀释用1m1移液器吸取0.5m1己充分混匀的菌悬液(待测样品),至10-1的试管中,此即为10倍稀释。
将10-1试管置试管振荡器上振荡,使菌液充分混匀。
用1m1移液器在10-1试管中来回吹吸菌悬液三次,进一步将菌体分散、混匀。
吹吸菌液时不要太猛太快,吸时吸管伸入管底,吹时离开液面。
混匀后吸取至10-2试管中,此即为100倍稀释。
……其余依次类推,整个过程如图所示。
3.平板接种培养平板接种培养有浇注平板培养法和涂布平板培养法两种方法。
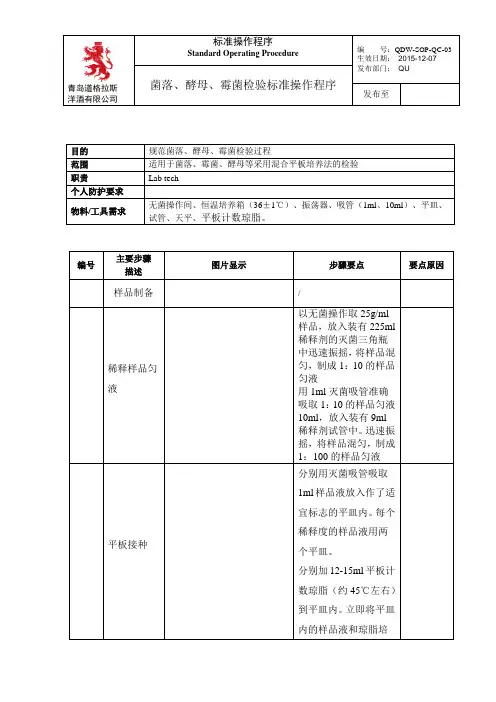

菌落总数测定实验步骤
菌落总数测定实验的步骤如下:
1. 准备所需材料和试剂:琼脂培养基、试管、乳酸菌平板、移液器、消毒液等。
2. 将琼脂培养基溶解并熔化,待稍微冷却至37℃左右。
3. 取一定量的菌液,一般可采用10倍稀释法,将菌液加入含有适量琼脂培养基的试管中,彻底混合均匀。
4. 将加有菌液的琼脂培养基倒入乳酸菌平板中,待凝固。
5. 将已经凝固的乳酸菌平板倒置,放入孵化箱中,以37℃恒温培养。
6. 培养时间通常为24-48小时,视具体菌种而定。
7. 从孵化箱中取出培养好的乳酸菌平板,将菌落数目较多且分散的平板选取,以避免菌落过于密集而无法清楚计数。
8. 使用显微镜或肉眼观察,使用计数板或计数器,对菌落进行计数,记录下每个平板上的菌落总数。
9. 根据实验设计的需要,可以进行平均数的计算和数据的统计分析。
10. 实验结束后,用消毒液彻底清洗实验器材,并正确处置菌
液和培养平板。
注意事项:
- 操作过程中应注意无菌操作,避免外部污染。
- 实验室内需要保持清洁卫生,定期消毒工作台和实验室器材。
- 孵化过程中需要注意温度和时间的控制,避免过渡时间或温
度过高导致菌落生长异常。
- 菌落计数时需要仔细观察,避免漏计或重复计数。
- 实验结束后,遵守实验室规定的废弃物处理要求,确保安全
环保。

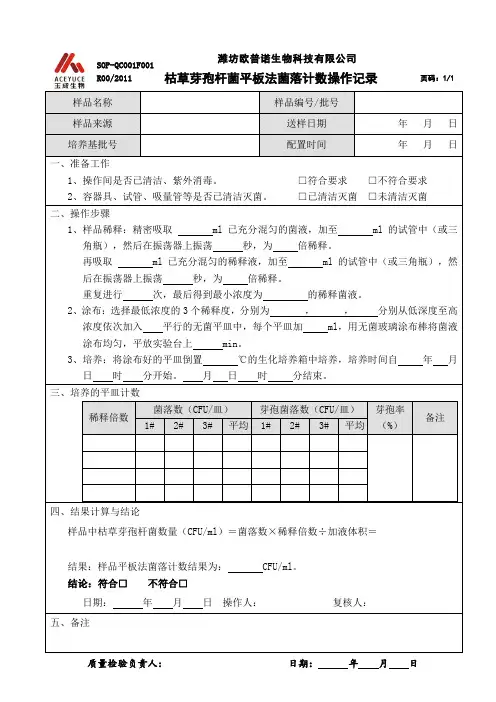
霉菌和酵母计数检验原始记录(平板计数法)
1.菌落数按“四舍五入”原则修约。
菌落数在10以内时,采用一位有效数字报告;菌落数在10T00之间时,采用两位有效数字报告。
2.菌落数大于或等于100时,前第3位数字采用“四舍五人”原则修约后,取前2位数字,后面用。
代替位数来表示结果;也可用10的指数形式来表示,此时也按“四舍五入”原则修约,采用两位有救数字。
3.若空白对照平板上有菌落出现,则此次检测结果无效。
4.称重取样以CFU/g为单位报告,体积取样以CFU/m1为单位报告,报告或分别报告霉菌和/或酵母数。
复核日期
报告人报告日期复核人。

平板菌落计数法操作步骤(精)
平板菌落计数法是一种可以用来测定悬浮液中的菌落总数以及形成菌落的种类的微生物学分析方法。
它通常被用来评估牛奶、酒精发酵物、汤、和其它类似的系统的微生物活性的估计。
平板菌落计数法的步骤一般为:
1、准备样品:将根据样品的类型,制定合适浓度、保存适宜的培养基;
2、消耗样品:根据下联试验结果,将样品消耗在培养基中;
3、载体准备:准备一个混合培养剂载体,在此载体上种植样品,以便能够有效进行培养;
4、培养:将种植好的平板载体放入带有适宜温度的培养箱中培养,按照适定的培养时间培养;
5、观察计数:将培养好的载体放入显微镜底座下进行显微观察,根据观察结果,对形成的菌落进行计数;
6、计算:根据样品的量,和所观察的菌落总数,对每升份的大菌落进行计算,以求出平板菌落总数。
7、结果分析:根据测得的平板菌落总数,进行比较测试及结果分析,从而判断样品微生物活性情况。


细菌培养的具体步骤(1个水槽计)1、灭菌:将包扎好的培养皿和试管在0.1MPa,121°C,20分钟高压蒸汽灭菌;将海水和配制好的培养基灭菌;将移液器和枪头一同放入高压蒸汽锅内灭菌。
全程要在无菌室内操作,再倒入培养基时要瓶口保持对着火焰。
2、编号:取无菌培养皿15套,分别用记号笔标明10 -4,10-5,10-6,10-7,10-8,10-9(稀释度)各3套。
另取9支盛有9.0mL无菌水的试管,依次标有10-1~10-9。
3、稀释:用移液枪取1.0mL样品液加入标有10 -1字样的试管中,此为10倍稀释,并用此溶液多次冲洗此枪头,使之充分混匀。
再从 10 -1溶液中吸取1.0mL溶液准确放入标有10 -2试管中此为稀释100倍……其余以此类推。
每操作一次换一个枪头。
4、取样:用5个枪头分别吸取标有 10-5,10-6,10-7,10-8,10-9稀释液各0.2mL。
加入相应的培养皿中间。
每个梯度设置3个平行实验组。
5、倒平板:尽快向上述盛有不同稀释度菌液的培养皿中倒入熔化后冷却至45°C左右的牛肉膏蛋白胨琼脂培养基约15mL,静置水平位置迅速转动培养皿,使培养基和菌液混合均匀(转动时不宜用力过度,否则会使培养基荡出培养皿或是溅到培养皿盖上)。
待培养基凝固后,将平板倒置于30℃恒温培养箱中培养。
注意:由于细菌易吸附在玻璃器皿表面,所以菌液加入到培养皿后,应尽快倒入熔化后冷却至45°C左右的牛肉膏蛋白胨琼脂培养基,立即摇匀。
否则,细菌将不易分散或长成菌落连在一起,不易计数。
6、计数:培养48小时后取出培养皿,根据统计的菌落数,计算出同一稀释度3个平板上的菌落平均数,按下列公式计算:每毫升样品中菌落形成的单位数(CFU)=同一稀释度3次重复的平均菌落数×稀释倍数×50 一般选取平板上长有30—300个菌落的培养皿计算每毫升含菌量较为合适,同一稀释度的3个重复平板上菌落数应相差不大,否则标明不准确。
平板计数的实验原理
平板计数法是一种实验室中常用的微生物计数方法,其原理是将待测微生物悬液均匀地铺在已知面积的平板上,通过培养基培养和观察,计算出在平板上生长的微生物菌落的数量。
平板计数法的具体操作步骤如下:
1.准备好含有适当营养物质的培养基,如大肠杆菌专用营养琼脂(LB)培养基。
2.将待测微生物悬液通过适当的稀释方法,制备出不同浓度的悬液。
一般要制备出大约3个数量级的浓度,即10^-5、10^-6和10^-7等。
3.将每一个稀释液用吸管吸取一定量,滴在分别标号好的平板上。
然后用灭菌的玻璃棒将悬液铺平,使液体均匀分布在平板上,使得每个平板上菌落的大小和形态的变化均匀。
4.将培养皿倒置放在培养箱中,进行恰当的孵育,使其在适宜的环境中生长繁殖。
具体的条件由不同微生物的生长需求而定。
5.观察每个平板上的微生物的生长情况,计算出每个平板上菌落的数量。
6.利用平均数等方法,计算出每毫升原液中微生物的数量。
平板计数法的优点是简单易行,操作方便,能直接观察和计数微生物的数量,结果比较准确。
不过,平板计数法并不适用于细胞形态、大小、生长速度和密度不同的微生物。
此外,平板计数法所得到的是可生长的菌落形式和数量,不能反映微生物在液体中的真实数量。
菌液浓度测定方法引言:菌液浓度的测定对于微生物学研究和工业应用都具有重要意义。
准确地测定菌液浓度可以帮助我们了解微生物种群的生长情况,指导实验的设计以及优化发酵过程。
本文将介绍几种常用的菌液浓度测定方法,并分析它们的优缺点。
一、平板计数法平板计数法是最常用的菌液浓度测定方法之一。
该方法基于微生物在平板培养基上形成单个可见菌落的原理。
具体步骤如下:1. 准备好所需的培养基和试管瓶。
2. 将菌液稀释至一定浓度(根据菌落数量,一般在10-100个之间)。
3. 将稀释后的菌液均匀地涂布在培养基平板上。
4. 将平板培养基倒置放置在恒温箱中进行孵育。
5. 统计并记录培养箱中每个菌落的数量。
6. 根据菌落的数量,计算出初始菌液的浓度。
优点:简单易行,不需要复杂的仪器设备。
缺点:只能测定可见菌落的浓度,无法测定微生物的总菌数;需要时间较长。
二、细胞计数法细胞计数法是一种直接测定菌液细胞数量的方法,常用的有几何计数法和电子计数法。
1. 几何计数法几何计数法利用显微镜观察菌液中的细胞数量,并通过统计计算出浓度。
具体步骤如下:1. 将菌液加入带有计数网格的计数板中。
2. 使用显微镜在计数板上观察细胞数量,并随机选择几个网格计数。
3. 统计细胞数量,并根据网格面积计算出菌液的浓度。
优点:可直接观察到细胞数量,计算相对准确。
缺点:需要显微镜和计数板进行观察和计数,操作相对复杂。
2. 电子计数法电子计数法利用粒子计数仪器来测定菌液中细胞的数量。
具体步骤如下:1. 将菌液加入粒子计数仪器中,仪器通过光学或电学方法进行细胞计数。
2. 根据计数结果,得出菌液的浓度。
优点:自动化程度高,结果快速准确。
缺点:需要专门的粒子计数仪器,相对较贵。
三、荧光素酶检测法荧光素酶检测法是一种基于荧光素酶反应测定菌液浓度的方法。
该方法适用于含有荧光素酶基因的菌株。
具体步骤如下:1. 提取菌液中的荧光素酶。
2. 加入一定量的底物,启动荧光素酶反应。
平板菌落记数法的原理(一)平板菌落记数法1. 引言平板菌落记数法(plate colony counting method)是一种常用的微生物学实验方法,用于定量测定微生物培养基上的菌落数量。
它是一种简单有效的方法,适用于各种微生物的鉴定与计数。
2. 实验原理平板菌落记数法基于菌落的形成原理进行操作。
当微生物被均匀涂布在固体培养基表面后,每个细菌或真菌细胞开始独立生长,最终形成一个个可见的菌落。
通过对菌落进行计数,可以推算出初始微生物的数量。
具体实验步骤如下:•准备培养基:根据实验需求选择适当的培养基,并按照指定的配方制备该培养基。
•涂布菌液:将待测菌液通过酒精灯的消毒棒均匀地涂布在培养基上。
•培养:将涂布后的培养基倒立放置,以避免菌落与试管壁接触污染。
将培养基置于适当的温度下培养,促进细菌或真菌的生长。
•计数菌落:在培养适宜时间后,用放大镜观察菌落,采用计数器对菌落进行计数。
•计算结果:根据计数结果以及相应的稀释倍数,推算出原始培养液中微生物的数量。
3. 注意事项在进行平板菌落记数法时,需要注意以下几点:•实验环境要维持洁净,避免外界微生物的污染。
•涂布菌液要均匀,避免过度或不足涂布导致菌落计数不准确。
•培养条件要合适,包括温度、湿度和培养时间等。
•计数时要耐心细致,避免重复计数或漏计。
•根据实验需要选择适当的稀释倍数,以避免菌落过于密集无法准确计数或过于稀疏难以观察。
4. 应用领域平板菌落记数法广泛应用于微生物学领域的各个方面,包括食品卫生检测、环境微生物学研究、药物抗菌性评价等。
•食品卫生检测:可以通过菌落计数的方法,评估食品样本中的微生物污染情况,指导食品质量控制。
•环境微生物学研究:可通过菌落计数了解土壤、水体、空气等环境中微生物的分布和变化趋势,为环境监测和生态学研究提供依据。
•药物抗菌性评价:可以通过菌落计数方法评估药物对微生物的抗菌效果,为药物研发提供数据支持。
5. 结论平板菌落记数法是一种简单可行的微生物计数方法,通过菌落计数可以对微生物的数量进行快速准确的测定。
平板菌落计数法名词解释
平板菌落计数法是一种常用的微生物计数方法,用于测定样品中微生物的数量。
下面将对每个步骤进行详细的名词解释:
1. 样品处理:在进行平板菌落计数前,需要对样品进行处理。
样品处理包括对样品的粉碎、研磨、匀浆等操作,以使样品中的微生物充分分散。
2. 培养基制备:平板菌落计数需要使用特殊的培养基,以便为微生物提供适宜的生长环境。
培养基制备包括按照一定的配方和比例将各种成分混合在一起,制备出适合微生物生长的培养基。
3. 接种:将处理过的样品接种到培养基上,以便使样品中的微生物在培养基上生长繁殖。
接种时需要保证样品均匀地分布在培养基上,并确保无菌操作以避免污染。
4. 培养:将接种后的培养基放置在适宜的温度和湿度条件下进行培养。
在培养过程中,微生物会在培养基上生长繁殖,形成肉眼可见的菌落。
5. 计数:在培养一定时间后,对培养基上的菌落进行计数。
计数时需要注意区分不同种类的菌落,并根据菌落的形态、大小、颜色等因素进行分类和统计。
6. 计算:最后,根据统计的菌落数量和稀释倍数,计算出样品中微生物的数量。
通过以上步骤,可以准确地测定样品中微生物的数量。
平板菌落计数法广泛应用于食品、药品、环境等领域的质量控制和卫生检测等方面。
菌落总数操作手册
一、概述
菌落总数是指在一定条件下生长的细菌菌落数,用于评估食品或环境的卫生质量。
本操作手册将详细介绍如何进行菌落总数检测,以确保实验结果的准确性和可靠性。
二、实验材料
1. 培养基:平板计数琼脂(PCA)
2. 试剂:无菌生理盐水
3. 器具:无菌棉签、无菌培养皿、无菌移液管(1mL)、天平、pH计、恒温培养箱、计时器、灭菌锅
三、实验步骤
1. 样品采集:使用无菌棉签采集适量样品,并放入无菌容器中。
对于液体样品,直接使用无菌移液管取样;对于固体或半固体样品,需将样品研磨或搅拌均匀后取样。
2. 样品稀释:将采集的样品进行稀释,使细菌能更好地在培养基上生长。
根据样品性质和预计菌落数,选择适当的稀释倍数。
一般采用10倍稀释法。
3. 制备平板:将PCA培养基加热融化后,冷却至45℃左右,倒入无菌培养皿中,每皿约15mL。
4. 接种样品:将稀释后的样品取1mL加入已制备好的平板中,用无菌玻璃棒均匀涂布在培养基上。
5. 培养:将培养皿倒置放入恒温培养箱中,在37℃下培养24-48小时。
6. 计数:计数平板上的菌落数,并记录结果。
根据实验要求,计算出样品中的菌落总数。
7. 结果报告:根据实验数据,撰写实验报告并向上级汇报检测结果。
四、注意事项
1. 实验前应保证所有器具和试剂的无菌状态,避免交叉污染。
2. 实验过程中要保持清洁卫生,避免人为误差。
平板菌落计数法
一、目的要求
学习平板菌落计数的基本原理和方法。
二、基本原理
平板菌落计数法是将等测样品经适当稀释后,其中的微生物充分分散为单个细胞,取一定量的稀释液接种到平板上,经过培养,由每个单细胞生长繁殖而形成的肉眼可见的菌落,即一个单菌落应代表原样品中的一个单细胞。
统计菌落数,根据其稀释倍数和取样接种量即可换算出样品中的含菌数。
但是,由于待测样品往往不易完全分散成单个细胞,所以,长成的一个单菌落也可能来自样品中的2~3或更多个细胞。
因此平板菌落计数的结果往往偏低。
现在常使用菌落形成单位。
该计数法的缺点是操作较繁,结果需要培养一段时间才能取得,而且测定结果易受多种因素的影响,但是这种计数方法最大的优点是可以获得活菌的信息,所以被广泛用于生物制品检验,以及食品、饮料和水等含菌指数或污染度的检测。
三、器材
大肠杆菌悬液,LB琼脂培养基,1mL、5mL无菌吸管,无菌平皿,无菌水,无菌试管,试管架和记号笔等。
四、操作步骤
1、编号
取无菌平皿9套,分别标明为10-4、10-5、10-6各三套,另取6支无菌试管分别标记为10-1、10-2、10-3、10-4、10-5、10-6。
2、稀释
用1mL无菌吸管吸取1mL已充分混匀的大肠杆菌菌悬液,精确地放0.5mL至10-1的试管中,此即为10倍稀释,将多余的菌液放回原菌液中。
将10-1试管充分振荡、混匀。
另取一支1ml吸管插入10-1试管中来回吹吸菌液三次,进一步将菌体分散、混匀。
动作不要太猛太快,吸时插入,吹时提出,再用此吸管吸取10-1菌液1mL,精确地放0.5mL至10-2试管中,此即为100倍稀释,依次类推,
3、取样
用三支1ml无菌吸定分别吸取10-4、10-5、10-6的稀释菌悬液各1mL,对号放入编好号的无菌平皿中,每个平皿放0.2mL
4、倒平板
尽快向上述盛有不同稀释菌液的平皿中倒入融化后冷却至45度的LB培养基约15-20ml,置水平位置迅速旋动平皿,使培养基与菌液混合均匀。
5、培养
倒置于37度培养箱中培养48小时,
6、计数
算出同一稀释度三个平板上的菌落平均数,并按下列公式进行计算;
每毫升中菌落形成单位(cfu)= 同一稀释度三次重复的平均菌落数×稀释倍数×5
五、实验报告
1、结果
将培养后菌落计数结果填入下表:
2、思考题
(1)为什么溶化后的培养基要冷却至45℃左右才能倒平板?
(2)要使平板菌落计数准确,需要掌握哪几个关键?为什么?
(3)同一种菌液用血球计数板和平板菌落计数法同时计数,所得结果是否一样?为什么?
(4)试比较平板菌落计数法和显微镜下直接计数法的优缺点。