第二章 胶体溶液(2011.9)
- 格式:ppt
- 大小:2.46 MB
- 文档页数:88






溶液和胶体第⼆章溶液和胶体溶液和胶体是物质的不同存在形式,在⾃然界中普遍存在,与⼯农业⽣产以及⼈类⽣命活动过程有着密切的联系。
⼴⼤的江河湖海就是最⼤的⽔溶液,⽣物体和⼟壤中的液态部分⼤都为溶液或胶体。
溶液和胶体是物质在不同条件下所形成的两种不同状态。
例如NaCl溶于⽔就成为溶液,把它溶于酒精则成为胶体。
那么,溶液和胶体有什么不同呢?它们各⾃⼜有什么样的特点呢?要了解上述问题,需要了解有关分散系的概念。
2.1分散系及其分类2.1.1 分散系的概念⼀种或⼏种物质分散在另⼀种物质⾥所形成的系统称为分散系统,简称分散系。
例如粘⼟分散在⽔中成为泥浆,⽔滴分散在空⽓中成为云雾,奶油、蛋⽩质和乳糖分散在⽔中成为⽜奶等都是分散系。
在分散系中,被分散的物质叫做分散质(或分散相),⽽容纳分散质的物质称为分散剂(或分散介质)。
在上述例⼦中,粘⼟、⽔滴、奶油、蛋⽩质、乳糖等是分散质,⽔、空⽓就是分散剂。
分散质和分散剂的聚集状态不同,分散质粒⼦⼤⼩不同,分散系的性质也不同。
我们可以按照物质的聚集状态或分散质颗粒的⼤⼩将分散系进⾏分类。
2.1.2分散系的分类物质⼀般有⽓态、液态、固态三种聚集状态,若按分散质和分散剂的聚集状态进⾏分类,可以把分散系分为九类,见表2-1。
表2-1 分散系分类(⼀)若按分散质粒⼦直径⼤⼩进⾏分类,则可以将分散系分为三类,见表2-2。
表2-2 分散系分类(⼆)分⼦与离⼦分散系统中,分散质粒⼦直径<1nm,它们是⼀般的分⼦或离⼦,与分散剂的亲和⼒极强,均匀、⽆界⾯,是⾼度分散、⾼度稳定的单相系统。
这种分散系统即通常所说的溶液,如蔗糖溶液、⾷盐溶液。
胶体分散系中,分散质粒⼦直径为1~100nm,它包括溶胶和⾼分⼦化合物溶液两种类型。
⼀类是溶胶,其分散质粒⼦是由许多⼀般的分⼦组成的聚集体,这类难溶于分散剂的固体分散质⾼度分散在液体分散剂中,所形成的胶体分散系称为溶胶。
例如氢氧化铁溶胶、硫化砷溶胶、碘化银溶胶、⾦溶胶等。

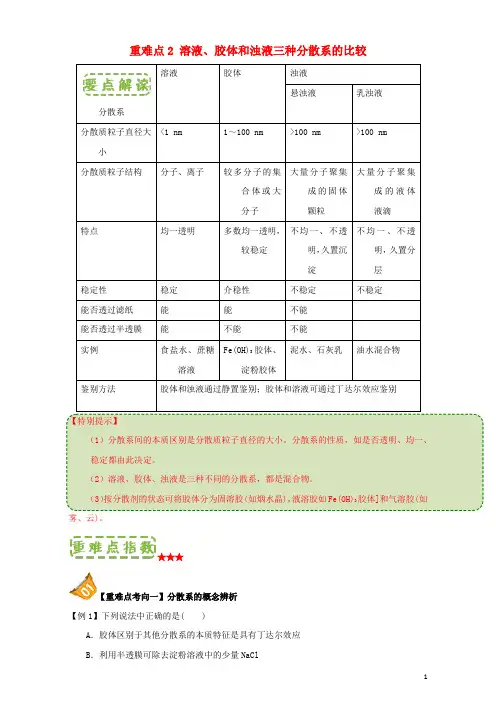
重难点2 溶液、胶体和浊液三种分散系的比较分散系溶液胶体浊液悬浊液乳浊液分散质粒子直径大小<1 nm 1~100 nm >100 nm >100 nm分散质粒子结构分子、离子较多分子的集合体或大分子大量分子聚集成的固体颗粒大量分子聚集成的液体液滴特点均一透明多数均一透明,较稳定不均一、不透明,久置沉淀不均一、不透明,久置分层稳定性稳定介稳性不稳定不稳定能否透过滤纸能能不能能否透过半透膜能不能不能实例食盐水、蔗糖溶液Fe(OH)3胶体、淀粉胶体泥水、石灰乳油水混合物鉴别方法胶体和浊液通过静置鉴别;胶体和溶液可通过丁达尔效应鉴别【特别提示】(1)分散系间的本质区别是分散质粒子直径的大小。
分散系的性质,如是否透明、均一、稳定都由此决定。
(2)溶液、胶体、浊液是三种不同的分散系,都是混合物。
(3)按分散剂的状态可将胶体分为固溶胶(如烟水晶),液溶胶如Fe(OH)3胶体]和气溶胶(如雾、云)。
★★★【重难点考向一】分散系的概念辨析【例1】下列说法中正确的是( )A.胶体区别于其他分散系的本质特征是具有丁达尔效应B.利用半透膜可除去淀粉溶液中的少量NaClC.溶液是电中性的,胶体是带电的D.纳米材料粒子直径一般在10-9~10-7 m之间,因此纳米材料属于胶体【答案】B【解析】胶体与其他分散系的本质区别是分散质粒子的直径大小,丁达尔效应是胶体的一种性质,A项错误;半透膜能允许直径在1 nm以下的小分子或离子透过,1 nm以上的胶体粒子不透过,因此可以用半透膜除去淀粉溶液中的NaCl,B项正确;胶体中的胶粒带正电荷,但整个胶体不带电,呈电中性,C项错误;胶体是分散系,属于混合物,直径在1~100 nm 之间的纳米材料不一定是分散系,若是纯净物,则不属于胶体,D项错误。
【重难点点睛】(1)胶体是分散系,由分散质和分散剂组成,属混合物。
(2)胶体呈电中性,胶体微粒一般带同种电荷,有的胶体微粒如淀粉胶体微粒不带电荷。
