(推荐)溶菌酶作用机理
- 格式:doc
- 大小:679.00 KB
- 文档页数:3


溶菌酶溶菌酶溶菌酶( Lysozyme,E.C.3.2.17),全称为1,4-p -N -溶菌酶,又称为细胞壁溶解酶,是自然界普遍存在的一种酶,因其能溶解细菌细胞壁具有溶菌作用而得名。
(一)溶菌酶的结构及物理化学性质溶菌酶易溶于水,遇碱易破坏,不溶于丙酮、乙醚,是一种白色、无臭的结晶粉末。
相对分子质量为14.7ku,由129个氨基酸残基组成,碱性氨基酸残基及芳香族氨基酸如色氨酸残基的比例很高,含有4个二硫键,如图2 -24所示,其等电点为10~11。
在37℃条件下溶菌酶的生物学活性可保持6h,当温度较低时保持时间更长,利于溶菌酶在体内发挥作用。
禽蛋蛋清是溶菌酶的重要来源,蛋清溶菌酶的物理化学性质如表17 -1所示。
溶菌酶由两个区域组成,由一个长的α螺旋所联接,其二级结构大多是α螺旋。
N末端的区域( f40~80)由一些螺旋线组成,大多数是反平行的β折叠。
第二个区域由fl~39和f89~129氨基酸残基组成。
分子中的这两个区域被一个螺旋体(f87天冬氨酸- 114精氨酸)所分离,分子组成了内部疏水外部亲水的基本结构,对溶菌酶发挥抗菌功能起着巨大的作用。
表17 -1 蛋清溶菌酶的物理化学特性特性数值相对分子质量14 400亚基数 1氨基酸129等电点10.7二硫键数 4碳水化合物所占比例0E1%280nm 26.493℃时的D热值(每分钟破坏90%的活性)110酶活力的实验通过浑浊溶壁微球菌的细胞溶解(二)溶菌酶的来源溶菌酶在自然界中普遍存在,在人和许多哺乳动物的组织和分泌液中,均发现有溶菌酶存在,其物化性质基本相似,溶菌酶的来源如表17 -2所示。
溶菌酶主要分布于禽蛋和鸟类蛋清中,尤其是浓厚蛋白的系带膜状层中。
禽蛋中异常丰富,占整个蛋清中的 3.5%,鸡蛋蛋清是溶菌酶的主要商业来源。
表17 -2溶菌酶的来源溶菌酶的来源溶菌酶的含量鸡蛋清 2 500 ~ 3 500μg/mL鸭蛋清 1 000 ~ 1 300μg/mL鹅蛋清500 ~ 700μg/mL眼泪 3 000 ~5 000μg/mL人乳55~ 75 μg/mL牛奶10~ 15μg/mL脾脏50 ~ 160μg/kg胸腺60~ 80μg/kg胰腺20~ 35μg/kg花椰菜汁25~ 28μg/mL木瓜汁8~ 9μg/mL卷心菜汁7~8μg/mL(三)溶菌酶的溶菌机制溶菌酶是一种糖苷水解酶,专门作用于微生物细胞壁,可以破坏组成微生物细胞壁的N-乙酰胞壁酸和N-乙酰葡萄糖胺之间的β-1,4-糖苷键,其作用机理见图17 -1。
溶菌酶作用机理
1.溶菌酶:是催化某些细菌细胞壁水解、从而溶解其细胞壁的酶,主要存在于鸡蛋清及动物的眼泪中。
2.细胞壁多糖:是N-乙酰氨基葡萄糖(NGA)-N-乙酰氨基葡萄糖乳酸(NAM)的共聚物,其中的NGA及NAM通过?-1,4糖苷键而交替排列:
3.溶菌酶的结构:由129个氨基酸组成的单肽链蛋白质,含有四对二硫键,一级结构如图所示
4.溶菌酶的催化作用:为葡糖苷酶,能水解NAM的C1与NAG的C4之间的糖苷键,但不能水解NAG的C1 与NAM的C4之间的糖苷键,水解作用如下:
5.溶菌酶的三维结构:溶菌酶分子内部几乎是非极性的,在分子的表面有一个较深的裂缝,恰好能容纳多糖底物的六个单糖(ABCDEF环),是溶菌酶的活性部位,其中白色所示的是活性部位的Glu35和Asp52。
6.溶菌酶与底物的复合物的三维结构:
7.溶菌酶-底物结合部位示意图:NAG多聚体水解速率表明从5到6聚体增加到最大,活性部位的裂缝正好被六个糖残基所装满,水解部位是D和E之间的糖苷键
8.溶菌酶与底物的复合物的三维结构示意图:第四个糖残基D环由于空间的原因必须由正常的椅式变形为能量较高的半椅式,因此降低了糖苷键的稳定性容易断裂。
9.溶菌酶催化作用机制要点总结:
(1)Glu35的-COOH提供一个H+到D环与E环间的糖苷键O原子上。
H+的转移使D环的C1键与糖苷键O原子间的键断开,并形成正碳离子过渡中间产物。
(2)含有E及F残基的NAG二聚体离开酶分子。
(3)正碳离子中间产物进一步与来自溶剂的OH-发生反应, Glu35质子化,酶游离出来。

内容1:溶菌酶简介1.1 溶菌酶溶菌酶(N-乙酰胞壁质聚糖水解酶,EC3.2.1.17)又称为胞壁质酶,是一种专门作用于微生物细胞壁的水解酶。
溶菌酶是由129个氨基酸构成的单纯碱性球蛋白,化学性质非常稳定。
溶菌酶存在在自然界中,溶菌酶普遍存在于鸟类、家禽的蛋清和哺乳动物的眼泪、唾液、血液、鼻涕、尿液、乳汁和组织细胞中(如肝、肾、淋巴组织、肠道等)。
从木瓜、芜青、大麦、无花果和卷心菜、萝卜等植物中也能分离出溶菌酶,其中以蛋清含量最高。
溶菌酶生理作用在生物体内溶菌酶具有抗菌消炎,抗病毒,增强机体免疫力的生理功能,还可激活血小板,改善组织局部血液循环障碍,分泌脓液,增强局部防卫功能,具有止血、消肿等作用。
它还可以作为一种宿主抵抗因子,对组织局部起保护作用2:溶菌酶的种类溶菌酶的研究最早是从尼科尔(Nicoile)1907年发表枯草杆菌溶解因子的报告开始的。
两年后,Laschtschenko指出:鸡卵白强烈抑菌作用是酶作用的结果。
1922年英国细菌学家弗莱明(Fleming)发现人的唾液、眼泪中存在这种能溶解细菌细胞壁的酶,因其具有溶菌作用,故命名为溶菌酶。
1937年由Abraham与Robinson从卵蛋白中最先分离出晶体溶菌酶,此后人们在人和动物的多种组织、分泌液及某些植物、微生物中也发现了溶菌酶的存在。
根据来源不同,将溶菌酶分为三类(1)动物源溶菌酶⏹动物源溶菌酶包括鸡蛋清溶菌酶及人和哺乳动物溶菌酶。
⏹鸡蛋清溶菌酶是目前研究和应用最多的,在鸡蛋清中约含有3.5%左右的酶,分子量为14000,其等电点在pH10.8左右,最适效应温度在50℃,化学性质稳定,pH在1.2~11.3之间改变时对酶结构影响很小,pH在4~7范围内100℃处理1min仍有近100%的活力,在210℃条件下加热1.5h仍具有活性。
鸡蛋清溶菌酶在碱性环境条件下稳定性较差,分解G+细菌,但对G-细菌不起作用。
研究表明其它鸟类蛋清溶菌酶也是由129个氨基酸残基组成,但其排列顺序和鸡蛋清溶菌酶不同,并且活性部位也不相同。



溶菌酶在饲料中的应用李鑫1 ,谭志坚1 ,凌欣华2,李巧贤3(1 佛山市正典生物技术有限公司,广东佛山 528138;2 梅州市畜牧兽医技术推广站,广东梅州 514021;3 广东现代农业集团研究院,广东广州 510630)溶菌酶(Lysozyme)又称胞壁质酶或N-乙酰胞质聚糖水解酶,是动物体内一种非特异性免疫因子,具有抗菌消炎、抗病毒、增强免疫力、促进双歧杆菌等有益菌增殖的作用。
本文介绍了溶菌酶的特性、分类和作用机理,重点综述了溶菌酶作为饲料添加剂在猪、鸡、鸭、反刍动物以及水产动物等饲料中的应用。
溶菌酶广泛存在于鸟类和家禽的蛋清中,亦存在于哺乳动物的泪液、唾液、血浆、乳汁、胎盘、体液及组织细胞内,其中以蛋清中含量最丰富。
溶菌酶对革兰氏阳性菌有抗菌作用,而对没有细胞壁的动物体细胞不会产生不利影响,因而安全性很高。
口服溶菌酶,可阻止流感和腺病毒繁殖。
作为抗生素的替代品,溶菌酶被WHO和许多国家认定为无毒、无害、安全的应用于食品和饲料添加剂领域,2010年被我国卫生部批准为食品添加剂。
1 溶菌酶的特性溶菌酶,又称胞壁质酶或N-乙酰胞壁质聚糖水解酶,能水解肽聚糖中的N-乙酰葡萄糖和N-乙酰胞壁酸之间的β-1,4糖苷键,以此破坏细菌的细胞壁,具有较强的抑菌抗菌活性。
溶菌酶是一种白色、微白色结晶型或无定型粉末,无臭、味甜且易溶于水,不溶于丙酮和乙醚等有机溶剂,在干燥室温可长期保存。
化学性质非常稳定,对热也极为稳定。
当pH在1.2-11.3范围内剧烈变化时,其结构几乎不变。
在酸性环境中,溶菌酶对热的稳定性很强,在pH4-7范围内,100℃处理1 min仍能保持原酶活性,pH3时能耐100℃加热处理45 min,但在碱性环境中溶菌酶对热稳定性较差。
最适pH为6.6,作用的最适温度为45~50℃,等电点pH10.5-11。
2 溶菌酶的分类2.1 c型溶菌酶, 主要分布在脊椎动物和昆虫中, 大部分虾溶菌酶属于c型,如凡纳滨对虾、日本囊对虾、斑节对虾、罗氏沼虾、日本沼虾的溶菌酶。


溶菌酶的作用机理和应用溶菌酶是一种专门作用于微生物细胞壁的水解酶,破坏细菌的细胞壁,使得细菌溶解、坏死。
人教版选择性必修一只提了一下溶菌酶,试题中有时也会出现溶菌酶。
欲了解溶菌酶,首先需要知道它分布在人体的哪些部位,按照溶菌酶存在的部位主要参与第一道防线(如泪液中溶菌酶),也参与第二道防线(如血浆中的溶菌酶)。
另外,溶菌酶作为一种天然蛋白质,能在胃肠内作用营养物质被消化和吸收,对人体无毒性,也不会在体内残留,是一种安全性很高的的食品保鲜剂、营养保健品和药品。
溶菌酶的结构试题解析试题:溶菌酶是存在于体液、眼泪等中的酶,有杀菌功能,整个分子大致呈球形,故称为球蛋白(如图)。
下列关于溶菌酶的说法,全错的一组是()①溶菌酶从细胞进入泪液不穿过生物膜②溶菌酶是由两条多肽链共同组成的③双缩脲试剂5%NaOH溶液与1%CuSO4溶液等体积混合后与溶菌酶反应呈紫色④溶菌酶的空间结构与其功能密切相关⑤溶菌酶的杀菌作用属于特异性免疫A. ②③⑤B. ①②⑤C. ②③④D. ①②④解析:溶菌酶是存在于眼泪和白细胞中的酶,有杀菌功能,整个分子大致呈球形,故称为球蛋白。
①溶菌酶从细胞进入泪液是胞吐,不穿过生物膜,①正确;②从图形看出,溶菌酶是由1条多肽链组成的,②错误;③双缩脲试剂5%NaOH溶液和1%CuSO4溶液,应先后加,不能混合起来加,再说,不是等体积混合,③错误;④溶菌酶的空间结构与其功能密切关系,④正确;⑤溶菌酶的杀菌作用属于非特异性免疫,⑤错误。
所以,②③⑤错误,答案为A。
溶菌酶及其作用1.溶菌酶的发现英国细菌学家弗莱明很善于提出问题。
1921年他对眼睛的抵抗力产生了兴趣。
他想:“人的眼睛整天睁着,难免受到细菌的伤害,但眼睛为什么很少受到细菌的感染呢?是不是眼睛里面有一种物质在起着什么作用呢?”为了研究这个问题,他收集了一些眼泪,再把细菌接种到眼泪里,结果,细菌很快就死了。
弗莱明如同发现了新大陆。
“人的眼泪里一定存在着一种能使细菌致死的物质。

溶菌酶的作用机理
1922年,英国细菌学家A. Fleming发现人的唾液、眼泪中存在一种可溶解细菌细胞壁的酶,因其具有溶解作用,就命名为溶菌酶。
溶菌酶(lysozyme)是一种能特异性地水解细菌细胞壁肽聚糖的糖苷水解酶。
是一种碱性、安全绿色的小分子蛋白质,已知在人的眼泪、鼻黏液、唾液、乳汁等分泌液中及肝、肾、淋巴组织含有此酶。
细菌细胞壁主要成分是肽聚糖(Peptidoglycan),又称粘肽(Mucopetide)。
细胞壁的机械强度有赖于肽聚糖的存在,溶菌酶主要作用于细胞壁的骨架物质肽聚糖部分,肽聚糖是由NAG和NAM以β-1,4糖苷键连接起来的多聚体,并通过连接NAM上的短肽链之间的肽键使聚糖部分交联成网状,以维持细胞结构的稳定性。
溶菌酶发生作用后,由于骨架物质的裂解,细胞壁结构发生坍塌、脱落,细菌细胞即形成原生质体结构,该结构受到内外渗透压变化影响较大,很容易造成胞内物质泄漏,最终导致菌体细胞破裂、溶解,直至死亡。
卵清溶菌酶是一种无毒性的蛋白质,能选择性地使对象微生物细胞壁溶解,而对其它物质无反应。

溶菌酶的研究及应用简介摘要溶菌酶(lysozyme)是一种专门作用于微生物细胞壁的水解酶,又称胞壁质酶(muramidase)。
人们对溶菌酶的研究始于20 世纪初,英国细菌学家Fleming在发现青霉素的前6年(1922年)发现人的唾液、眼泪中存在能溶解细菌细胞壁的酶,因其具有溶菌作用,故命名为溶菌酶,其中鸡蛋溶菌酶的研究和应用已相当深入和广泛[1]。
通过对它的结构、性质、来源的研究;溶菌酶已广泛的应用于医药、生物工程和食品工业等多个方面。
关键词溶菌酶;结构;应用;研究进展溶菌酶(Lysozymc EC3.2.1.17)又名胞壁质酶(muramidase)、乙酞胞壁酸聚糖水解酶(N-acctylmuramide glyca-nohydrolase),广泛地分布于自然界[2]。
在病毒(如噬菌体T4)、细菌(如枯草杆菌)、植物(如番木瓜)、动物(如鼠、狗)及人体内都含有。
人体内多数组织器官含有一定浓度的溶菌酶。
但以脾、肾含量较高。
在鼻及支气管分泌液、泪液、脑脊液、唾液、乳汁及血液中均含有一定量的溶菌酶。
此酶自被发现以来,经科学家们不断地研究,使得它在酶学及临床医学中均占有一定的重要位置,也将其应用于医疗、食品、畜牧及生物工程中。
1 溶菌酶的发现1907年Nicollc[2]猜测芽胞杆菌(Bacillus)及枯草杆菌中含有溶解细菌的酶。
1909年schtchenko[3]第一个报道了鸡蛋清内含有溶解细菌的酶。
1922年Alexander Fleming[2]发现鼻粘液里有一种能溶解微球菌(micrococcus lysodeikticus)及其他细菌的酶,他把这种酶命名为溶菌酶(lysozyme)。
经过仔细的观察和研究,他发现此酶广泛地存在于生物组织及机体的某些分泌物中。
之后Robert及Wolff 也从鸡蛋清里提取出溶菌酶。
1937~1946年间Abraham[3],Robinson, Alderson及Fevold等人通过实验从而分别获得了溶菌酶的结晶。
青霉素和溶菌酶的作用机制青霉素和溶菌酶的作用机制是通过与细菌细胞壁的肽聚糖层的作用位点相结合,破坏细菌的细胞壁,细菌胞体内的渗透压很高,而细胞膜又很脆弱,于是细菌就在人体内相对低渗的环境里溶胀,最终破裂。
G+菌的肽聚糖层达20到50层,是其细胞壁的主要成分,而且其胞质的渗透压达25-50个大气压;G-菌的肽聚糖层很少,只有几层,最多十几层,其胞质的渗透压只有5到6个大气压。
因此,G+菌比G-菌对青霉素和溶菌酶更敏感。
溶菌酶作用机制:(lysozyme)又称胞壁质酶(muramidase)或N-乙酰胞壁质聚糖水解酶(N-acetylmuramide glycanohydrlase),是一种能水解致病菌中黏多糖的碱性酶。
主要通过破坏细胞壁中的N-乙酰胞壁酸和N-乙酰氨基葡糖之间的β-1,4糖苷键,使细胞壁不溶性黏多糖分解成可溶性糖肽,导致细胞壁破裂内容物逸出而使细菌溶解。
溶菌酶还可与带负电荷的病毒蛋白直接结合,与DNA、RNA、脱辅基蛋白形成复盐,使病毒失活。
因此,该酶具有抗菌、消炎、抗病毒等作用。
该酶广泛存在于人体多种组织中,鸟类和家禽的蛋清、哺乳动物的泪、唾液、血浆、尿、乳汁等体液以及微生物中也含此酶,其中以蛋清含量最为丰富。
从鸡蛋清中提取分离的溶菌酶是由18种129个氨基酸残基构成的单一肽链。
它富含碱性氨基酸,有4对二硫键维持酶构型,是一种碱性蛋白质,其N端为赖氨酸,C端为亮氨酸。
可分解溶壁微球菌、巨大芽孢杆菌、黄色八叠球菌等革兰阳性菌青霉素作用机制:青霉素作用机制是干扰细菌细胞壁的合成。
青霉素通过抑制细菌细胞壁四肽侧链和五肽交连桥的结合而阻碍细胞壁合成而发挥杀菌作用。
青霉素的结构与细胞壁的成分粘肽结构中的D-丙氨酰-D-丙氨酸近似,可与后者竞争转肽酶,阻碍粘肽的形成,造成细胞壁的缺损,使细菌失去细胞壁的渗透屏障,对细菌起到杀灭作用。
其对革兰阳性菌有效,由于革兰阴性菌缺乏五肽交连桥而青霉素对其作用不大。
溶菌酶摘要:溶菌酶是一种促使细菌细胞壁中黏多糖分解的酶。
1922年为Fleming氏所发现。
1945年Alderton氏等人从鸡蛋清中分离出结晶纯品。
溶菌酶是由18种氨基酸组成的多肽。
分子量约为14500-17500。
因制备原料不同,分子量及结构有所变化。
溶菌酶广泛存在于自然界如泪液、蛋清、鼻粘膜、肺、血清、白血球以及动物的其他组织和分泌物中,还存在于微生物中。
溶菌酶生产早先多从鸡蛋清中吸附,直接结晶得。
以后采用了离子交换技术,用弱酸性阳离子交换树脂直接从鸡蛋清中吸附分离。
本文介绍了溶菌酶的一些性质,提取纯化以及在生产实践中的应用。
Lysozyme(LY),virtually ubiquitous throughout microorganism,animal and plants,is a lways considered to be a small alkali protein.Lysozyme has long been used as amodel syst em for protein structure,enzyme kinetic,molecular immunology and molecular evolution studies.The information like source,structural composition and properties,mechanis m and the methods of extraction of lysozyme was introduced in this paper.The applicatio n of lysozyme in food industry,medicine and enzymatic engineering in recent years was s ummarized.Meanwhile,the problems involved in the application of lysozyme were discuss ed indetails.Furthermore,the prospectof lysozyme application was also predicted.一、溶菌酶的理化性质溶菌酶又称胞壁质酶或-一乙酸胞壁质聚糖水解酶"是一种葡萄糖苷酶,其化学性质稳定干燥条件下在室温可长期保存。
溶菌酶杀菌原理
溶菌酶通过破坏细菌细胞壁,打破其完整性,干扰细菌的正常生理功能,最终导致细菌死亡。
溶菌酶作用于细菌细胞壁的主要机理有3种:
1.破坏糖胺聚糖链:细菌细胞壁的主要成分是由多种糖胺聚糖链交织形成的。
溶菌酶能够切断这些糖胺聚糖链,导致细菌细胞壁的损伤和破裂。
2.扰乱细菌细胞壁结构:溶菌酶可以使细菌细胞壁的结构发生变化,破坏细菌细胞壁的完整性。
这会导致细菌细胞内部的物质外泄,导致细菌死亡。
3.促进水分进入细菌细胞:溶菌酶能够通过破坏细菌细胞壁,使细菌细胞内部暴露在外界环境中,从而增加了细菌细胞吸收水分的能力。
细菌在水分过剩的环境中会破裂,导致细菌死亡。
第一章1.下列描述的微生物特征中,不是所有微生物共同具有的一条是答案:只能在活细胞内生长繁殖2.不属于原核生物界的微生物是答案:病毒3.属于真菌界的微生物是答案:新生隐球菌4.原核细胞型微生物的特点是答案:仅有原始核质5.微生物的特点是答案:结构简单第二章1.细菌细胞壁的主要功能是答案:维持细菌的外形2.具有抗吞噬作用的细菌基本结构是答案:荚膜3.细菌的芽胞答案:是细菌在不利环境条件下形成的休眠体4.溶菌酶的作用机理是答案:水解肽聚糖的β-1,4糖苷键5.微生物具有肉眼可以看得见的特点答案:错第三章1.大多数细菌繁殖一代所需时间为答案:20min~30min2.“菌落”是指答案:一个细菌在培养基上生长繁殖而形成肉眼可见的细菌集团3.细菌生长繁殖的方式是答案:二分裂4.乙醇消毒剂常用的浓度是答案:75%5.芽胞与细菌有关的特性是答案:耐热性第四章1.构成细菌毒力的是答案:侵袭力和毒素2.与细菌致病性无关的结构是答案:异染颗粒3.细菌内毒素的成份是答案:脂多糖4.关于内毒素性质的错误叙述是答案:用甲醛脱毒可制成类毒素5.关于病菌致病因素的描述,错误的是答案:与病菌侵入的数量并无密切关系第五章1.金黄色葡萄球菌所致皮肤化脓性感染多为局限性,是因该菌能产生答案:血浆凝固酶2.金黄色葡萄球的肠毒素引起的疾病是答案:食物中毒3.葡萄球菌引起疾病有答案:化脓性炎症4.下列哪个不是金葡菌的致病物质答案:致热外毒素5.原核细胞型微生物的特点是仅有原始核质答案:对1.初步鉴定肠道致病菌与非致病菌常用的试验是答案:乳糖发酵试验2.培养肠道致病菌的强选择性培养基是答案:S.S平板3.目前筛查伤寒带菌者的方法是检测血清答案:Vi抗体4.伤寒沙门菌结构的特点是答案:仅有原始核质5.伤寒沙门菌的内毒素使答案:体温不变,外周血白细胞下降第七章1.关于霍乱弧菌的生物学性状,叙述错误的是答案:E1Tor生物型霍乱弧菌抵抗力强,是因为有芽胞形成2.霍乱病人排泄物的特点答案:米泔水样便3.一男性病人,43岁,头晕,腹胀,剧烈腹泻呈水样便伴呕吐l天。
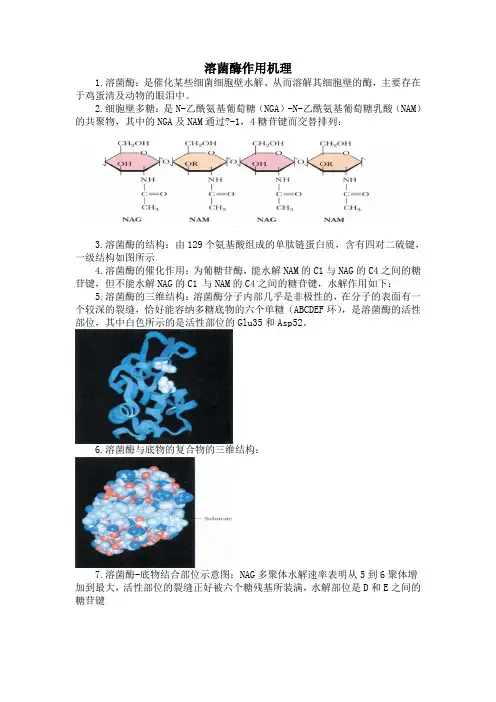
溶菌酶作用机理
1.溶菌酶:是催化某些细菌细胞壁水解、从而溶解其细胞壁的酶,主要存在于鸡蛋清及动物的眼泪中。
2.细胞壁多糖:是N-乙酰氨基葡萄糖(NGA)-N-乙酰氨基葡萄糖乳酸(NAM)的共聚物,其中的NGA及NAM通过b-1,4糖苷键而交替排列:
3.溶菌酶的结构:由129个氨基酸组成的单肽链蛋白质,含有四对二硫键,一级结构如图所示
4.溶菌酶的催化作用:为葡糖苷酶,能水解NAM的C1与NAG的C4之间的糖苷键,但不能水解NAG的C1 与NAM的C4之间的糖苷键,水解作用如下:
5.溶菌酶的三维结构:溶菌酶分子内部几乎是非极性的,在分子的表面有一个较深的裂缝,恰好能容纳多糖底物的六个单糖(ABCDEF环),是溶菌酶的活性部位,其中白色所示的是活性部位的Glu35和Asp52。
6.溶菌酶与底物的复合物的三维结构:
7.溶菌酶-底物结合部位示意图:NAG多聚体水解速率表明从5到6聚体增加到最大,活性部位的裂缝正好被六个糖残基所装满,水解部位是D和E之间的糖苷键
8.溶菌酶与底物的复合物的三维结构示意图:第四个糖残基D环由于空间的原因必须由正常的椅式变形为能量较高的半椅式,因此降低了糖苷键的稳定性容易断裂。
9.溶菌酶催化作用机制要点总结:
(1)Glu35的-COOH提供一个H+到D环与E环间的糖苷键O原子上。
H+的转移使D环的C1键与糖苷键O原子间的键断开,并形成正碳离子过渡中间产物。
(2)含有E及F残基的NAG二聚体离开酶分子。
(3)正碳离子中间产物进一步与来自溶剂的OH-发生反应, Glu35质子化,酶游离出来。
(注:专业文档是经验性极强的领域,无法思考和涵盖全面,素材和资料部分来自网络,供参考。
可复制、编制,期待你的好评与关注)。