第六章第一讲 化学能与热能
- 格式:ppt
- 大小:2.97 MB
- 文档页数:106

第六章 化学反应与能量第一节 化学能与热能[高考备考指南]焓变、反应热与能源(对应复习讲义第65页)1.化学反应的实质与特征(1)实质:反应物中化学键断裂和生成物中化学键形成。
(2)特征:既有物质变化,又伴有能量变化;能量转化主要表现为热量的变化。
(3)两守恒:化学反应遵循质量守恒定律,同时也遵循能量守恒定律。
2.吸热反应与放热反应(1)从化学键的角度分析(2)吸热反应和放热反应的比较(3)常见的放热反应和吸热反应放热反应:①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟水或酸的置换反应;⑤物质的缓慢氧化;⑥铝热反应。
吸热反应:①大多数分解反应;②盐类的水解反应;③Ba(OH)2·8H2O与NH4Cl反应;④碳和水蒸气、C和CO2的反应。
3.两种反应热——燃烧热与中和热(1)比较(2)中和反应反应热的测定①实验装置②中和热的测定原理ΔH =-(m 酸+m 碱)·c ·(t 终-t 始)nc =4.18 J·g -1·℃-1=4.18×10-3kJ ·g -1·℃-1;n 为生成H 2O 的物质的量。
③注意事项a .泡沫塑料板和碎泡沫塑料(或纸条)的作用是保温隔热,防止热量损失。
b .为保证酸完全中和,采取的措施是碱稍微过量。
c .测定温度时,应测反应过程的最高温度作为终止温度。
4.能源判断正误(1)放热反应不需要加热就能反应,吸热反应不加热就不能反应。
( ) (2)水结成冰放出热量的反应为放热反应。
( ) (3)同一物质的三态能量中气态最高,固态最低。
( )(4)同温同压下,反应H 2(g)+Cl 2(g)===2HCl(g)在光照和点燃条件下反应的ΔH 不同。
( ) (5)可逆反应的ΔH 表示完全反应时的热量变化,与反应是否可逆无关。
( )(6)甲烷的标准燃烧热ΔH =-890 kJ·mol -1,则甲烷燃烧的热化学方程式为CH 4(g)+2O 2(g)===CO 2(g)+2H 2O(g) ΔH =-890 kJ·mol -1。


化学能与热能课标要求1.认识物质具有能量,认识吸热反应与放热反应,了解化学反应体系能量改变与化学键的断裂和形成有关。
2.能基于化学键解释某些化学反应的热效应。
3.认识化学能可以与热能、电能等其他形式能量之间相互转化,能量的转化遵循能量守恒定律。
知道内能是体系内物质的各种能量的总和,受温度、压强、物质的聚集状态的影响。
课标要求4.认识化学能与热能的相互转化,恒温恒压条件下化学反应的反应热可以用焓变表示,了解盖斯定律及其简单应用。
5.能辨识化学反应中的能量转化形式,能解释化学反应中能量变化的本质。
6.能进行反应焓变的简单计算,能用热化学方程式表示反应中的能量变化,能运用反应焓变合理选择和利用化学反应。
核心考点核心命题角度考题取样命题情境素养能力化学反应中能量变化的有关概念 结合能量变化图像判断吸热反应和放热反应2016海南,11学习探索归纳与论证结合反应历程考查化学反应能量变化(新角度)2020天津,10学术探索归纳与论证热化学方程式结合物质的燃烧热或物质的能量书写热化学方程式(新角度)2020全国卷Ⅰ,28(1)学习探索理解与辨析盖斯定律的应用及反应热的计算和大小比较根据键能计算反应热2015新课标全国卷Ⅱ,27(1)生活实践归纳与论证根据盖斯定律计算反应热(热点角度)2019全国卷Ⅲ,28(2)学习探索归纳与论证高考怎么考高考中常结合基本概念考查热化学方程式的书写和反应热的计算等,体现高考命题的基础性;也会结合最新科研成果中的反应历程等考查反应过程中的能量变化,体现高考命题的创新性。
预计2022年高考中,有关反应热的考查内容将不断拓宽,对热化学方程式的书写及盖斯定律的应用要求会有所提高,另外试题很可能涉及能源问题,引导考生形成与环境和谐共处、合理利用自然资源的观念。
考点1 化学反应中能量变化的有关概念考点帮·必备知识通关考法帮·解题能力提升考法1 化学反应中的能量变化考点2 热化学方程式考点帮·必备知识通关考法帮·解题能力提升考法2 热化学方程式的正误判断与书写考点3 盖斯定律的应用及反应热的计算和大小比较考点帮·必备知识通关考法帮·解题能力提升考法3 反应热的计算考法4 反应热的大小比较11.反应热、焓变(1)反应热:在等温条件下,在化学反应过程中吸收或放出的热量称为反应热。

知识点总结化学反应与能量变化第1课时化学反应与热能燃料燃烧释放的热量知识点1、化学反应中能量变化的主要形式:①化学能与热能主要为燃料通过燃烧将化学能转化为热能②化学能与电能通过原电池、电解池装置③化学能与光能2、化学变化中能量变化与化学键的关系:成键释放能量,断键吸收能量。
3、化学反应中的能量变化规律:化学反应所释放的能量是现代能量的主要来源之一。
化学反应一般是以热量和功的形式跟外界环境进行能量交换的,而其中多以热量的形式进行能量交换。
(1)化学反应的特征是有新物质生成,生成物与反应物所具有的总能量不同。
(2)任何化学反应除遵循质量守恒外,同样也都遵循能量守恒。
(3)反应物与生成物的能量差若以热量形式表现即为放热反应或吸热反应。
4、物质稳定性和键能的关系物质的键能越大稳定性越强,具有的能量越低。
5、化学反应中能量变化与反应物和生成物总能量的关系图示,常见图示如下6、吸热反应、放热反应7、不同燃料燃烧时放出的热量不同,即使是同一燃料状态不同,释放的热量也不同,燃料燃烧是产生热量主要来源,其他的化学反应也会伴随热量变化。
8、化石燃料燃烧存在的问题和解决方法(1)问题:不可再生、排放粉尘、SO2、NO X、CO等大气污染物。
(2)解决方法:节能充分有效的利用能源:例如改进锅炉和燃料空气的比、清理积灰、使用节能灯、改进电动机的材料和结构、钢铁厂余热的利用等寻找新能源:太阳能、风能、地热能、海洋能、氢能。
练习题1、下列说法正确的是()A.需加热才能发生的反应一定是吸热反应B.放热的反应在常温下一定易进行C.反应是放热还是吸热由反应物和生成物所具有的能量的相对大小决定D.吸热反应在一定条件下也进行2、已知反应:X+YM+N为放热反应,对该反应的下列说法中正确的是( )A.X的能量一定高于MB.Y的能量一定高于NC.X和Y的总能量一定高于M和N的总能量D.因为该反应为放热反应,故不必加热反应就可发生3、有人预言:H2是2l世纪最理想的能源,其根据不正确的是()A.生产H2的原料来源广阔B.在等质量的可燃气体中,H2燃烧时放出的热量多C.H2易液化,携带方便D.燃烧时无污染4、下列燃料中,不属于化石燃料的是()A.汽油B.煤C.天然气D.氢气5、下列有关“燃烧”的叙述不正确的是()A.燃烧是发光、发热的化学反应B.燃烧必须有O2参加C.燃烧一定有H2O生成D.燃烧一定是氧化还原反应6若石油井着火。



第六章化学反应与能量第一节化学反应与能量变化【学习目标】1.知道化学反应可以实现化学能与热能的转化,认识吸热和放热反应。
2.能用化学键解释某些吸热反应和放热反应。
3.设计实验认识构成原电池的条件。
4.理解原电池的概念及工作原理,能正确判断原电池的正负极。
5.知道干电池、充电电池、燃料电池等化学电源的特点。
6.掌握构成电池的要素,了解不同电极材料对电池性能的影响。
7.能正确书写简单化学电源的电极反应式。
【基础知识】一、化学反应与热能1、实验探究(1)向Mg与稀盐酸反应的溶液中插入温度计,温度计显示的温度升高,说明该反应为放热反应。
(2)将20 g Ba(OH)2·8 H2O晶体粉末与10 g NH4Cl晶体混合放入烧杯中,将烧杯放在滴有几滴水的木片上。
用玻璃棒快速搅拌,闻到有刺激性气味时用玻璃片盖上烧杯,用手触摸杯壁下部感觉冰凉,烧杯与木片间有结冰现象,说明该反应为吸热反应。
2、放热反应与吸热反应(1)放热反应:释放热量的化学反应,如活泼金属与酸的反应,燃烧反应,中和反应等。
(2)吸热反应:吸收热量的化学反应,如氢氧化钡与氯化铵的反应,盐酸与碳酸氢钠的反应,灼热的炭与二氧化碳的反应。
3、化学反应存在能量变化的原因(1)从化学键的变化理解——主要原因(2)从物质储存化学能的角度理解宏观解释放热反应示意图吸热反应示意图化学反应 放出热量化学反应 吸收热量①放热反应可以看成是反应物所具有的 化学 能转化为 热 能释放出来。
②吸热反应可以看成是 热 能转化为 化学 能被生成物所“储存”。
4、人类对能源的利用 (1)利用的三个阶段柴草时期——树枝杂草 ↓化石能源时期—— 煤 、 石油 、 天然气 ↓多能源结构时期——太阳能、氢能、核能、海洋能、风能、地热能等(2)化石燃料利用过程中亟待解决的两方面问题 ①一是其短期内 不可再生 ,储量有限;②二是煤和石油产品燃烧排放的粉尘、 SO 2、NO x 、CO 等是大气污染物的主要来源。


化学反应与能量李仕才第一节化学能与热能考点一焓变和反应热1.化学反应的实质与特征:(1)实质:反应物中化学键断裂和生成物中化学键形成。
(2)特征:既有物质变化,又伴有能量变化;能量转化主要表现为热量的变化。
2.焓变、反应热:(1)反应热:化学反应过程中吸收或放出的能量。
(2)焓变:在恒压条件下进行的反应的热效应,符号:ΔH,单位:kJ/mol或kJ·mol-1。
(3)产生原因。
3.吸热反应和放热反应的比较:4.活化能与焓变的关系图解(1)在无催化剂的情况下:E1为正反应的活化能;E2为逆反应的活化能;ΔH=E1-E2为此反应的焓变。
(2)催化剂的作用:降低E1、E2,但不影响ΔH,反应放热还是吸热取决于起点(反应物)和终点(生成物)能量的高低。
判断正误(正确的打“√”,错误的打“×”)1.伴随着能量变化的物质变化都是化学变化。
( ×)2.反应C(s)+CO2(g)===2CO(g) ΔH>0,则反应物断裂化学键吸收的总能量低于产物形成化学键放出的总能量。
( ×)3.物质发生化学变化都伴有能量的变化。
( √)4.Na转化为Na+时,吸收的能量就是该过程的反应热。
( ×)5.同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同。
( ×)6.可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关。
( √)1.化学反应中的能量变化通常表现为热量变化,还表现为光能变化、电能变化、机械能变化,热量变化不是唯一的表现形式。
2.化学反应的本质是旧化学键断裂和新化学键形成,任何化学反应都具有热效应。
3.有能量变化的过程不一定是吸热反应和放热反应,如物质的物理变化过程中,也会有能量的变化,不属于吸热反应或放热反应。
如浓硫酸、NaOH 溶于水放出热量,NH 4NO 3溶于水吸收热量,但它们不是化学反应,其放出或吸收的热量不属于反应热。
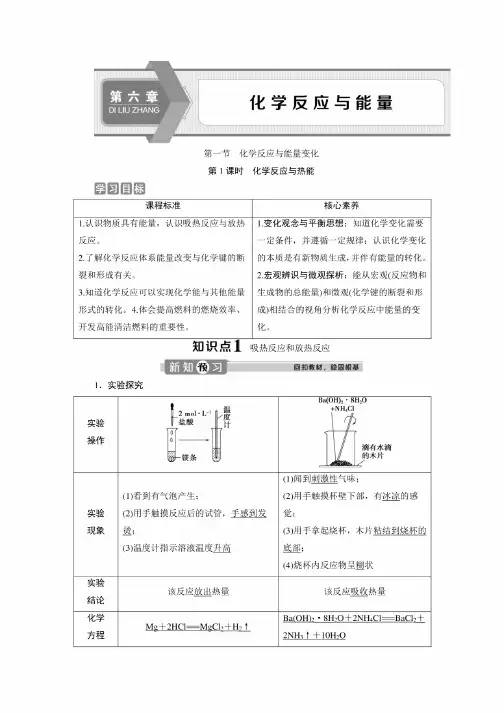
第一节化学反应与能量变化第1课时化学反应与热能圈回国喝课程标准核心素养1.认识物质具有能量,认识吸热反应与放热反应。
2.了解化学反应体系能量改变与化学键的断裂和形成有关。
3.知道化学反应可以实现化学能与其他能量形式的转化。
4.体会提高燃料的燃烧效率、开发高能清洁燃料的重要性。
1.变化观念与平衡思想:知道化学变化需要一定条件,并遵循一定规律;认识化学变化的本质是有新物质生成,并伴有能量的转化。
2.宏观辨识与微观探析:能从宏观(反应物和生成物的总能量)和微观(化学键的断裂和形成)相结合的视角分析化学反应中能量的变化。
知]识点1吸热反应和放热反应1.实验探究实验操作ff_2mol-L-1卜盐酸带0-------->寻-镁条BBa(OH)2-8H2O+NH4C1滴有水滴的木片实验现象(1)看到有气泡产生;(2)用手触摸反应后的试管,手感到发烫;(3)温度计指示溶液温度ft匾(1)闻到刺激性气味;(2)用手触摸杯壁下部,有冰凉的感觉;(3)用手拿起烧杯,木片粘结到烧杯的底部;(4)烧杯内反应物呈糊状实验结论该反应放出热量该反应吸收热量化学方程Mg+2HCl=MgCh+H2fBa(OH)2•8H2O+2NH4Cl=BaC12+2NH3f+IOH2O式2.概念(1)放热反应:释放热量的化学反应。
(2)吸热反应:吸收热量的化学反应。
3.常见的吸热反应和放热反应(1)常见的放热反应:金属与水或酸的反应、燃烧反应、大多数化合反应、中和反应等。
(2)常见的吸热反应:氢氧化钗晶体与氯化俊的反应、盐酸与碳酸氢钠的反应、C+ CO2岌土2CO、C+H2O(g)^=CO+H2,大多数分解反应等。
1.下列反应不一定属于放热反应的是()A.燃烧反应B.H2SO4与Ba(OH)2溶液的反应C.Mg与盐酸的反应D.复分解反应解析:选D。
所有燃烧反应、金属与酸的反应、中和反应都属于放热反应,复分解反应则不一定属于放热反应。
2.下列反应既属于氧化还原反应,又属于吸热反应的是()A.铝片与稀盐酸的反应B.Ba(OH)2•8H2O与NH4C1的反应C.灼热的碳与C02的反应D.甲烷在氧气中的燃烧解析:选C。
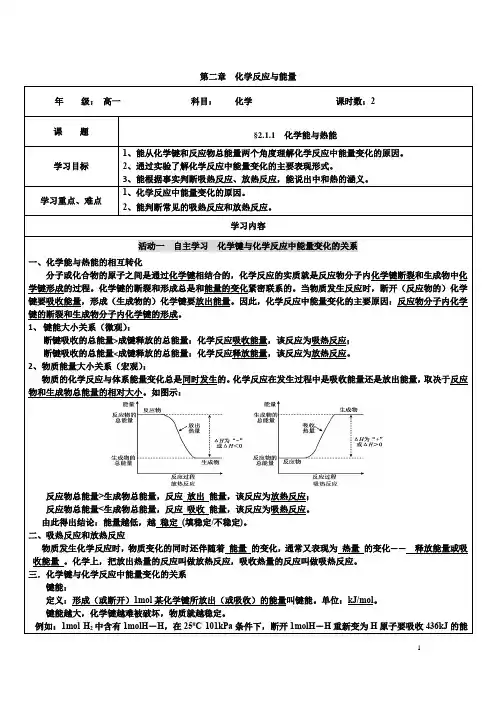
第二章化学反应与能量活动一自主学习化学键与化学反应中能量变化的关系一、化学能与热能的相互转化分子或化合物的原子之间是通过化学键相结合的,化学反应的实质就是反应物分子内化学键断裂和生成物中化学键形成的过程。
化学键的断裂和形成总是和能量的变化紧密联系的。
当物质发生反应时,断开(反应物的)化学键要吸收能量,形成(生成物的)化学键要放出能量。
因此,化学反应中能量变化的主要原因:反应物分子内化学键的断裂和生成物分子内化学键的形成。
1、键能大小关系(微观):断键吸收的总能量>成键释放的总能量:化学反应吸收能量,该反应为吸热反应;断键吸收的总能量<成键释放的总能量:化学反应释放能量,该反应为放热反应。
2、物质能量大小关系(宏观):物质的化学反应与体系能量变化总是同时发生的。
化学反应在发生过程中是吸收能量还是放出能量,取决于反应物和生成物总能量的相对大小。
如图示:反应物总能量>生成物总能量,反应放出能量,该反应为放热反应;反应物总能量<生成物总能量,反应吸收能量,该反应为吸热反应。
由此得出结论:能量越低,越稳定(填稳定/不稳定)。
二、吸热反应和放热反应物质发生化学反应时,物质变化的同时还伴随着能量的变化,通常又表现为热量的变化—— 释放能量或吸收能量。
化学上,把放出热量的反应叫做放热反应,吸收热量的反应叫做吸热反应。
三.化学键与化学反应中能量变化的关系键能:定义:形成(或断开)1mol某化学键所放出(或吸收)的能量叫键能。
单位:kJ/mol。
键能越大,化学键越难被破坏,物质就越稳定。
例如:1mol H2中含有1molH-H,在250C 101kPa条件下,断开1molH-H重新变为H原子要吸收436kJ的能13、下列说法中不正确的是()A.化学反应中能量的变化只能表现为热量变化B.化学反应在发生物质变化的同时还伴随着能量的变化,这是化学反应的一大特征C.化学能是能量的一种形式,它可以转化为其它形式的能量,如热能、电能等D.放热反应不需要加热即可发生E.吸热反应必须加热才能发生F.需要加热条件的化学反应都是吸热反应G.任何化学反应都伴随有能量的变化H.反应物的总能量高于生成物的总能量时,发生放热反应I.反应物的总能量低于生成物的总能量时,发生吸热反应J.需要持续加热才能进行的反应一般都是是吸热反应14、下列反应中既属于氧化还原反应又属于放热反应的是()A.氢氧化钾与硫酸的反应B.锌与盐酸反应放出氢气C.镁条在空气中燃烧D.Ba(OH)2•8H2O与NH4Cl反应15、对于放热反应2H2+O22H2O,下列说法正确的是()A.产物H2O 所具有的总能量高于反应物H2和O2所具有的总能量B.反应物H2和O2具有的能量相等C.断开2molH—H键和1molO—O键吸收的总能量小于形成4molO—H键所放出能量D.该反应中,化学能只有转变为热能16、如图所示,把试管小心地放入盛有(20℃)碳酸饮料的烧杯中,试管中开始放入适量饱和CuSO4溶液,再用滴管滴加5mL浓硫酸于试管中,试回答下列问题:(1)实验中观察到的现象是________________。
化学能与热能化学能与热能是两种重要的能量形式,它们在生产和生活中扮演着不可替代的角色。
本文将从定义、性质、转化等方面分别介绍化学能与热能。
一、化学能1. 定义化学能是指化学物质中含有的可供释放出来做功的能量。
一般来说,具有化学能的物质都是经过化学反应才能转化为其他物质,同时释放出能量。
2. 性质化学能的特点是容易储存,方便使用,且可以通过反应实现转化。
例如,化学电池就属于化学能的一种储存形式,可以通过电池反应来释放电能。
在这个过程中,化学能被转化为电能,然后再转化为为机械能、光能等不同形式的能量。
化学能的另一个性质就是能够释放出大量的热能。
例如,燃烧是一种常见的化学反应,其中燃料物质的化学能被迅速释放,同时放出大量的热能。
这种热能可以被用于加热房间、发动汽车等。
化学能的最后一个特点是容易受到化学物质、温度和压力等因素的影响。
例如,如果化学物质受到氧化或还原的作用,化学能就会发生改变;如果物质的温度和压力发生变化,化学反应的速度和效果也会发生变化。
3. 转化化学能可以被转化为其他形式的能量,例如电能、机械能、光能等。
以下是一些常见的化学能的转化方式:(1)电能:利用化学电池的反应将化学能转化为电能。
(2)机械能:利用发动机的化学反应将化学能转化为机械能。
(3)光能:利用光化学反应将化学能转化为光能。
(4)热能:利用燃烧反应将化学能转化为热能。
二、热能1. 定义热能是物体内部分子和原子的运动能量,也可以理解为物体温度上升的能量。
热能在自然和人类生活中起着重要作用,我们可以用它来制热、发电、炼钢、焊接等工作。
2. 性质热能的特点是容易传递和储存,且可以通过温度差实现转化。
例如,我们可以通过将热能在不同的物体和环境中传递来实现能量的储存和转化。
在这个过程中,热能可以被转化为电能、机械能等不同形式的能量。
热能的另一个性质就是可以被吸收和释放。
例如,我们可以使用太阳能板来吸收太阳辐射下的热能;我们也可以利用电子元件的热效应来产生电能。