氢氧化钙
- 格式:doc
- 大小:23.50 KB
- 文档页数:5

氢氧化钙(MSDS)氢氧化钙是一种常见的化学物质,具有许多不同的用途。
以下是有关氢氧化钙的材料安全数据表(MSDS)。
1. 产品标识- 产品名称:氢氧化钙- 化学名称:氢氧化钙- 分子式:Ca(OH)2- CAS号:1305-62-02. 成分信息- 主要成分:氢氧化钙(Ca(OH)2)至少占总体积的90%- 其他成分:可能存在小量的杂质或添加剂3. 物理和化学性质- 外观:白色固体- 气味:无气味- pH值:饱和溶液pH大约为12.5- 溶解性:可溶于水,在水中生成钙离子和氢氧根离子- 熔点:580℃- 沸点:不适用4. 危险性评估- 对人体健康的影响:- 吸入:可引起呼吸道不适- 食入:可能对胃、肠、皮肤和眼睛有刺激作用- 接触:可引起皮肤刺激和灼伤- 对环境的影响:可能对水生生物产生毒性影响5. 急救措施- 吸入:将受害人移到空气新鲜处,如有呼吸困难,立即就医- 食入:给受害人大量饮用温水,不要诱导呕吐,就医- 接触:用大量水冲洗受影响的皮肤区域,如有不适,就医- 眼睛:立即用清水冲洗至少15分钟,就医6. 防护措施和个人防护装备- 眼睛/面部防护:佩戴密封眼镜或安全面罩- 手部防护:佩戴耐化学品的手套- 其他:穿戴适当的防护服7. 安全操作指南- 储存:储存在干燥、清洁、通风良好的地方,远离可燃物和氧化剂- 处理和储存注意事项:避免与皮肤、眼睛和衣物接触,远离食物和饮料- 废弃物处理:按照当地法规处理废弃物以上是有关氢氧化钙的材料安全数据表(MSDS)的简要信息。
这只是一个参考,具体情况请参考实际的MSDS表。

第一部分:化学品名称1.1 中文名称:氢氧化钙1.2 英文名称:Calcium hydroxide1.3 中文别名:熟石灰1.4 英文别名:Slaked lime1.5 推荐用途:实验室用化验、试验及科学实验。
1.6 限制用途:不可作为药品、食品、家庭或其它用途。
第二部分:危险性概述2.1 紧急情况概述:造成皮肤刺激。
造成严重眼损伤。
可能引起呼吸道刺激。
对水生生物有害过量接触需采取特殊急救措施和进行医疗随访。
火灾时:使用二氧化碳、沙粒、灭火粉末灭火。
如必要的话,戴自给式呼吸器去救火。
2.2 GHS危险性分类:皮肤刺激(类别2);严重眼睛损伤(类别1);特异性靶器官系统毒性(一次接触) (类别3);呼吸系统急性水生毒性(类别3)。
2.3 物理化学危险性信息:不适用2.4 健康危害:造成皮肤刺激。
造成严重眼损伤。
可能引起呼吸道刺激。
2.5 环境危害:对水生生物有害。
2.6 其他危害物:无资料。
第三部分:成分/组成信息3.1 主要成分:氢氧化钙3.2 含量:≤100%3.3 CAS No.:1305-62-0第四部分:急救措施4.1 必要的急救措施描述:吸入:如果吸入,请将患者移到新鲜空气处。
如呼吸停止,进行人工呼吸。
请教医生。
皮肤接触:用肥皂和大量的水冲洗。
立即将患者送往医院。
请教医生。
眼睛接触:用大量水彻底冲洗并请教医生。
食入:禁止催吐。
切勿给失去知觉者从嘴里喂食任何东西。
用水漱口。
请教医生。
4.2 主要症状和影响,急性和迟发效应:4.3 及时的医疗处理和特殊治疗的说明和提示:无资料。
第五部分:消防措施5.1 特别危险性描述:无资料。
5.2 灭火方法或灭火剂:火灾时:使用二氧化碳、沙粒、灭火粉末灭火。
5.3 灭火注意事项及措施:如必要的话,戴自给式呼吸器去救火。
第六部分:泄漏应急处理6.1 作业人员的防护措施、防护设备和应急处置程序:使用个人防护用品。
避免吸入蒸气、烟雾或气体。
保证充分的通风。
移去所有火源。

氢氧化钙介绍白色结晶性粉末。
无味。
通常含有微量水分。
d 2. 08~2. 34。
溶于酸、甘油、蔗糖、氯化铵溶液,微溶于水,不溶于乙醇。
25℃时饱和水溶液的pH值为12.4。
在空气中易吸收二氧化碳变为碳酸钙。
最后更新:2022-01-01 09:01:17氢氧化钙 - 制法开放数据可信数据将石灰石煅烧为氧化钙,与水按一定的比例混合消化,得到氢氧化钙料液,经净化分离除去杂质,再脱水,之后于150~300℃下干燥即可。
最后更新:2022-01-01 09:01:18氢氧化钙 - 介绍微有苦碱味。
易吸收空气中二氧化碳生成碳酸钙,灼热失去水成氧化钙。
在25℃时饱和水溶液pH为12.4。
能溶于甘油、蔗糖溶液和氯化铵溶液,溶于酸时能产生大量热,微溶于水。
有腐蚀性。
半数致死量(大鼠,经口)7.34g/kg。
最后更新:2022-10-16 17:13:09氢氧化钙 - 用途开放数据可信数据分析试剂。
可用作吸收剂、硬水软化剂、消毒剂、抗酸剂、缓冲剂、中和剂、固化剂等。
对于酸性气体,如二氧化碳。
它还可用作橡胶、医药和石化产品的添加剂。
最后更新:2022-01-01 09:01:18氢氧化钙 - 安全性开放数据可信数据大鼠经口LD50:7340mg/kg。
属强碱性物质,有刺激和腐蚀作用。
吸入粉尘,对呼吸道有强烈刺激性,还有可能引起肺炎。
眼接触亦有强烈刺激性,可致灼伤。
最高允许浓度为5mg/m3。
工作人员应做好防护,若不慎进入眼睛,应立即用清水冲洗。
贮存于阴凉、干燥、通风良好的库房。
最后更新:2022-01-01 09:01:18。
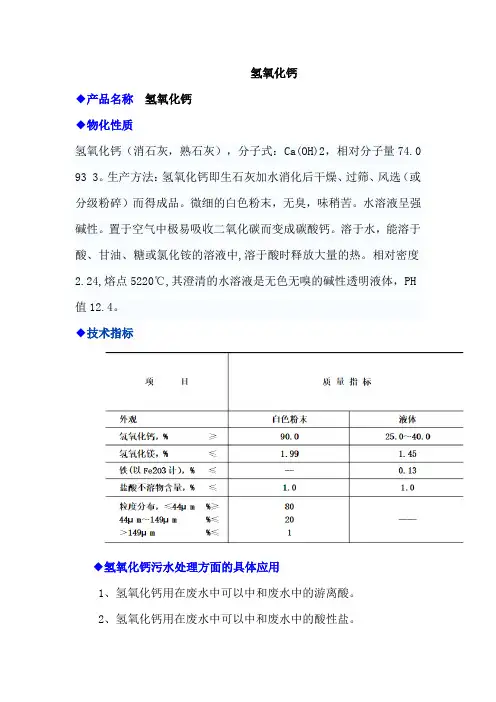
氢氧化钙
◆产品名称氢氧化钙
◆物化性质
氢氧化钙(消石灰,熟石灰),分子式:Ca(OH)2,相对分子量74.0 93 3。
生产方法:氢氧化钙即生石灰加水消化后干燥、过筛、风选(或分级粉碎)而得成品。
微细的白色粉末,无臭,味稍苦。
水溶液呈强碱性。
置于空气中极易吸收二氧化碳而变成碳酸钙。
溶于水,能溶于酸、甘油、糖或氯化铵的溶液中,溶于酸时释放大量的热。
相对密度2.24,熔点5220℃,其澄清的水溶液是无色无嗅的碱性透明液体,PH 值12.4。
◆技术指标
◆氢氧化钙污水处理方面的具体应用
1、氢氧化钙用在废水中可以中和废水中的游离酸。
2、氢氧化钙用在废水中可以中和废水中的酸性盐。
3、氢氧化钙用在废水中,其中氢氧化钙中的氢氧根离子可以与金属离子反应生产不溶于水的沉淀物。
4、氢氧化钙用在废水中,可以调节废水的PH值至碱性,这样可以更好的使金属氢氧化物沉淀。
◆氢氧化钙配制
计算配比,直接溶解
◆注意事项
1、存放在干燥库房中,防潮,避免与酸类物接触。
2、运输过程中避免受潮,小心轻放,以防止包装破损而影响产品质量。
3、禁止食用,万一入口,用水漱口立即求医。
(切记不能饮水,生石灰是碱性氧化物遇水会腐蚀!。

氢氧化钙类别
1氢氧化钙简介
氢氧化钙(Calcium Hydroxide)又称苛性钙、清水石,是一种十分普遍的无机化合物,化学计量式为Ca(OH)2,为白色结晶固体,极容易溶于水,并能将水分解为氢氧根离子,即生成稀碱液。
苛性钙晶体可以用水磨成粉末,也可以熔融成片,有散热收敛性,在常温下任何物理状态下均具有苛性反应,它具有使用方便,存储成本低等特点,为我们的生活所普遍使用。
2主要用途
(1)氢氧化钙在建筑工业中,常用于回浆剂、水凝胶、泥砂浆等中,能发挥出十分出色的膨胀性、化学稳定性,从而起着拉强混凝土结构性能的作用,特别在消胶及减少混凝土路面抗滑性能提高方面有得天独厚的优势。
(2)氢氧化钙可用于除草剂、膨胀剂、增强剂,水凝胶、回浆剂、活性炭等,不仅可用于水处理,还可用于多种助剂的制作。
(3)氢氧化钙具有良好的除湿性,可用来除去大气湿度,被用于空调节能,除去仓房温度太低的不良后果,有效提高空气质量。
(4)氢氧化钙可用于水洗染色的染料的脱色和软化,是洗涤过程中不可缺少的化工产品,也可用于建筑材料的硫酸洗涤,方便与可靠。
3总结
氢氧化钙是苛性钙,它是一种无机化合物,可以用水磨成粉末,也可以熔融成片。
它具有良好的膨胀性、脱色性、聚合性、增强性和抗滑性,能够很好地拉强混凝土结构,可以用于建筑材料的硫酸洗涤,以及除湿性。
它的使用范围很广泛,正因此,它才被广泛应用于建筑材料的结构,企业的清洗和其他工业应用领域。

氢氧化钙分解
1 氢氧化钙
氢氧化钙是一种常见的化学物质,分子式为Ca(OH)2,它是一种无机化合物,也被称为单水氢氧化钙或双水氢氧化钙。
氢氧化钙是一种有用的化学产品,广泛用于工业及日常生活中。
2 分解过程
氢氧化钙分解是一个重要的化学反应,也是一种制备氢氧化钠的重要方法。
它的分解过程是利用水将氢氧化钙分解成氢氧化钠和固体钙,反应式为:`2Ca(OH)_2 + 2H_2O → 2Ca(OH)_4 + 2H_2O + CaCO_3`。
3 反应条件
它的反应受温度、PH值、水质等因素影响,不同条件下分解前后对物质的结合性有不同的影响。
温度越高,反应速度越快,反应最适宜范围是90到100摄氏度;PH值要足够高,水质也要足够纯净,最好不要包含铁和其他金属离子,因为它们会影响分解的结果。
4 应用
氢氧化钙的分解是一种常用的工业生产工艺,常被用于化学、纺织和食品工业,在医药行业和农业行业也有广泛的应用。
它也可以制备氢氧化钠,用于制造家庭纸制品、日用品等产品,也用于水处理,调和水质,以便使用。


氢氧化钙方程式【目录】一、氢氧化钙的定义1.1 定义1.2 结构二、氢氧化钙的化学方程式2.1 氢氧化钙的化学式2.2 氢氧化钙反应的描述2.3 氢氧化钙的化学式方程三、氢氧化钙的用途3.1 生活中的应用3.2 工业的应用一、氢氧化钙的定义1.1 定义氢氧化钙(Calcium Hydroxide)也称作“毒灰”,是一种白色粉末状的具有腐蚀性的盐酸族混合物,具有腐蚀性,主要由钙和氢氧化物组成,成分为Ca(OH)2,故常被称为Ca(OH)2,是用来作为消毒材料和漂白剂。
1.2 结构毒灰是钙和氢氧化物的结合物,其分子定义如下:钙原子与两个氢氧化物分子形成CO2)2,分子结构的表示如下:Ca(OH)2是一种均质的固体,具有较强的碱性反应。
二、氢氧化钙的化学方程式2.1 氢氧化钙的化学式氢氧化钙的化学式为Ca(OH)2,氢氧化钙是由水和钙组成的混合物,也称作“毒灰”,在液态状态下一定会有溶解,氢氧化钙可以用 H2O 水化解产生滴定性,也可以直接发生化学反应。
2.2 氢氧化钙反应的描述氢氧化钙反应的描述:将氢氧化钙与水悬挂使用,二者可发生饱和反应:Ca(OH)2+2H2O-> Ca(H2O)2+2OH,在水中氢氧化钙会分解成钙离子 Ca2+ 和碱性离子 OH-,可以用 OH- 及 Ca2+ 来处理盐水,因为钙离子具有较好的腐蚀力,在处理 ugw 和污水时可有效控制盐度,从而达到更好的去除效果。
2.3 氢氧化钙的化学式方程氢氧化钙的化学式方程:Ca(OH)2+2HCl->CaCl2+2H2O。
这是氢氧化钙与HCl 可发生的化学反应,在反应的过程中HCl 会水解,将氢氧化钙转化成钙盐,即 CaCl2,同时 2mol 的水也被分解。
三、氢氧化钙的用途3.1 生活中的应用氢氧化钙在日常生活中还有许多应用:(1)常用作机械版钱币或纸币的表面处理剂,可以把钱币或纸币充分消毒,以延长它们的使用寿命;(2)用于添加饲料,使饲料中的胡萝卜素含量较高,与钙结合后能有效促进动物体内的新陈代谢;(3)也可以添加到润滑油中,以改善润滑油的质量,降低其粘度,使润滑油更易于滴落,减少机械部件之间的摩擦和损坏。

氢氧化钙(1305-62-0)化学品简介【中文名称】氢氧化钙【英文名称】calcium hydroxide【中文同义词】熟石灰氢氧化钙熟石灰) (氢氧化钙苛石灰农用石灰,消石灰氢氧化钙,氧化钙石灰石灰乳石灰浆, 石灰无光釉石灰乳, 石灰消)熟( ,熟石灰消石灰消石灰,熟石灰消石灰) 熟石灰氫氧化鈣( 氫氧化鈣苛石灰【英文同义词】CALCIUM HYDRATECALCIUM HYDROXIDECALCIUM HYDROXIDE SOLUTIONCALCIUM HYDROXIDE TSCALCIUM (II) HYDROXIDECALCIUM OXIDE, HYDRATEDHYDRATED LIMEHYDRATED LIMELIME HYDRATELIME (HYDRATED)LIME, SLAKEDLIME WATERSLAKED LIMEagriculturallimeBell minebellminebiocalcCa(OH) 2Calcium hydroxide (Ca(OH)) 2calciumdihydroxide calciumhydroxide(Ca(OH))2【CAS No.】1305-62-0【分子式】Ca(OH)2【分子量】74.09危险性概述【健康危害】本品属强碱性物质,有刺激和腐蚀作用。
吸入本品粉尘,对呼吸道有强烈刺激性。
可引起化学性肺炎。
眼接触有强烈刺激性,可致灼伤。
误落入消石灰池中,能造成大面积腐蚀灼伤,如不及时处理可致死亡。
长期接触可致皮炎和皮炎溃疡。
【环境危害】对环境有危害,对水体可造成污染。
【燃爆危险】本品不燃,具腐蚀性、强刺激性,可致人体灼伤。
急救措施【皮肤接触】立即脱去污染的衣着,先用植物油或矿物油清洗。
用大量流动清水冲洗至少15分钟。
就医。
【眼睛接触】立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。
就医。
【吸入】迅速脱离现场至空气新鲜处。
保持呼吸道通畅。

氢氧化钙化学式摩尔质量俗称氢氧化钙(化学式:Ca(OH)2),又称石灰水或氢氧化钙溶液,是一种常见的无机化合物。
它的摩尔质量为74.093 g/mol。
氢氧化钙在工业和日常生活中有着广泛的应用,下面将详细介绍它的一些特性和用途。
氢氧化钙是一种无色结晶固体,可溶于水,但溶解度相对较低。
它的溶解会产生氢氧化钙溶液,这是一种碱性溶液,常用来进行酸碱中和反应。
由于其强碱性,氢氧化钙可以与酸反应生成盐和水,这种反应被广泛用于工业生产中的中和处理。
氢氧化钙在建筑材料行业中也有重要的应用。
它可以用作石灰石、石膏和其他材料的制备原料。
通过与二氧化碳反应,氢氧化钙可以转化为碳酸钙,这是一种广泛应用于建筑材料中的物质。
此外,氢氧化钙还可以用于调节土壤酸碱度,促进植物生长。
除了建筑材料行业,氢氧化钙在环境保护领域也有重要作用。
它可以用来处理废水和废气中的酸性物质,将其中和为中性或碱性,以减少对环境的污染。
此外,氢氧化钙还可以用于饮用水和游泳池水的净化,可以中和水中的酸性物质,使水质更加安全和清洁。
氢氧化钙还被广泛应用于食品工业中。
它可以作为食品添加剂,用于调节食品的酸碱度和稳定性。
例如,在面包制作过程中,氢氧化钙可以中和面团中的酸性物质,提高面包的品质和延长其保鲜期。
此外,氢氧化钙还可以用于油脂加工中,用来中和油脂中的酸性物质,提高油脂的质量和稳定性。
除了以上应用,氢氧化钙还用于制备其他化合物。
例如,通过与硫酸反应,可以得到硫酸钙,这是一种重要的工业原料。
此外,氢氧化钙还可以用于制备一些药物和化妆品等产品,具有重要的经济价值。
总结起来,氢氧化钙是一种重要的无机化合物,具有广泛的应用领域。
它在建筑材料、环境保护和食品工业中都有重要作用,并且还可以用于制备其他化合物。
通过了解氢氧化钙的特性和应用,可以更好地理解它在各个领域中的重要性,并且为其合理利用提供了参考。

氢氧化钙是什么
1、氢氧化钙是一种强碱,具有杀菌与防腐能力,对皮肤,织物有腐
蚀作用。
2、通常指溶液能使特定指示剂变色的物质(如使紫色石蕊溶液变蓝,使无色酚酞溶液变红等),在标准情况下(浓度为0.1mol/L),pH>12。
在水溶液中电离出的阴离子全部是氢氧根离子,与酸反应形成盐和水。
所谓强碱、弱碱是相对而言,碱溶于水能发生完全电离的,属于强碱。
碱金属和部分碱土金属对应的碱一般是强碱。
扩展资料:
应用领域:
1、可作生产碳酸钙的原料。
2、氢氧化钙属碱性,因而可以用于降低土壤的酸性,从而起到改良
土壤结构的作用。
农药中的波尔多液正是利用石灰乳(溶于水的氢氧化钙)和硫酸铜水溶液按照一定的比例配制而出的。
冬天,树木过冬防虫,树木
根部以上涂80公分的石灰浆。
3、优质品主要用于生产环氧氯丙烷、环氧丙烷。
4、可用在橡胶、石油化工添加剂中,如石油工业加在润滑油中,可防
止结焦、油泥沉积、中和防腐。
5、用于制取漂白粉、漂粉精、消毒剂、制酸剂、收敛剂、硬水软化剂、土壤酸性防止剂、脱毛剂、缓冲剂、中和剂、固化剂等。
6、氢氧化钙和空气中二氧化碳还会发生反应从而形成难溶于水的碳酸钙。
制糖工业生产中,先利用氢氧化钙中和糖浆中的酸,然后通入二氧化碳和剩余氢氧化钙反应生成沉淀物被过滤出去,以此减少糖的酸味。
一、化学品及企业标识中文名称:氢氧化钙英文名称:calcium hydroxide中文同义词:熟石灰,氢氧化钙,熟石灰,苛石灰(氢氧化钙)英文同义词:CALCIUM HYDRATE;CALCIUM HYDROXIDECAS No.:1305-62-0分子式:Ca(OH)2分子量:二、成分组成信息成分:氢氧化钙三、危险性概述健康危害:本品属强碱性物质,有刺激和腐蚀作用。
吸入本品粉尘,对呼吸道有强烈刺激性。
可引起化学性肺炎。
眼接触有强烈刺激性,可致灼伤。
误落入消石灰池中,能造成大面积腐蚀灼伤,如不及时处理可致死亡。
长期接触可致皮炎和皮炎溃疡。
环境危害:对环境有危害,对水体可造成污染。
燃爆危险:本品不燃,具腐蚀性、强刺激性,可致人体灼伤。
四、急救措施皮肤接触:立即脱去污染的衣着,先用植物油或矿物油清洗。
用大量流动清水冲洗至少15分钟。
就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。
就医。
吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
食入:用水漱口,给饮牛奶或蛋清。
就医。
五、消防措施危险特性:未有特殊的燃烧爆炸特性。
有害燃烧产物:氧化钙。
灭火方法:消防人员必须穿全身防火防毒服,在上风向灭火。
灭火时尽可能将容器从火场移至空旷处。
六、泄漏应急处理应急处理:隔离泄漏污染区,限制出入。
建议应急处理人员戴防尘面具(全面罩),穿防毒服。
避免扬尘,小心扫起,若大量泄漏,用塑料布、帆布覆盖。
收集回收或运至废物处理场所处置。
七、操作处置与储存操作注意事项:密闭操作。
操作人员必须经过专门培训,严格遵守操作规程。
建议操作人员佩戴防尘面具(全面罩),穿连衣式胶布防毒衣,戴橡胶手套。
避免产生粉尘。
避免与酸类接触。
搬运时要轻装轻卸,防止包装及容器损坏。
配备泄漏应急处理设备。
倒空的容器可能残留有害物。
储存注意事项:储存于阴凉、通风的库房。
远离火种、热源。
氢氧化钙的化学方程式
氢氧化钙的化学式为Ca(OH)2,氢氧化钙在工业中有广泛的应用,它是常用的建筑材料,也用作杀菌剂和化工原料等。
氢氧化钙俗称熟石灰或消石灰,化学式为Ca(OH)2,是一种白色粉末状固体,加入水后,呈上下两层,上层水溶液称作澄清石灰水,下层悬浊液称作石灰乳或石灰浆。
上层清液澄清石灰水可以检验二氧化碳,下层浑浊液体石灰乳是一种建筑材料。
氢氧化钙与二氧化碳反应:CO2+Ca(OH)2=CaCO3↓+H2O。
氢氧化钙与酸反应,生成盐和水:2HCl+Ca(OH)2=CaCl2+2H2O。
氢氧化钙与某些盐反应,生成另一种碱和另一种盐:
①碳酸钠溶液与氢氧化钙反应:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
②氯化镁与氢氧化钙反应:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓。
③硝酸铵与氢氧化钙反应:2NH4NO3+Ca(OH)2=2NH3↑+2H2O+Ca(NO3) 2。
氢氧化钙是强碱,对皮肤、织物有腐蚀作用。
但因其溶解度不大,所以危害程度不如氢氧化钠等强碱大。
氢氧化钙能跟酸碱指示剂作用:紫色石蕊试液遇氢氧化钙显蓝色,无色酚酞试液遇氢氧化钙显红色。
氢氧化钙化学物质氢氧化钙(Ca(OH)2)是一种有机无机化合物,是一种白色粉末,常用于工业制造过程中用作保护性和表面处理剂。
虽然它看起来很简单,但是它具有复杂的特性。
首先,它是一种碱性物质,其次,氢氧化钙所具有的高活性给它在工业以及其他方面带来了多种应用。
这里,我们将探讨氢氧化钙的化学特性,以及它在工业制造上的应用。
氢氧化钙通常由碳酸钙(CaCO3)和氢氧化钠(NaOH)经过热量转换而得到。
它具有酸性和碱性特性,具有溶解金属和金属氧化物的能力,并能够作为抗腐蚀剂及表面处理剂,从而决定了它在工业制造中的重要性。
此外,氢氧化钙也具有抗菌性,表明它能够抑制大多数细菌的生长。
因此,它通常作为消毒剂和防腐剂来使用,特别是用于食物加工。
例如,它可用于消毒酒类,去除其中的细菌。
此外,它还可用于调制水,保存蔬菜,治疗食物中毒等。
此外,氢氧化钙还在冶金、玻璃制造、建筑等行业中得到了广泛的应用。
在冶金行业,它可用于去除铁的氧化物和水的氧化物,以防止金属腐蚀。
此外,它还可用于玻璃制造,作为抗腐蚀剂来防止铜,铝和镁等金属腐蚀。
在建筑行业,它可以作为一种凝结剂,用来控制水分和水泥的硬度,从而增强混凝土的强度和耐久性。
另外,氢氧化钙还可以作为去离子剂,用于生物学方面,如生物制药和分析试验。
例如,它可以用于提取特定的蛋白质,细胞成分,以及某种病原体。
此外,它还可以用于检测和分离种子细胞,以及生物细胞各种状态的检测。
总而言之,氢氧化钙是一种重要的无机化合物,具有复杂的特性和全面的应用。
它在工业制造中占据重要的地位,可用于防腐、消毒、玻璃制造、建筑等行业。
此外,它还具有抗菌性,可用于生物学领域,如生物制药、生物检验、植物细胞分子等。
此外,它除了上述应用外,还有广泛的表面处理用途,包括清洁,润湿,减少摩擦,增加耐磨性,以及维护部件耐腐蚀性,等等。
这就是关于氢氧化钙化学物质的总结。
氢氧化钙知识点氢氧化钙,俗称石灰,是一种常见的无机化合物。
它的化学式是Ca(OH)2,由一份钙离子和两份氢氧根离子组成。
在工业和农业中都有广泛的应用,本文将从化学性质、制备方法和应用方面来探讨氢氧化钙的相关知识。
一、化学性质氢氧化钙是白色粉末,无臭、微碱。
溶于水的数量极少,每升0℃所能溶解的氢氧化钙量仅有0.092g,当温度升高时,溶解度会增加。
在潮湿空气中,氢氧化钙能吸收水分,产生大量热量,水化生成Ca(OH)2·nH2O。
1. 碱性氢氧化钙是强碱性物质,能和酸反应生成盐和水。
如HCl + Ca(OH)2 → CaCl2 + 2H2O。
因此,氢氧化钙常作为化学试剂中的碱。
在生活中,我们常用它来中和或清洁酸性的物品,如清洗马桶时加入氢氧化钙可中和污垢中的盐酸。
2. 腐蚀性氢氧化钙对皮肤和黏膜有腐蚀作用,应注意避免直接接触。
假如误食、误吸入或误接触,请及时就医。
二、制备方法氢氧化钙的制备方法繁多,根据不同的生产需求可以选择不同的制备方法。
1. 石灰石加水法将石灰石加水反应得到氢氧化钙,反应式为CaCO3 + H2O + CO2 → Ca(HCO3)2,Ca(HCO3)2 → C aCO3 + CO2 + H2O,则2CaCO3 + 2H2O → Ca(OH)2 + CO2↑。
2. 石灰加水法称为灰浆法,将生石灰加水反应,生成氢氧化钙,反应式为CaO + H2O → Ca(OH)2。
3. 精制石灰加水法在加水的基础上,采取沉淀法、离心法、过滤法等方法对浸出液中的杂质进行去除,提高氢氧化钙的纯度。
4. 工业法采用炉区、电炉或还原法等多种方法得到高纯度的氢氧化钙。
三、应用方面氢氧化钙的应用极广,常常被用在建筑和农业的领域中。
1. 建筑领域氢氧化钙常被用作建筑材料中的主要成分。
由于其具有较高的碱性和吸潮性,能够防止砖墙受潮,抑制霉菌的生长,保证建筑物表面干燥,同时会对空气中的二氧化碳进行吸收,达到净化空气的效果。
氢氧化钙的理化性质
氢氧化钙是一种白色粉末状固体。
又名消石灰。
氢氧化钙具有碱的通性,是一种强碱。
氢氧化钙的碱性比氢氧化钠强(金属活动性:钙>钠),但由于氢氧化钙的溶解度比氢氧化钠小得多,所以氢氧化钙溶液的腐蚀性和碱性比氢氧化钠小。
产品别名:消石灰、熟石灰(ShúShíHuī) 、石灰水(溶液)、石灰乳(悬浊液)、石灰浆(悬浊液)。
化学式:Ca(OH)2
制备方法:将生石灰溶于水,即CaO+H2O=Ca(OH)2
相对分子质量为:约74 。
溶解度:氢氧化钙溶解度随温度升高而降低随温度降低而升高)。
理化性质
氢氧化钙具有碱的通性,是一种强碱,由于氢氧化钙的溶解度比氢氧化钠小得多,所以氢氧化钙溶液的腐蚀性和碱性比氢氧化钠小。
这些性质决定了氢氧化钙有广泛的应用。
农业上用它降低土壤酸性,改良土壤结构,很明显在这种场合用氢氧化钠是不可能的。
另外氢氧化钙与空气中的二氧化碳反应生成难溶于水的碳酸钙,也有利于药液附着于植物表面一段时间不被雨水冲掉。
氢氧化钙和二氧化碳的反应不论在化学实验室还是在工农业生产中,或者在自然界都经常发生。
经常被利用着。
石灰沙浆砌砖抹墙的事实熟为人知,鲜为人知的是制糖工业中也发生这个反应:在制糖过程中要用氢氧化钙来中和糖浆里的酸,然后再通入二氧化碳使剩余的氢氧化钙变成沉淀过滤出去,这样才能减少糖的酸味。
氢氧化钙
产品名称氢氧化钙
颜色:白色固体.
产品英文名:
Calcium hydroxide;Hydrated lime;Slaked lime;Lime,hydrated,limewater 产品别名消石灰; 熟石灰
分子式Ca(OH)2
产品用途用于制漂白粉, 硬水软化剂,改良土壤酸性,自来水消毒澄清剂及建筑工业等
陆晴川号1305-62-0
氢氧化钙毒性防护其粉尘或悬浮液滴对粘膜有刺激作用,能引起喷嚏和咳嗽,和碱一样能使脂肪皂化,从皮肤吸收水分、溶解蛋白质、刺激及腐蚀组织。
吸入石灰粉尘可能引起肺炎。
最高容许浓度为5mg/m3。
吸入粉尘时,可吸入水蒸气、可待因及犹奥宁,在胸廓处涂芥末膏;当落入眼内时,可用流水尽快冲洗,再用5%氯化铵溶液或0.01%CaNa2-EDTA溶液冲洗,然后将0.5%地卡因溶液滴入。
工作时应注意保护呼吸器官,穿戴用防尘纤维制的工作服、手套、密闭防尘眼镜,并涂含油脂的软膏,以防止粉尘吸入。
包装储运用内衬聚乙烯塑料薄膜袋的塑料编织袋包装,每袋净重25kg。
应贮存在干燥的库房中。
严防潮湿。
避免和酸类物质共贮混运。
运输时要防雨淋。
失火时,可用水,砂土或一般灭火器扑救。
物化性质细腻的白色粉末。
相对密度2.24。
加热至580℃脱水
成氧化钙,在空气中吸收二氧化碳而成碳酸钙。
溶于酸、铵盐、甘油,微溶于水,不溶于醇,有强碱性,对皮肤、织物有腐蚀作用。
水中溶解度
熟石灰溶解度曲线0℃0.18g
10℃0.17g
20℃0.16g
30℃0.15g
40℃0.14g
50℃0.13g
60℃0.12g
70℃0.105g
80℃0.095g
90℃0.08g
100℃0.07g
主要化学方程式有:
氢氧化钙溶液和饱和碳酸钠溶液反应能够生成氢氧化钠:
Ca(OH)2 + Na2CO3=2NaOH+CaCO3↓,这个反应可以用来制取小量烧碱。
氢氧化钙和二氧化碳的反应
Ca(OH)2+CO2=CaCO3↓+H2O(这是石灰浆涂到墙上后氢氧化钙和氧气发生的反应,墙会“冒汗”就是因为生成了水H2O,墙变得坚固是因为生成了碳酸钙CaCO3,在乡下有时为了使墙更快变
硬,就在刚刷好的屋里烧炭生成二氧化碳CO2(C+O2=(点燃)CO2)。
这个反应也是检验CO2的方程式,气体通入石灰水变混浊的是CO2)。
不同量的氢氧化钙和碳酸氢钠的反应
2NaHCO3+Ca(OH)2(少量)=CaCO3↓+2H2O+Na2CO3
NaHCO3+Ca(OH)2(过量)=CaCO3↓+H2O+NaOH
工业上煅烧石灰石CaCO3==(高温)CaO+CO2↑(此反应也是工业上制取大量CO2的方法,一式二用)
工地上经常冒白烟是在制石灰浆Ca(OH)2:CaO+H2O=Ca(OH)2(因为熟石灰的溶解度随温度升高而降低,所以工人更愿意在夏天制石灰浆,这样温度高时溶进水的熟石灰少,可制得更多石灰浆,此反应放出大量热量)
石灰浆被抹在墙上,和CO2反应后变硬Ca(OH)2+CO2=CaCO3↓+H2O
氟化氢氨和氢氧化钙的化学方程式:NH4HF2 + Ca(OH)2 = CaF2 + 2H2O +NH3
氯化镁和氢氧化钙反映的化学方程式:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2
硝酸氨和氢氧化钙反应的化学方程式:
2NH4NO3+Ca(OH)2=NH3↑+H2O+Ca(NO3)2
(NH4)2SO4+Ca(OH)2=NH3↑+H2O+CaSO4
CaCO3+SiO2=CaSiO3+CO2 条件是高温
氢氧化钙具有碱的通性。
它的碱性或腐蚀性都比氢氧化钠弱,可
以说是一种中强性碱,这些性质决定了氢氧化钙有广泛的使用。
农业上用它降低土壤酸性,改良土壤结构,很明显在这种场合用氢氧化钠是不可能的。
农药波尔多液是用石灰乳和硫酸铜水溶液按一定比例配制的。
因1885年首先用于法国波尔多城而得名。
这种用于果树和蔬菜的天蓝色粘稠的悬浊液农药,是通过其中的铜元素来消灭病虫害的。
其中不仅利用了氢氧化钙能和硫酸铜反应的性质,也利用了氢氧化钙微溶于水的特点使药液成粘稠性,有利于药液在植物枝叶上附着。
另外氢氧化钙和空气中的二氧化碳反应生成难溶于水的碳酸钙,也有利于药液附着于植物表面一段时间不被雨水冲掉。
氢氧化钙和二氧化碳的反应不论在化学实验室还是在工农业生产中,或者在自然界都经常发生。
经常被利用着。
石灰沙浆砌砖抹墙的事实熟为人知。
鲜为人知的是制糖工业中也发生这个反应:在制糖过程中要用氢氧化钙来中和糖浆里的酸,然后再通入二氧化碳使剩余的氢氧化钙变成沉淀过滤出去,这样才能减少糖的酸味。
氢氧化钙溶液和饱和碳酸钠溶液反应能够生成氢氧化钠:
Ca(OH)2 + Na2CO3=2NaOH+CaCO3↓,这个反应可以用来制取小量烧碱。
Ca(OH)2+CO2=CaCO3↓+H2O ,这个反应可用来鉴定氢氧化钙溶液。
如果在氢氧化钙溶液中继续通入二氧化碳,会发下溶液先浑浊后澄清,这是因为二氧化碳会和碳酸钙[Ca(CO3)]继续反应
CaCO3+CO2+H2O=Ca(HCO3)2, 而碳酸氢钙[Ca(HCO3)2]是易
溶的,所以溶液会再次澄清。
加热溶液又变浑浊,因为碳酸氢钙受热分解
Ca(HCO3)2==CaCO3↓+CO2↑+H2O
氢氧化钙不能盛放在带玻璃塞的试剂瓶中,因为虽然二氧化硅化学性质稳定,但是会和强碱反应,如NaOH,KOH,RbOH,Ba(OH)2,Ca(OH)2。
如果把氢氧化钙
放在带玻璃塞的试剂瓶中,会发生如下反应:
Ca(OH)2+SiO2===CaSiO3↓+H2O
而硅酸钙会沉淀在瓶塞上,导致瓶子打不开,所以不能成在带玻璃塞的试剂瓶中。
制取氢氧化钙:H2O+CaO=Ca(OH)2(这里切记!没有沉淀符号的) 初中需掌握的并不多:
Ca(OH)2+CO2=CaCO3↓+H2O
Ca(OH)2 + Na2CO3=2NaOH+CaCO3↓即可。