关于新药申报中中检所没有的对照品如何处理
- 格式:docx
- 大小:15.49 KB
- 文档页数:3


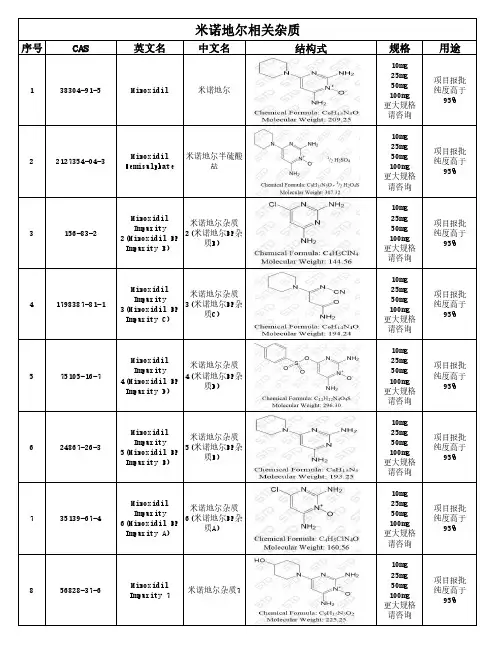
米诺地尔相关杂质序号CAS英文名中文名结构式规格用途138304-91-5Minoxidil 米诺地尔10mg 25mg 50mg 100mg 更大规格请咨询项目报批纯度高于95%22127354-04-3Minoxidil Hemisulphate 米诺地尔半硫酸盐10mg 25mg 50mg 100mg 更大规格请咨询项目报批纯度高于95%3156-83-2MinoxidilImpurity2(Minoxidil EPImpurity B)米诺地尔杂质2(米诺地尔EP杂质B)10mg 25mg 50mg 100mg 更大规格请咨询项目报批纯度高于95%41798387-81-1MinoxidilImpurity3(Minoxidil EPImpurity C)米诺地尔杂质3(米诺地尔EP杂质C)10mg 25mg 50mg 100mg 更大规格请咨询项目报批纯度高于95%575105-16-7MinoxidilImpurity4(Minoxidil EPImpurity D)米诺地尔杂质4(米诺地尔EP杂质D)10mg 25mg 50mg 100mg 更大规格请咨询项目报批纯度高于95%624867-26-3MinoxidilImpurity5(Minoxidil EPImpurity E)米诺地尔杂质5(米诺地尔EP杂质E)10mg 25mg 50mg 100mg 更大规格请咨询项目报批纯度高于95%735139-67-4MinoxidilImpurity6(Minoxidil EPImpurity A)米诺地尔杂质6(米诺地尔EP杂质A)10mg 25mg 50mg 100mg 更大规格请咨询项目报批纯度高于95%Minoxidil 10mg 25mg 50mg 项目报批更大规格请咨询1079459-04-4MinoxidilImpurity 9米诺地尔杂质910mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 11/MinoxidilImpurity 10米诺地尔杂质1010mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 12128304-91-6MinoxidilImpurity 11米诺地尔杂质1110mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 13128304-92-7MinoxidilImpurity 12米诺地尔杂质1210mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 143270-97-1MinoxidilImpurity 13米诺地尔杂质1310mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 1556828-40-1MinoxidilImpurity 14米诺地尔杂质1410mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 16/MinoxidilImpurity 15米诺地尔杂质1510mg25mg50mg100mg更大规格请咨询项目报批纯度高于95%更大规格请咨询18/Minoxidil Impurity 17米诺地尔杂质1710mg 25mg 50mg 100mg 更大规格请咨询项目报批纯度高于95%191020718-66-4Minoxidil-d10米诺地尔-d1010mg 25mg 50mg 100mg 更大规格请咨询项目报批纯度高于95%201818638Minoxidil-d 米诺地尔-d10mg 25mg 50mg 100mg 更大规格请咨询项目报批纯度高于95%216804Minoxidil Impurity 18米诺地尔杂质1810mg 25mg 50mg 100mg 更大规格请咨询项目报批纯度高于95%22/Minoxidil Impurity 19米诺地尔杂质1910mg 25mg 50mg 100mg 更大规格请咨询项目报批纯度高于95%23/Minoxidil Impurity 20米诺地尔杂质2010mg 25mg 50mg 100mg 更大规格请咨询项目报批纯度高于95%24/Minoxidil Impurity 21米诺地尔杂质2110mg 25mg 50mg 100mg 更大规格请咨询项目报批纯度高于95%更大规格请咨询26/MinoxidilImpurity 23米诺地尔杂质2310mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 27/MinoxidilImpurity 24米诺地尔杂质2410mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 28959054-23-0MinoxidilImpurity 25米诺地尔杂质2510mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 29131230-62-1MinoxidilImpurity 26米诺地尔杂质2610mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 30/MinoxidilImpurity 27米诺地尔杂质2710mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 31/MinoxidilImpurity 28米诺地尔杂质2810mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 32/MinoxidilImpurity 29米诺地尔杂质2910mg25mg50mg100mg更大规格请咨询项目报批纯度高于95%更大规格请咨询34/MinoxidilImpurity 31米诺地尔杂质3110mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 35/MinoxidilImpurity 32米诺地尔杂质3210mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 36/MinoxidilImpurity 33米诺地尔杂质3310mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 37116436-03-4MinoxidilImpurity 34米诺地尔杂质3410mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 38156-81-0MinoxidilImpurity 35米诺地尔杂质3510mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 3977940-94-4MinoxidilImpurity 36米诺地尔杂质3610mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 407148-63-2MinoxidilImpurity 37米诺地尔杂质3710mg25mg50mg100mg更大规格请咨询项目报批纯度高于95%更大规格请咨询42/MinoxidilImpurity 39米诺地尔杂质3910mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 43/MinoxidilImpurity 40米诺地尔杂质4010mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 442889432-05-5MinoxidilImpurity 41米诺地尔杂质4110mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 4534960-71-9MinoxidilImpurity 42米诺地尔杂质4210mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 46/MinoxidilImpurity 43米诺地尔杂质4310mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 47114562-80-0MinoxidilImpurity 44米诺地尔杂质4410mg25mg50mg100mg更大规格请咨询项目报批纯度高于95% 48/MinoxidilImpurity 45米诺地尔杂质4510mg25mg50mg100mg更大规格请咨询项目报批纯度高于95%更大规格请咨询5035139-68-5MinoxidilImpurity 47米诺地尔杂质4710mg25mg50mg100mg更大规格请咨询项目报批纯度高于95%51/MinoxidilImpurity 48米诺地尔杂质4810mg25mg50mg100mg更大规格请咨询项目报批纯度高于95%湖北扬信医药科技有限公司(现货)供应各种杂质对照品:泊沙康唑杂质、替卡格雷杂质、依折麦布杂质、索拉菲尼相关杂质、索非布韦杂质、氨氯地平杂质、马来酸氯苯那敏杂质、头孢克肟杂质、瑞舒伐他汀杂质、瑞格列奈杂质、恩替卡韦杂质,替诺福韦杂质等;代理中检所/EP/BP/USP/LGC/TRC/DR/TLC/MC/SIGMA/BACHEM/STD等品牌用途:项目报批 纯度高于95% 并提供COA、NMR、HPLC、MS等图谱。
沙美特罗|杂质合集汇总沙美特罗为新型选择性长效β2受体激动剂,一次剂量其支气管扩张作用可持续12小时。尚有强大的抑制肺肥大细胞释放过敏反应介质作用,可抑制吸入抗原诱发的早期和迟发相反应,降低气道高反应性。用于哮喘(包括夜间哮喘和运动性哮喘)、喘息性支气管炎和可逆性气道阻塞。
现货供应 为了帮助科研人员和药企能够更好地控制沙美特罗的质量,扬信医药为大家提供以下高品质的沙美特罗杂质:
“怕发补?找扬信;怕发补?就用STD杂质标准品!”——STD目前可提供约百万种有机化学标准物质产品。产品可提供全系结构确证分析和质量检测证明图谱资料。图表中为部分示例产品,了解更多产品信息,请咨询相关业务人员——
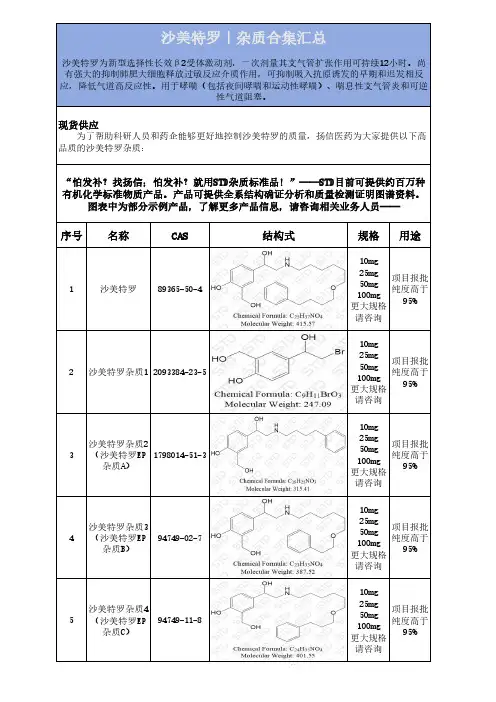
序号名称CAS结构式规格用途
1沙美特罗89365-50-410mg25mg50mg100mg更大规格请咨询
项目报批纯度高于95%
2沙美特罗杂质12093384-23-510mg25mg50mg100mg更大规格请咨询
项目报批纯度高于95%
3沙美特罗杂质2(沙美特罗EP杂质A)1798014-51-310mg25mg50mg100mg更大规格请咨询
项目报批纯度高于95%
4沙美特罗杂质3(沙美特罗EP杂质B)94749-02-710mg25mg50mg100mg更大规格请咨询
项目报批纯度高于95%
5沙美特罗杂质4(沙美特罗EP杂质C)94749-11-810mg25mg50mg100mg更大规格请咨询
项目报批纯度高于95%6沙美特罗杂质5(沙美特罗EP杂质D)1391052-04-210mg25mg50mg100mg更大规格请咨询
项目报批纯度高于95%
7沙美特罗杂质6(沙美特罗EP杂质E)108928-81-010mg25mg50mg100mg更大规格请咨询
项目报批纯度高于95%
8沙美特罗杂质7(沙美特罗EP杂质F)1391054-40-210mg25mg50mg100mg更大规格请咨询
项目报批纯度高于95%
9沙美特罗杂质8 (沙美特罗EP杂质G)2470130-36-810mg25mg50mg100mg更大规格请咨询

1目的1.1为了让公司科研及研发项目顺利开展, 激发工作人员积极性, 使项目保质保量完成, 尽快实现成果转化以及效益的转化,特制定本项目考核及项目奖金管理制度。
2本制度旨在鼓励员工充分发挥创造力和工作积极性, 高质高效地完成公司分配的项目任务。
3适用范围及管理3.1本制度适用于X制药集团研发项目考核及项目奖金发放管理。
3.2本制度包括了自主研发项目、外部引进项目等, 其他项目参照本制度设定。
3.3所有项目奖金依据相应项目计划中考核节点申请、发放。
第一章本制度未涵盖之项目管理, 报请集团总经理办公会, 一报一批。
第二章总则第一条奖励方式包括: 项目开发奖金、加薪、职级晋升、带薪休假、培训机会以及其他方式等。
第二条奖励范围1.开发新产品, 满足奖励条件的;2.通过研发, 寻找到质优价廉的新材料、新配方或新工艺的;3、能积极收集信息, 提出产品开发项目的;4.成功申请中药品种保护的;5、新增检验项目, 有利于提高产品质量, 且被采纳的;第三条6.其他奖励参照集团公司相关规定。
第四条处罚方式包括: 罚款、降薪、调离岗位、辞退等。
第五条处罚范围1.非不可抗拒的未按时完成预定计划任务的;2.泄露公司科研秘密、技术资料的, 情节严重者追究法律责任;3、未经公司同意以公司或研究院名义从事其他活动的, 情节严重者追究法律责任;4.因本身工作质量问题导致申报失败的;第三章 5.其他处罚参照集团公司相关规定。
第四章新药研发阶段奖励第六条奖金分配阶段及分配比例原则由于新药研究周期长, 故采用分段奖励的办法, 具体分为以下阶段:1.完成临床前研究, 上报至国家CFDA, 取到受理号并通过现场检查并取得药检所合格报告, 发放奖金总额的40%。
1.1.小试阶段, 小试工艺及质量标准研究符合要求, 发放奖金总额的10%;1.2.中试阶段, 中试工艺及质量标准研究符合要求, 发放奖金总额的10%;1.3.药理毒理阶段, 完成实验, 取得报告, 发放奖金总额的10%;1.4、申报阶段, 申报资料通过省局初审并受理, 通过省局组织的现场检查, 现场生产出合格样品或取得省所的合格报告, 发放奖金总额的10%。

药分⽅向质量标准的题库1.药品质量标准:是国家对药品质量及检验⽅法所作的技术规定,是药品⽣产、经营、使⽤、检验和监督管理部门共同遵循的法定依据。
法律约束⼒的技术法规2.标准的分类A 正式法定标准(1)国家药品标准《中华⼈民共和国药典》(CP)10版《中华⼈民共和国卫⽣部药品标准》(部颁标)《国家药品监督管理局标准》(局颁标准):要求:①具有国内的先进⽔平②真正具有可控性中国药典委员会制定。
药品监督局颁布执⾏。
地⽅标准:省市⾃治区药品标准。
(2)临床研究⽤质量标准新药-控制临床⽤药质量-均衡性、安全-修定(3)新药试⾏标准3.药品质量标准的特性权威性:仲裁科学性:实验次数、数据资料、⽅法、限度进展性:显微理化TLC4.药品质量标准的主要内容名称(中⽂名)、汉语拼⾳、处⽅、制法、性状、鉴别、检查、浸出物测定、含量测定、功能与主治、⽤法与⽤量、禁忌、注意、规格、贮藏、有效期限等项⽬处⽅药味的排列:君;左-右;上-下保密处⽅: 华佗再造丸、⾎脂宁丸、云南⽩药-绝密。
⽤法定计量单位:重量以“g”,容量以“ml”表⽰;处⽅量根据剂型不同,如⽚剂、胶囊折算成出1 000⽚或者1 000粒的药量,液体制剂如⼝服液、酒剂、酊剂、糖浆剂等,以1 000ml药量写出。
处⽅投料药材的重量:净药材;炮制;制剂处⽅中规定的药量,系指净药材或炮制品粉碎后的份量。
低限投料辅料及附加剂:制剂中使⽤的辅料及附加剂⼀般不列⼊质量标准的处⽅中,将其在制法中加以说明。
5.确定制定质量标准的类别阶段性:质量标准的分类新药质量标准临床前研究⽤质量标准临床研究⽤质量标准暂⾏或试⾏的药品质量标准正式的药品质量标准再修订:⼯艺不变国家药品标准:《中华⼈民共和国药典》、局颁药品标准企业标准:6制定质量标准的前提药物组成固定:临床经验⽅、经典名⽅、医院制剂、科研⽅、仿制药----药味及分量原料稳定:原料、辅料标准制备⼯艺稳定:新药-剂型-中试7制定质量标准的规范化过程确定质量研究的内容进⾏⽅法学研究确定质量标准的项⽬及限度制订及修订质量标准8质量标准设计原则(⼀)同步进⾏原则(⼆)样品要有代表性(三)对照试验原则(四)重复性原则⼀)同步进⾏原则1、制剂⽤原料研究与质量控制同步:药材、提取物、有效部位(组分)或有效成分、辅料黄精:显微-增加TLC川芎:增加川芎嗪测定2、制备⼯艺研究与质量控制同步去粗取精-提取纯化-有效成分检查、鉴别、含量测定、卫⽣学⼆)样品要有代表性1、原料要有代表性包括药材原料、制剂⽤中试样品-3批2、质量标准所制定的指标应有代表性应与功能主治相符3、质量标准具有可控性4、质量标准所采⽤的对照物要有可靠性对照品和对照药材(三)对照试验原则1、设⽴对照鉴别、含量测定空⽩、阴性、阳性对照2、对照的等量性取样量、制备相等条件-供试品与阴性供试品、阳性对照应为量化对照四)重复性原则1、研究过程中质量控制内容需要有良好的重复性:不同⼈-不同仪器2、⽣产过程中质量控制内容需要有良好的重复性:各个批次3、流通过程中质量控制内容需要有良好的重复性:不同⽓候条件、地理位置、贮藏情况-膏剂质量标准研究程序(⼀)查阅资料:技术要求、药典、论⽂项⽬:成分⽅法:(⼆)制定质量标准的⽅案《新药审批⽅法》→⽅案的设计;项⽬8~14《中国药典》→标准的内容(三) 实验研究※积累原始数据(四) 起草说明和制定标准草案⽅法:准确、灵敏、简便、快速限度:保证药效、临床杂质来源中药材原料中带⼊⽣产制备过程中引⼊贮存过程中引起的中药制剂⾃⾝理化性质的改变杂质的分类⼀般杂质(如酸、碱、⽔分、氯化物、硫酸盐、铁盐、重⾦属、砷盐)特殊杂质:⼤黄流浸膏原始记录起草说明制定标准草案质量标准研究的申报资料药品原料(药材)的质量标准药品成品的质量标准草案质量标准起草说明三批样品⽅法验证的定义与⼀般原则定义:根据检测项⽬的要求,预先设置⼀定的验证内容,并通过设计合理的试验来验证所采⽤的分析⽅法能否符合检测项⽬的要求原则:每个检测项⽬采⽤的分析⽅法,均需要进⾏⽅法验证只有经过验证的分析⽅法才能⽤于控制药品质量⽅法验证涉及到的三个主要⽅⾯⼀)需要验证的检测项⽬鉴别:专属性杂质检查:限度试验-专属性和检测限;定量试验-专属性、准确度和定量限葡萄糖输液:5-羟甲基糠醛对⼈体横纹肌和内脏有损害;普罗布考:微量杂质会导致严重的眼毒性,其杂质A、B、C限量分别为5×10-6、5×10-5和0.5%定量测定(含量测定、溶出度、释放度等):专属性、准确度和线性其他特定检测项⽬:粒径分布、旋光度、分⼦量分布等防腐剂苯酚的检测⾻肽注射液/动物四肢⾻/静脉滴注/2 mL-10~20 mL。

医药CRO化学药品各号申报资料的一般要求申报资料的一般要求为便于梳理与理解,在同一号资料中分为以下三种情形:A:新药报临B:新药报生产C:仿制药1号资料:A:包括通用名、商品名、化学名、英文名、汉语拼音,并注明其化学结构式、分子量、分子式等(见药审中心要求)。
如果是新剂型新命名、应附上药典委员会命名的复函B:同AC:同A外,需提供:国家标准(注:不允许申请商品名)2号资料:A:1、药品生产企业:“三证”(GMP与生产许可证的单位名称和生产地址一致)新药证书申请人:有效的营业执照、事业单位法人证书及其变更登记证明2、专利查询报告、不侵权保证书3、特殊药品:SFDA安监司的立项批件4、制剂用原料药的合法来源(一套)①直接向原料生产厂家购买:a、原料厂三证(三证与原料的批准证明文件的单位名称、地址必须一致)1、生产企业:营业执照、税务登记证、组织机构代码证、生产许可证(QS 证)(还需要产品第三方检测报告、出厂检测报告,产品执行标准等) 。
2、贸易型企业:营业执照、流通许可证(同时也需要提供所销售产品生产厂家的营业执照、生产许可证等)b、原料的批准证明文件(《药品注册批件》、《药品注册证》、统一换发文号的文件等)c、原料的质量标准及原料药出厂检验报告d、购货发票(赠送的,提供相关证明(赠送证明))e、购销合同或供货协议复印件f、自检报告书(全检)②向原料经销单位购买的:除需提供上述文件外,还需提供经销商与原料厂的供货协议新增:申报生产时,原料药如系通过赠送途径获得而未能提供该原料药合法来源证明和供货协议的,不批准③原料与制剂同时注册申请:原料和制剂厂不一致的,应提供原料和制剂厂之间的供货协议或合作开发协议(申报相同剂型的原料药来源不能是相同的原料药申请人)×A厂胶囊原料甲×B厂胶囊只能一对一,因此时的原料甲还未批准上市④使用进口原料的:略5、商标查询单或商标注册证(可推迟至报生产时提供)6、直接接触药品的包装材料和容器的包材证或受理通知单(2005版药典已将胶囊归为包材)7、委托试验:应提供委托合同,并附该机构合法登记证明、必要的资质证明。

附件三:生物制品注册分类及申报资料项目要求第一部分治疗用生物制品二、申报资料(一)申报资料第一部分:综述资料1.新制品名称(包括通用名、英文名、汉语拼音,说明命名依据),选题的目的和依据,国内外有关方面研究现状(包括专利情况)、生产和使用情况综述,附主要参考文献。
2.研制单位研究工作的综述。
第二部分:药学资料3.生产用原材料研究资料。
3.1生产用动物、生物组织或细胞、原料血浆的来源、收集及质量控制等研究资料。
3.2生产用细胞的来源、构建(或筛选)过程及检定等研究资料。
3.3主种子库和生产种子库的建立、检定、保存及传代稳定性资料。
4.原液或原料药生产工艺的研究资料,附生产用各种仪器、培养基质、试剂等的来源及标准。
5.制剂处方及工艺的研究资料,辅料的来源和质量标准,及有关文献资料。
6.中试产品质量研究工作的试验资料及文献资料。
包括理化性质分析、鉴别、纯度检查、有毒杂质检测、含量测定及生物活性测定等,还包括工作参考品或对照品的制备及检定资料。
7.供临床研究用连续三批中试产品的制造和检定原始记录,附中检所复检报告及对检定规程的审核意见。
8.中试产品制造和检定规程草案及起草说明。
9.初步稳定性研究资料。
10.产品内包装材料及其选择依据。
第三部分:临床前研究资料11.主要药效学研究资料及文献资料。
12.安全药理学研究资料及文献资料。
13.单次给药毒性研究资料及文献资料。
14.重复给药毒性研究资料及文献资料。
15.药代动力学研究资料及文献资料。
16.遗传毒性研究资料及文献资料。
17.生殖毒性研究资料及文献资料。
18.致癌研究资料及文献资料。
19.免疫毒性和/或免疫原性研究资料及文献资料。
20.局部耐受性研究资料及文献资料。
21.复方制剂中多种组分的动物药效、毒性、药代动力学相互影响的研究资料及文献资料。
22.药物依赖性研究资料及文献资料。
第四部分:临床资料23.供临床医师参阅的药理、毒理研究及文献的综述。
24.临床研究计划及研究方案。

美国DMF1.介绍1) 名称:Drug Master File(药物主控档案)2)DMF的意义:美国的原料药管理同中国不同,不进行文号管理。
原料药厂家只需提供DMF(drug master file --生产及控制方面的资料)给FDA备案,当药品生产商采用该原料药生产制剂产品时再进行审查。
美国的DMF文件库是全世界制剂厂家广泛参照的一个供应商资源库,所以几乎所有想让产品推向国际的原料药厂都进行DMF备案。
原料药若以合法的身份进入美国市场,必须获得FDA认可。
一般首先取得DMF登记号,这样,在制剂生产商向FDA提交注册申请资料时,原料药部分的资料可直接引用该原料药的DMF文件登记号,并且在现场检查时进行检查。
在FDA批准制剂申请之前,原料药生产企业必须通过FDA官员的现场检查。
现场检查的目的是确认原料药生产现场是否符合ICH Q7 GMP(同时也必须符合FDA技术上的一些特殊要求);确认原料药生产现场是否与提交的DMF文件内容一致。
3)法规依据:FDA并不强制要求企业递交DMF文件。
相应内容也可以在制剂申请时进行提交。
2.程序1)按要求编写DMF文件。
2)递交DMF文件。
3)获得备案号。
3.原料药DMF的有关问题Q1 DMF文件的作用?A1提供的资料可用于支持新药申请(NDA)、简略新药申请(ANDA)等。
新药申请,适用于在美国首次上市的药品;简略新药申请,适用于仿制药的申请。
仿制药的简略新药申请大体与新药申请一样,但不必提供药理、毒理、临床等资料,重点是保证生物等效性。
Q2 DMF提交获得备案号如何维护?A2 DMF不是编好了一个版本,获得备案号后就一劳永逸了,它需要按客户的要求以及工艺和设施变更的情况不断地修改补充完善,重大的变更必须通知客户。
美国FDA要求,即使没有变更,每年也需要递交一份没有变更的声明。
4.我们提供的服务指导厂家准备DMF文件所要求的中文资料;翻译制作DMF英文文件;DMF文件的提交和与FDA的技术联络,回答FDA的有关问题;指导厂家准备生产现场,包括硬件和软件;提供现场检查迎检培训提供现场翻译对厂家进行ICH Q7 以及cGMP特定要求的专项培训。
关于新药申报中中检所没有的对照品如何处理
中国药品生物制品检定所仅提供中国药典、国家食品药品管理局国家药品标准中所需使用的对照品和标准品。
药典和国家药品标准中未涉及到的品种,因新药研发或其它原因需使用对照品或标准品时,可检索各大试剂公司是否有国外对照品或标准品可以购买。
也可自行研制或请有资质的实验室代为标定。
1.所用对照品(标准品)中检所已经发放提供(可参阅中国药典2000年版二部附录ⅩⅤG),且使用方法相同时,应使用中检所提供的现行批号对照品(标准品),并提供其标签和使用说明书,说明其批号,不应使用其他来源者;如使用方法与说明书使用方法不同(如定性对照品用作定量用、效价测定用标准品用作理化测定法定量、UV法或容量法对照品用作色谱法定量等),应采用适当方法重新标定,并提供标定方法和数据;若色谱法含量测定用对照品用作UV法或容量法,定量用对照品用作定性等,则可直接应用,不必重新标定。
2.申报临床研究时,如中检所尚无供应,为不影响注册进度,可先期与中检所接洽制备和标定,申报时提供标定报告、标签(应标明效价或含量、批号、使用效期)和使用说明书;也可与省所合作标定,申报时提供标准品或对照品研究资料,“说明其来源、理化常数、纯度、含量及其测定方法和数据”;标定有困难时,可使用国外药品管理当局或药典委员会发放的对照品(标准品)或国外制药企业的工作对照品(标准品),进行标准制订和其他基础性研究,但应提供其标签(应标明其含量)和使用说明书,能保证其量值溯源性;也可使用国外试剂公司(如sigma公司等)提供的对照品(标准品),但应提供试剂公司该批对照品(标准品)的检测报告(用作含量测定时,应有确定的含量数据),如为高纯度试剂,提供了国外试剂公司检测报告(用作含量测定时,应有确定的含量数据)时,也可使用,并应能保证其量值溯源性,但申请人应及时与中检所接洽对照品(标准品)的标定事宜,临床研究期间完成此工作。
3.直接申报生产品种,如中检所尚无供应,可参照2中要求进行,并提供相应研究资料,但申请人在标准试行期间应与中检所接洽并完成的标定事宜。
4.对照品(标准品)标定的技术要求:
4.1.创新药物
应说明对照品(标准品)原料的制备路线、精制方法、质检报告,提供理化常数和纯度的测定数据及分析结果(包括相关图谱),提供标定方法的研究和验证资料(如与原料药质量研究项下相同,可不再提供)、含量测定数据及经统计分析得到的对照品(标准品)含量结果,并说明进行临床前药学研究、药理毒理学研究所用样品的含量是否用该批对照品(标准品)确定或可用该批对照品(标准品)进行量值溯源。
●纯度测定方法应选用色谱法,并采用两种以上不同分离机理或不同色谱条件并经验证的色谱方法相互验证比较,同时采用二极管阵列检测器或其它适宜方法检测HPLC 法的色谱峰纯度,而后根据测定结果经统计分析确定对照品(标准品)原料的纯度。
●对于组份单一、纯度较高的药物,对照品(标准品)标定方法宜首选可进行等当量换算、精密度高、操作简便快速的容量法。
可根据药物分子中所具有的官能团及其化学性质,选用不同的容量分析方法,但应符合如下条件:(1)反应按一个方向进行完全;(2)反应迅速,必要时可通过加热或加入催化剂等方法提高反应速度;(3)共存物不得干扰主药反应,或能用适当方法消除;(4)确定等当点的方法要简单、灵敏;(5)标化滴定液所用基准物质易得,并符合纯度高、组成恒定且与化学式符合、性质稳定(标定时不发生副反应)等要求。
标定方法的选择要关注如下事项:(1)供试品的取用量应满足滴定精度的要求(消耗滴定液约20ml);(2)滴定终点的判断要明确,提供滴定曲线。
如选用指示剂法,应考虑其变色敏锐,并用电位法校准其终点颜色。
(3)为排除因加入其它试剂而混入杂质对测定结果的影响,或便于剩余滴定法的计算,可采用“将滴定的结果用空白试验校正”的办法;(4)要给出滴定度(采用四位有效数字)的推导过程。
标定结果要根据3个以上实验室各不少于15组测定结果经统计分析,去除离群值和可疑值后的结果,并报告可信限。
●如该药物没有可进行等当量换算并符合要求的容量法时,可采用反复纯化的原料,色谱法确定纯度后扣除有关物质、炽灼残渣、水分和挥发溶剂等后的理论含量确定为标准品含量,以此为基准进行对照品(标准品)的换代和量值传递。
●用于抗生素微生物检定法的第一代基准标准品可参照上述方法标定,如为多组份抗生素,其组份比例应与拟上市产品组份比例一致或接近,或以其中某一组份纯品为基
准标准品,但要注意标准品换代时量值传递的恒定。
●仅用于鉴别定性的化学对照品,注重其结构确证的研究资料,纯度和含量的要求一般可适当降低。
●杂质对照品,用作限度要求时,应提供其来源(合成路线)、结构确证的研究资料,应具备较高的纯度和含量,并提供纯度和含量的的测定结果,提供质量控制标准。
4.2其他类别药物,可参照4.1要求进行
●用于抗生素微生物检定法的标准品须用上市国的国家标准品或原发厂的工作标准品为基准标准品进行标定。
标定时采用的原料药应符合相应要求,并提供原料的制备路线、精制方法、质检报告,提供理化常数和纯度的测定数据及分析结果(包括相关图谱)。
标定须用现行版中国药典附录收载的“抗生素微生物检定法”-三剂量法,并提供详细的方法学研究,包括检定菌和培养基的选择、剂量和剂距选择、缓冲液选择(如与质量研究项下相同,可不再提供)。
每次标定结果均应照“生物检定统计法-量反应平行线测定法(3.3)”法进行可靠性测验及效价计算。
按照《药品注册管理办法》,上市药品质量标准所用标准物质均须由中检所负责标定和管理,药品研发过程中,研制单位应注意及时与中检所联系标定事宜,以保证研发工作的连续性。