高三化学氧化还原反应2
- 格式:pdf
- 大小:1.95 MB
- 文档页数:13

氧化还原反应的本质和特征•氧化还原反应的本质:电子的转移(得失或偏移)氧化还原反应的特征:化合价升降(某些元素化合价在反应前后发生变化,是氧化还原反应判别的依据)•氧化还原反应的发展史:1.物质与氧气发生的反应属于氧化反应,含氧化合物中氧被夺去的反应属于还原反应。
2.有化合价升降的反应属于氧化还原反应。
3.有电子得失或偏移的反应属于氧化还原反应。
对物质的认识存在发展的过程,从最初的隔离开的氧化反应、还原反应,到从表面上看化合价变化的氧化还原反应,把氧化与还原统一在一个概念下,再透过现象看本质,化合价的变化是有电子得失或偏移引起的。
•氧化还原反应中应注意的几个问题:1、氧化剂氧化性的强弱,不是看得电子的多少,而是看得电子的难易;还原剂还原性的强弱,不是看失电子的多少,而是看失电子的难易。
eg:氧化性:浓HNO3>稀HNO3还原性:Na>Al2、有新单质参加或生成的反应不一定是氧化还原反应eg:C(金刚石)==C(石墨);3O2==2O3(放电);P4(白磷)==4P(红磷)3、任何元素在化学反应中,从游离态变为化合态,或由化合态变为游离态,均发生氧化还原反应(比如置换反应,化合反应,分解反应)4、置换反应一定是氧化还原反应,复分解反应一定不是氧化还原反应;有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
5、元素具有最高价的化合物不一定具有强氧化性!eg.H3PO4、H2SiO3(或H4SiO4)两酸均无强氧化性但硝酸有强氧化性。
•配平简介:化学反应方程式严格遵守质量守恒定律,书写化学反应方程式写出反应物和生成物后,往往左右两边各原子数目不相等,不满足质量守恒定律,这就需要通过配平来解决。
•配平原则:(1)电子守恒原则:反应中还原剂失去电子的总数与氧化剂得到电子的总数相等(2)电荷守恒原则:若为离子反应,反应前后离子所带正负电荷总数相等(3)质量守恒原则:反应前后各元素的原子个数相等配平步骤:(1)一标:标明反应前后化合价有变化的元素的化合价(2)二等:通过求最小公倍数使化合价升降总值相等(3)三定:确定氧化剂与还原剂的化学计量数氧化剂(还原剂)化学计量数=降(升)价的最小公倍数÷1mol氧化剂(还原剂)降(升)价总数(4)四平:用观察法配平其他物质的化学计量数(5)五查:检查质量与电荷、电子是否分别守恒配平技巧:(1)逆向配平法:部分氧化还原反应、自身氧化还原反应等可用逆向配平法,即选择氧化产物、还原产物为基准物来配平(一般从反应物很难配平时,可选用逆向配平法)例:通过表明氧化产物、还原产物化合价的升降,确定CrCl3、Cl2的计量数为2和3,然后再用观察法配平。

第3节氧化还原反应[考试说明] 1.了解氧化还原反应的本质和特征。
2.了解常见的氧化剂和还原剂。
3.理解氧化性、还原性的比较方法。
4.掌握氧化还原反应方程式的配平和相关计算。
[命题规律] 氧化还原反应是中学化学的重点内容,也是高考的必考点。
高考中常以生产、生活实际为载体,以选择题型考查氧化还原反应基本概念和相关规律;结合工艺流程图以填空题型考查新情境下氧化还原反应方程式的书写与配平以及与氧化还原滴定相结合考查氧化还原反应的有关计算等.考点1 氧化还原反应的相关概念及电子转移表示法知识梳理1。
氧化还原反应的本质和特征2.相关概念及其关系例如,反应MnO2+4HCl(浓)错误!MnCl2+Cl2↑+2H2O中,氧化剂是□13MnO2,还原剂是错误!HCl,氧化产物是错误!Cl2。
生成1 mol Cl2时转移电子数目为错误!2N A,被氧化的HCl的物质的量是错误!2 mol,盐酸显示的性质是错误!还原性和错误!酸性。
3.氧化还原反应中电子转移的表示方法(1)双线桥法请标出Cu与稀硝酸反应中电子转移的方向和数目:错误!(2)单线桥法请标出Cu与稀硝酸反应中电子转移的方向和数目:错误!4.氧化还原反应与四种基本反应类型间的关系(1)一定属于氧化还原反应的是错误!置换反应.(2)一定不属于氧化还原反应的是错误!复分解反应。
(3)一般属于氧化还原反应的化合反应的共同点是错误!有单质参加。
(4)一般属于氧化还原反应的分解反应的共同点是错误!有单质生成。
5.常见的氧化剂和还原剂(1)常见的氧化剂物质类型实例还原产物活泼的非金属单质卤素单质X2错误!X-O2O2-、O错误!、OH-、H2O元素处于高价KMnO4(H+)错误!Mn2+续表(2)常见的还原剂某些非金属单质H2、C、S H2O、CO或CO2、SO2变价元素中低价态化合物或离子氧化物CO CO2SO2错误!SO3或SO错误!氢化物NH3N2或错误!NOH2S错误!S或SO2离子SO错误!错误!SO错误!Fe2+错误!Fe3+I-错误!I2(3)具有中间价态的物质既有氧化性,又有还原性具有中间价态的物质氧化产物还原产物Fe2+错误!Fe3+错误!FeSO2-,3错误!SO错误!错误!SH2O2错误!O2错误!H2O其中,Fe2+、SO错误!主要表现错误!还原性,H2O2主要表现错误!氧化性。

高三化学一轮复习—— 氧化还原反应的“三大”基本规律及其应用知识梳理1.氧化还原反应规律(1)价态规律 ①元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性。
如Fe 3+、Cu 2+只有氧化性,S 2-、I -只有还原性,Cl 2、Fe 2+既有氧化性又有还原性。
②价态归中规律不同价态的同种元素间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价―→中间价”。
而不会出现交叉现象。
简记为“两相靠,不相交”。
如在反应KClO 3+6HCl===KCl +3Cl 2↑+3H 2O 中,氧化产物是Cl 2,还原产物是Cl 2,1 mol KClO 3反应时转移电子数是5N A .③歧化反应规律“中间价―→高价+低价”。
具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:Cl 2+2NaOH===NaCl +NaClO +H 2O 。
1 mol Cl 2反应时转移电子数为N A 。
(2)强弱规律①自发进行的氧化还原反应,一般遵循强氧化剂制弱氧化剂,强还原剂制弱还原剂,即“由强制弱”。
在反应中,较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。
如根据反应Cl 2+S 2-===S ↓+2Cl -,可以确定氧化性Cl 2>S ,还原性S 2->Cl -。
②先后规律a .同时含有几种还原剂时――→加入氧化剂将按照还原性由强到弱的顺序依次反应。
如:在FeBr 2溶液中通入少量Cl 2时,因为还原性Fe 2+>Br -,所以Cl 2先与Fe 2+反应。
b .同时含有几种氧化剂时――→加入还原剂将按照氧化性由强到弱的顺序依次反应。
如在含有Fe 3+、Cu 2+、H +的溶液中加入铁粉,因为氧化性Fe 3+>Cu 2+>H +,所以铁粉先与Fe 3+反应。
(3)守恒规律氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。

高三化学氧化还原反应知识精讲一、氧化还原反应1、本质:反应中有电子的得失2、特征:反应前后有元素的化合价变化3、判定:有元素的化合价变化(有单质参加反应,一定属于氧化还原)4、类型:强氧化剂+ 强还原剂(反应容易进行,条件简单)实例:Cl2+ H2S == S ↓ + 2HCl强氧化剂+ 弱还原剂(反应较容易进行,条件较简单)实例:Cl2+ SO2+ 2H2O == H2SO4 + 2HCl弱氧化剂+ 强还原剂(反应较容易进行,条件较简单)实例:SO2+ 2H2S == 3S ↓ + H2O弱氧化剂+ 弱还原剂(反应难于进行,即使反应也需要加热等条件)实例:S + 2Cu 加热Cu2S二、常见氧化剂和还原剂分类强氧化剂:F2、Cl2、O2、Br2KMnO4(H+)、HNO3、浓H2SO4、KClO3、MnO2、NO2、SO3Fe3+、Ag+HClO、Na2O2、H2O2弱氧化剂:I2、S、PSO2活泼金属离子、H+强还原剂:金属单质H2S(其他硫化物)、亚硫酸盐、亚铁盐、I-加热时的H2、CO弱还原剂:F-、Br-气态二氧化硫注:氧化性、还原性的强弱是相对的概念,尽管有一些数据可以对他们的这些性质进行比较,但在实际解决问题的时候,一般我们是看相对强弱。
比如:复分解反应中的“强酸制弱酸”,并不是说只有“强酸”才能制备“弱酸”,是“相对强酸”制备“相对弱酸”。
CO2+ NaClO + H2O == NaHCO3+ HClO,反应中,碳酸不是强酸,但是碳酸的酸性比次氯酸强,反应同样可以进行。
例1.(00-全国)久置于空气中的下列物质,因被氧化而呈黄色的是:A.浓硝酸B.氯化亚铁溶液C.溴苯D.溴化银[解析]浓硝酸是因为本身分解生成二氧化氮溶于水中而显黄色。
氯化亚铁溶液是因为被氧化生成氯化铁而显黄色。
溴苯是因为溶解了过量溴单质而显黄色。
溴化银本身是浅黄色固体。
[说明]在空气中变质,主要考虑空气中的氧气、二氧化碳、水的存在,所以还原性物质、碱性物质和能与水反应的物质会在空气中变质。

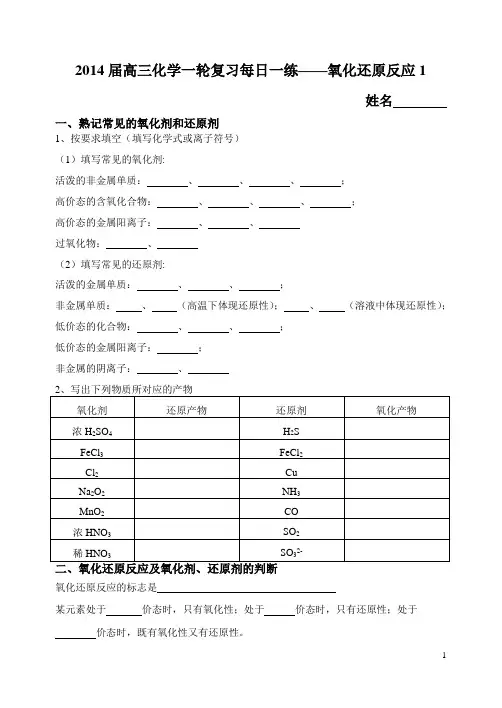
2014届高三化学一轮复习每日一练——氧化还原反应1姓名一、熟记常见的氧化剂和还原剂1、按要求填空(填写化学式或离子符号)(1)填写常见的氧化剂:活泼的非金属单质:、、、;高价态的含氧化合物:、、、;高价态的金属阳离子:、、过氧化物:、(2)填写常见的还原剂:活泼的金属单质:、、;非金属单质:、(高温下体现还原性);、(溶液中体现还原性);低价态的化合物:、、;低价态的金属阳离子:;非金属的阴离子:、氧化还原反应的标志是某元素处于价态时,只有氧化性;处于价态时,只有还原性;处于价态时,既有氧化性又有还原性。
练习:1.下列反应中,不属于氧化还原反应的是 ( )A .3Cl 2+6KOH = 5KCl +KClO 3+3H 2OB .2NO 2十2NaOH = NaNO 3+NaNO 2+H 2OC .SnCl 4+2H 2O = SnO 2+4HClD .3CCl 4+K 2Cr 2O 7 = 2CrO 2Cl 2+3COCl 2+2KCl2. 下列反应属于非氧化还原反应的是 ( )A .Fe 2O 3+3CO 高温=2Fe +3CO 2B .NH 4NO 3△ =N 2O↑十2H 2OC .2NaHCO 3△ =Na 2CO 3+CO 2↑十H 2OD .Cu 2(OH)2CO 3△ =2CuO +CO 2↑+H 2O3.下列反应中,CO 2作氧化剂的是 ( )A .Ca(OH)2+CO 2 = CaCO 3↓+H 2OB .CO 2+C 高温=2COC .2Fe 2O 3+3C 高温=4Fe +3CO 2↑D .C +2H 2O △ =2H 2+CO 24. 下列反应中,水作还原剂的是 ( )A .2Na +2H 2O = 2NaOH +H 2↑B .Cl 2+H 2O = HCl +HClOC .2F 2+2H 2O = 4HF +O 2D .SO 2+H 2O = H 2SO 35.在下列反应中, HCl 作氧化剂的是 ( )A .NaOH+HCl = NaCl+H 2OB .Zn+2HCl = ZnCl 2+H 2↑C .MnO 2+4HCl (浓) △ = MnCl 2+2H 2O+Cl 2↑D .CuO+2HCl = CuCl 2+H 2O6.下列各粒子中既具有氧化性又具有还原性的是 ( )A.AlB.Cl -C.Cu 2+D.Fe 2+7. 只具有还原性的离子是( ); 既有氧化性又有还原性的离子是( )A. Cu 2+B. NO 3—C. Br —D. SO 32-8.下列变化需要加入还原剂才能实现的是 ( )A .MnO 4-→Mn 2+B .HCl→Cl 2C .Fe→Fe 3+D .KClO 3→O 2 9.下列反应中必须加入还原剂才能进行的是 ( )A .Cl 2→Cl -B .Zn→ Zn 2+C .H2→H 2OD .CuO→CuCl 2 10.P 单质在反应4P +3KOH +3H 2O = 3KH 2PO 2+PH 3中是 ( )A .被氧化 B.被还原 C.既被氧化又被还原 D.既未被氧化又未被还原11.一定条件下,氨气与一氧化氮发生反应:NH 3 + NO N 2 + H 2O (未配平)。


2009届高三化学各地月考试题汇编:氧化还原反应(2)1、 (郑州二中09学年高三10月份月考 )(8分)市场销售的某种食用精制盐包装袋上有如下说明(部分):(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):3KIO + KI + SO H 24 = 42SO K + 2I + O H 2(2)上述反应生成的2I 可用四氯化碳检验。
向碘的四氯化碳溶液中加入32SO Na 稀溶液,将2I 还原,以回收四氯化碳。
①32SO Na 稀溶液与2I 反应的离子方程式是②某学生设计回收四氯化碳的操作步骤为:a 、将碘的四氯化碳溶液置于分液漏斗中;b 、加入适量32SO Na 稀溶液;c 、分离出下层液体。
以上设计中遗漏的操作及在上述操作中的位置是(3)已知:---+=+264232222O S I O S I 某学生测定食用精制盐的碘含量,其步骤为:a 、准确称取g 7.12食盐,加适量蒸馏水使其完全溶解;b 、用稀硫酸酸化所得溶液,加入足量KI 溶液,使食用盐中3KIO 与KI 反应完全;c 、以淀粉溶液为指示剂,逐滴加入物质的量浓度为L mol /100.64-⨯的322O S Na 溶液mL 0.20,恰好反应完全。
①判断c 中反应恰好完全依据的现象是②根据以上实验和包装说明,所测精盐的碘含量是 kg mg /答案:.(1)1、5、3、3、3、3 (2分)。
(2)①I 2+SO 32-+H 2O = 2I -+SO 42 - +2H +(2分);②在步骤b 后,增加操作:将分液漏斗充分振荡后静置(1分)。
(3)①溶液由蓝色恰好变为无色(1分)。
②20(2分)2.(郑州二中09学年高三10月份月考 ) (6分)(1)已知氢氧化铁可以被次氯酸钠氧化成FeO 4n -,当3.21gFe(OH)3参加反应时,反应中共转移了0.09mol 电子,则n 。
(2)根据上题推断结果,配平下列离子方程式:[ ]Fe(OH)3+ [ ]ClO - + [ ]OH -—— [ ]FeO 4n -+[ ]Cl -+[ ]H 2O(3)结合以上反应,推测FeO 4n -能与下列哪些物质反应(填序号) 。

江苏省响水中学2014届高三化学一轮复习学案:第7课时氧化还原反应2[考纲要求]: 1.能配平氧化还原反应方程式,学会表示电子转移的方向和数目;2.运用电子得失守恒原理在化学计算等方面的应用。
[典题拓展]:1.(08天津卷)(1)配平氧化还原反应方程式:__ C2O42-+__MnO4-+__H+=__CO2+__Mn2++__H2O(2)称取6.0 g含H2C2O4·2H2O、KOH、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。
量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。
该溶液被中和的H+的物质的量为____mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由___变为___。
该溶液中还原剂的物质的量为____mol。
③原试样中H2C2O4·2H2O的质量分数为____。
KHC2O4的质量分数为_____2.在100ml溴化亚铁溶液中通入2.24L氯气(标况),若有三分之一的溴离子被氧化,求:(1)原溴化亚铁溶液的物质的量浓度为。
(2)写出该反应的离子方程式。
3.14g铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标准状况)氧气混合,通入水中,恰好被全部吸收,则合金中铜的质量为多少?[巩固练习]4.已知:2Fe3++2I—== 2Fe2++I2 , 2 Fe2+ +Br2==2 F e3+ + 2Br—,(1)含有1molFeI2和2molFeBr2的溶液通入2molCl2,此时被氧化的离子是,被氧化的离子的物质的量分别是。
(2)如果向原溶液中通入3molCl2,则被氧化的离子是,被氧化的离子的物质的量分别是。
5.MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。
某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:(1)第①步加稀H2SO4时,粗MnO2样品中的(写化学式)转化为可溶性物质。

考纲定位要点网络1.了解氧化还原反应的本质。
2.了解常见的氧化还原反应。
根据化学式判断元素化合价。
3.掌握常见氧化还原反应的配平和相关计算。
4.能正确书写氧化还原化学方程式和离子方程式。
氧化还原反应的概念与本质1.本质和特征2.相关概念及其关系3.两种电子转移的表示方法(1)双线桥法:标变价―→画箭头―→标得失―→定数目。
示例:C与浓硫酸反应:(2)单线桥法:箭头由失电子原子指向得电子原子、线桥上只标电子转移的数目、不标“得到”“失去”字样。
===氧化产物+还原产物示例:Cu与浓硝酸反应:===Cu(NO3)2+2NO2↑+2H2O。
提醒:四种基本反应类型和氧化还原反应的关系4.常见的氧化剂和还原剂(1)常见氧化剂常见氧化剂包括某些非金属单质、含有高价态元素的化合物等。
如:(1)在氧化还原反应中、非金属单质不一定只作氧化剂;金属单质一定作还原剂。
(2)某元素由化合态变为游离态、该元素可能被氧化也可能被还原。
(3)在氧化还原反应中、若有一种元素被氧化、则不一定有另一种元素被还原、也可能同一元素既被氧化又被还原。
(4)某元素的化合价越高、氧化性不一定越强。
(5)金属阳离子不一定只具有氧化性、如Fe 2+。
[基础判断](1)氧化还原反应中的反应物、不是氧化剂就是还原剂。
( ) (2)NaHCO 3+H 2===HCOONa +H 2O 的反应中、NaHCO 3被氧化。
( ) (3)Na 2O 2与H 2O 反应、NO 2与H 2O 反应中氧化剂与还原剂均为一种物质。
( )(4)在Cl 2+2NaOH===NaCl +NaClO +H 2O 反应中、1 mol Cl 2 反应转移2 mol e -。
( )(5)HNO 3作氧化剂时还原产物可能为NO 、NO 2、N 2O 4、N 2等。
( ) [答案] (1)× (2)× (3)√ (4)× (5)√ [知识应用]1.对于反应:MnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O 、 (1)生成1 mol Cl 2、被氧化的HCl 为________mol 、转移电子数为________(用N A 表示阿伏加德罗常数的值)。

氧化还原反应1.(2020年宁夏青铜峡高级中学高三月考)物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。
现有下列各组物质:①Cu和HNO3溶液;②Cu和FeCl3溶液;③Zn与H2SO4溶液;④Fe和HCl溶液。
其中由于浓度不同而能发生不同氧化还原反应的是( )。
A.③④B.①③C.①②D.①③④1.B 解析Cu与HNO3溶液反应时,若为浓硝酸,发生反应Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O,若为稀硝酸,则发生反应3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O,与浓度有关,①正确;Cu与FeCl3溶液发生反应Cu+2FeCl32FeCl2+CuCl2,与浓度无关,②错误;Zn与H2SO4溶液反应时,若为稀硫酸,发生反应Zn+H2SO4(稀)ZnSO4+H2↑,若为浓硫酸,则发生反应Zn+2H2SO4(浓)ZnSO4+SO2↑+2H2O,与浓度有关,③正确;④Fe与HCl溶液发生反应Fe+2HCl FeCl2+H2↑,与浓度无关,④错误,故B项符合题意。
2.(2019年吉林延边二中高三考试)下列是从海藻灰和智利硝石矿层中提取碘的主要反应:①2NaI+MnO2+3H2SO42NaHSO4+MnSO4+2H2O+I2 ;②2NaIO3+5NaHSO32Na2SO4+3NaHSO4+H2O+I2。
下列说法正确的是( )。
A.氧化性:MnO2>S O42−>I O3->I2B.I2在反应①中是还原产物,在反应②中是氧化产物C.反应①②中生成等量的I2时,转移电子数之比为1∶5D.NaHSO3溶液呈酸性,NaHSO3溶液中c(HS O3-)>c(H2SO3)>c(S O32−)2.C 解析氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,反应①中MnO2>I2, 反应②中I O3->S O42−,A项错误;在反应①中,I元素化合价升高,被氧化,I2为氧化产物,在反应②中,I元素化合价降低,被还原,I2为还原产物,B项错误;反应①②中生成等量的I2时,假设都为1 mol,则反应①转移2 mol电子,反应②转移10 mol电子,则转移电子数之比为1∶5,C项正确;NaHSO3溶液呈酸性,则HS O3-的电离程度大于水解程度,所以c(S O32−)>c(H2SO3),则c(HS O3-)>c(S O32−)>c(H2SO3),D项错误。
第⼆讲氧化还原反应及其应⽤(⾼三复习学案、教案与习题⼤全)第⼆讲氧化还原反应及其应⽤主讲⼈车琳⾼考考点1,理解氧化还原反应,了解氧化剂和还原剂等概念2,掌握重要氧化剂、还原剂之间的常见反应3,熟练掌握氧化性和还原性强弱4,能判断氧化还原反应中电⼦转移的⽅向和数⽬,并能配平反应⽅程式5,能运⽤元素守恒、电⼦守恒、电荷守恒,进⾏氧化还原反应计算6、掌握原电池、电解池原理,能熟练书写电极反应式和电池总反应式。
7、理解化学腐蚀和电化腐蚀原理。
本讲序列【阅读议点】⼀、氧化还原反应的基本概念(请研读教材,梳理以下概念)1、什么是氧化还原反应?2、什么是氧化剂?什么是还原剂?什么是氧化产物?什么是还原产物?3、氧化还原的实质是:4、氧化还原反应的特征是:5、电⼦转移的表⽰⽅法有:⼆、如何⽐较氧化性和还原性的相对强弱?⒈同⼀氧化还原反应中,氧化性:氧化剂>氧化产物(当然的,氧化剂>还原剂)还原性:还原剂>还原产物(当然的,还原剂>氧化剂)⒉根据元素周期表,同周期元素的单质(或原⼦)从左到右还原性渐弱,氧化性渐强(稀有⽓体元素除外),同主族元素单质(或原⼦)从上到下还原性渐强,氧化性渐弱。
例如,氧化性:F2>Cl2>Br2>I2>S(含常识性知识)还原性:Na相应简单离⼦的还原性:F-K+>Rb+>Cs+⒊根据⾦属活动顺序:K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au还原性渐弱K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+Pb2+(H+)Cu2+ Fe3+ Ag+氧化性渐强⒋据原电池电极:负极⾦属⼀般⽐正极⾦属活泼(还原性强)。
思考:有没有例外情况?请举例,并画出装置图?⒌同种元素价态越⾼,氧化性越强(如Fe3+>Fe2+),但例外地,氧化性:HClO>HClO2>HClO3>HClO4,元素化合价处于最⾼价态时只有氧化性;价态越低,还原性越强(如S2->S>SO2),最低价态只有还原性;中间价态兼具氧化性和还原性。
高三化学氧化还原反应1、氧化还原反应(1)定义:凡有电子转移(电子得失或共用电子对偏移)的反应叫氧化还原反应。
(2)特征:反应前后元素的化合价发生改变。
(3)实质:有电子转移。
判断一个反应是否是氧化还原反应,关键要看反应前后元素的化合价是否发生改变。
思考:有单质生成的反应一定是氧化还原反应吗?2、基本概念及其之间的关系氧化剂:得到电子(或元素化合价降低)的物质还原剂:失去电子(或元素化合价升高)的物质氧化反应:失去电子(或元素化合价升高)的反应还原反应:得到电子(或元素化合价降低)的反应氧化性:物质得到电子的能力或性质还原性:物质失去电子的能力或性质氧化产物:还原剂被氧化后所对应的产物还原产物:氧化剂被还原后所对应的产物基本概念之间的关系:氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物3、电子转移的表示方法(1)单线桥法。
从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。
例:2e-—MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(2)双线桥法。
得失电子分开注明,从反应物指向生成物(同种元素)注明得失及电子数。
例:得2e-——MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O失2e-——注意两类特殊的化学反应。
①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。
例:—1 0 +5 —1 0 +5 3Cl 2+6KOH KClO 32O②归中反应。
不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。
例:KClO 3+6HCl 3Cl 2+ 6KCl ↑ +3H 2O Cl Cl Cl若理解为右图则错了。
Cl Cl Cl4、氧化还原反应方程式的配平(1)配平依据:化合价升降总数相等或电子转移总数相等。
第二章化学物质及其变化第06讲氧化还原反应(精讲)【考情分析】本讲内容在高考的考查方向主要有两个:①考查氧化还原反应相关概念、氧化还原反应规律,新课标卷近五年共计考查1次,其他的地区的高考试卷对本部分考查较多。
②氧化还原反应方程式的书写与配平和有关氧化还原反应的计算,新课标卷近五年共计考查6次。
题型有选择题和填空题两种形式,以填空题为主,试题难度偏大。
【核心素养分析】证据推理与模型认知:建立氧化还原反应的观点,掌握氧化还原反应的规律,结合常见的氧化还原反应理解有关规律;通过分析、推理等方法认识氧化还原反应的特征和实质,建立氧化还原反应计算和配平的思维模型。
科学探究与创新意识:认识科学探究是进行科学解释和发现。
创造和应用的科学实践活动;能从氧化还原反应的角度,设计探究方案,进行实验探究,加深对物质氧化性、还原性的理解。
【网络构建】【知识梳理】知能点一氧化还原反应的相关概念及其表示方法1.氧化还原反应的本质和特征2.基于双线桥理解氧化还原反应概念之间的关系规律总结:分析电子转移数目的关键——标出元素化合价(1)基本方法:先标出熟悉元素的化合价,再根据化合物中正负化合价的代数和为零的原则求解其他元素的化合价。
(2)熟记常见元素的化合价:一价氢、钾、钠、氟、氯、溴、碘、银;二价氧、钙、钡、镁、锌;三铝、四硅、五价磷;说变价也不难,二三铁、二四碳、二四六硫都齐全;铜汞二价最常见。
(3)明确一些特殊物质中元素的化合价:CuFeS 2:Cu +2、Fe +2、S -2;K 2FeO 4:Fe +6;Li 2NH 、LiNH 2、AlN :N -3;Na 2S 2O 3:S +2;MO +2:M +5;C 2O 2-4:C +3;HCN :C +2、N -3;CuH :Cu +1、H -1;FeO n -4:Fe +8-n;Si 3N 4:Si +4、N -3。
概括为“氧、氧、得、降、还、还、还”。
3.电子转移的表示方法请分别用单线桥法和双线桥法表示Cu 与稀硝酸反应中电子转移的方向和数目: (1)双线桥法注意事项a .箭头从失电子元素的原子指向得电子元素的原子。